在脓毒症发病机制中,由于全身炎症反应,全身毛细血管通透性增加、毛细血管的液体和低分子蛋白渗漏,致全身有效循环容量不足和氧输送降低[1]。在脓毒症期间,组织氧需求增高,器官功能取决于氧输送是否能满足组织的需求。动态监测氧代谢指标能更好反映组织缺氧及组织灌注,更有利于指导脓毒性休克液体复苏及治疗[2]。目前研究表明,单独测定乳酸(lactic acid, Lac)或中心静脉血氧饱和度(central venous oxygen saturation, ScvO2)不能准确反映组织缺氧及灌注情况,本文就乳酸及乳酸清除率、中心静脉血氧饱和度联合静动脉二氧化碳分压差(central venous-arterial carbon dioxide partial pressure difference, CO2 gap)在脓毒性休克患者血氧代谢变化中的临床意义进行综述,为脓毒性休克患者的治疗及预后判断提供依据。
1 乳酸及乳酸清除率人体内乳酸的产生来自于乳酸脱氢酶对丙酮酸的降解,在生理状态下不会形成乳酸堆积,动脉血乳酸正常水平为1.0±0.5 mmol/L;但在缺血、缺氧情况下,丙酮酸在体内迅速聚集并几乎完全转化为乳酸,细胞内乳酸迅速增加,并快速分布至血液中。血乳酸水平升高是组织灌注和氧输送不足的敏感生化指标[3]。脓毒性休克最新定义将动脉血乳酸水平 > 2.0 mmol/L作为一个诊断条件,强调了血乳酸水平升高是提示病情危重及组织低灌注的一个独立指标[4]。
Mikkelsen等[5]在一项830例严重脓毒症及脓毒性休克患者的前瞻性研究中,将所有病例分为休克组和非休克组,然后再将两组各分为3个亚组:低乳酸组( < 2.0 mmol/L)、中间组(2.0~3.9 mmol/L)和高乳酸组( > 4.0 mmol/L);在非休克或者休克病人中,中间组和高乳酸组的乳酸浓度均与死亡率相关,而且动脉血乳酸水平 > 4.0 mmol/L的患者预后更差。
另一项随机对照研究将243例严重脓毒症及脓毒性休克患者分为持续乳酸监测组和非监测组,结果表明:液体复苏后乳酸水平降至正常的患者预后更好,持续乳酸监测组需要更多晶体液复苏、更长时间的中心静脉血氧饱和度监测、28天病死率较低[6]。
血乳酸浓度反映乳酸生成、清除、转化及利用的综合情况,动态监测乳酸的变化将更好地预测脓毒性休克患者的严重程度、液体复苏效果及预后,并提出乳酸清除率的概念,即脓毒性休克初期液体复苏6 h的乳酸下降百分率,临界值为10%[7-8]。
乳酸清除率=(复苏前乳酸浓度-复苏后乳酸浓度)/复苏前乳酸浓度×100%。
研究表明[9],将乳酸清除率 > 10%作为液体复苏的目标可以显著提高生存率。一项针对PICU脓毒症患者的研究[10]发现,24 h乳酸清除率≥10%组的病死率为72%,< 10%组的病死率为83%,认为乳酸清除率 < 10%是死亡的独立危险因素。另一项研究[11]统计94例脓毒性休克患者的初始血乳酸水平及复苏3 h、6 h、24 h的乳酸清除率,根据28 d的病死率分为存活组和死亡组,结果存活组的乳酸清除率明显高于死亡组、血乳酸水平低于死亡组。
及时液体复苏,改善组织低灌注状态,尽早使血乳酸水平恢复正常以恢复机体氧供与氧耗的平衡是脓毒性休克治疗的目标[12]。然而,乳酸作为最常用的反映组织灌注的氧代谢指标,缺陷在于非休克因素如药物、癫癎、中毒、线粒体功能障碍等也可导致乳酸增高。而乳酸清除又依赖于肝脏代谢,乳酸清除率对于慢性肝病患者的应用受到限制。因此,需结合患者自身情况并联合其他氧代谢指标,才能更准确判断病情严重程度及预后。
2 中心静脉血氧饱和度混和静脉血氧饱和度(mixed venous oxygen saturation, SvO2)即测定混合静脉血中血红蛋白的氧饱和程度,可反映全身氧合情况,已作为早期目标导向治疗(early goal-directed therapy, EGDT)复苏的初始目标[13]。SvO2测定需借助肺漂浮(Swan-Ganz)导管监测肺动脉血的血氧饱和度,但操作复杂、有创,应用受到限制。大量研究证实,ScvO2与SvO2具有相关性[14]。ScvO2测定是从颈内静脉置管,于上腔静脉采血进行血气分析,记录血氧饱和度,操作简单,费用及风险均较低。但ScvO2监测的是上腔静脉的氧饱和度,反映上半身包括脑循环及双上肢的氧合情况,ScvO2的精确性也不如SvO2,SvO2可低于ScvO2约16%[15]。
一项关于脓毒性休克的回顾性研究[16]将120名患儿分为ScvO2监测组和对照组(未进行ScvO2监测),ScvO2监测组于第1、3、6 h进行ScvO2测定以指导液体复苏,对照组根据临床经验进行复苏,结果ScvO2监测组28天的病死率低于对照组。
有研究证明,无论儿童还是成人,早期ScvO2 < 70%与病死率增加有关[17]。2010年一项关于脓毒性休克液体复苏的研究[18]对619例脓毒性休克患者按照EGDT方案进行复苏,根据初始ScvO2水平分为低氧组(ScvO2≤70%)、氧正常组(ScvO2 71%~89%)、高氧组(ScvO2≥90%),3组病死率分别为40%、21%、34%,说明ScvO2降低与异常增高都与病死率增加相关。
ScvO2不仅能反映呼吸功能和氧合状态,也可以反映循环变化,是组织氧利用的一个综合标志,已被广泛用于组织氧合及代谢情况的判断,在一定程度上能够反映全身氧输送与氧消耗的关系。但严重感染、休克、创伤、心脏外科手术患者,全身炎症反应综合征致微循环障碍、毛细血管分流、血流分布异常甚至线粒体功能障碍,细胞无法利用氧,此时虽然氧输送下降,但ScvO2仍可能≥70%[19]。Textoris等[20]回顾性分析152例脓毒性休克患者,均按照国际复苏指南进行复苏,发现患者病死率与休克初期72 h内最高ScvO2值相关。另一项研究[21]统计脓毒性休克患者液体复苏1~4 h后ScvO2和乳酸清除率的变化情况,发现ScvO2没有显著变化、乳酸进行性下降、乳酸清除率升高,但ScvO2 > 85%的乳酸浓度最高。
因此,单纯ScvO2不能充分反映组织缺氧情况及病情严重程度,需要联合其他氧代谢指标才能更好地反映患者氧合及灌注情况。
3 静动脉二氧化碳分压差 3.1 CO2 gap的定义二氧化碳在血液中主要以物理溶解、碳酸氢盐以及与蛋白质结合生成碳胺基化合物的三种形式存在。溶解于血液中的二氧化碳即为二氧化碳分压(PCO2),静脉血二氧化碳分压高于动脉血二氧化碳分压,二者的差值称为静-动脉二氧化碳分压差(正常值一般 < 6 mm Hg)。在生理状态下,CO2含量(CCO2)与PCO2基本上成线性关系(PCO2=k×CCO2),所以可以用PCO2来取代CCO2。根据Fick定律,CO2产生总量(VCO2)=心输出量×(混合静脉血CO2含量-动脉血CO2含量),当用CO2分压取代CO2含量时,公式转变为:VCO2=心输出量×(混合静脉血CO2分压-动脉血CO2分压)/k;CO2 gap=k×VCO2/心输出量。由此得出,CO2 gap与k因子、VCO2及心输出量(cardiac output, CO)有关[22]。
3.2 CO2 gap的影响因素在正常情况下,VCO2与机体的氧耗(VO2)有关:VCO2=R×VO2。R是呼吸商(0.7~1.0之间波动),取决于机体代谢情况。当脂肪作为主要供能物质时,R接近0.7;当以葡萄糖为主要能源时,R接近1.0。当氧耗恒定不变时,机体利用葡萄糖供能比利用脂肪供能产生的CO2多。因此,究竟CO2的产生是由氧耗增加引起还是过多摄入碳水化合物导致也是争论的焦点[23]。但在机体氧需求减少或者缺氧时,CO2的产生会减少。
根据Fick公式,CO2 gap与CO成反比,它们之间的关系可以用VCO2曲线表示(图 1[37])。由CO降低所致的CO2 gap升高可以用二氧化潴留解释,CO下降致全身血流量不足并组织低灌注而不足以清除血液中的CO2,最终CO2潴留、CO2分压差升高;但在有自主呼吸的情况下,血流量减少使得呼吸加快、通气量增加、动脉血二氧化碳分压下降,因此可以不出现二氧化碳的潴留及静脉血二氧化碳分压增高。因此,在有自主呼吸的情况下,CO2 gap比单纯测定静脉血二氧化碳分压更有意义。总之,在通气充足、排除低代谢需求的情况下,CO降低会引起CO2 gap增高( > 6 mm Hg)[24]。
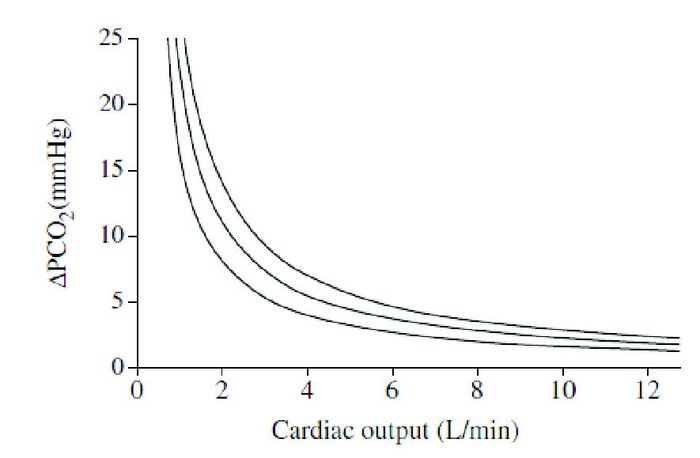
|
图 1 心输出量和静动脉CO2分压差的关系 当心输出量处在较低范围时,静动脉CO2分压差随心输出量增大而增高;当心输出量处在正常或较高范围时,静动脉CO2分压差基本处在正常范围。这种曲线型变化是基于恒定的CO2产生总量,当机体缺氧导致CO2总量降低时,CO2总量的等值线相应左移,以减弱静动脉CO2分压差的变化。 |
CO2由有氧呼吸和无氧酵解共同产生,有氧呼吸产生的CO2更多,机体缺氧情况下CO2的产生是减少的[25]。根据Fick公式,k=CO2 gap×CO/VCO2,在正常生理状态下,可以假设k值是不变的;但组织缺氧时,k值升高,VCO2会降低。因此,决定CO2 gap变化的是CO,组织缺氧根据CO是否减少分为:(1)CO减少型组织缺氧,组织缺氧同时伴有CO降低,到达全身器官的血流量相应减少,此时即使CO2的产生减少,但低血流量导致血液中CO2无法正常清除,从而CO2 gap可仍增高。Bakker等[26]对64名脓毒性休克患者进行研究,仅15例患者CO2 gap升高( > 6 mm Hg),这些患者的CO较CO2 gap正常的患者低,证明CO2 gap的升高与CO成反比;然而,CO2 gap升高的患者与CO2 gap正常的患者有着相似的VO2和血乳酸水平。因此,除了那些CO降低的脓毒性休克患者,CO2 gap在监测组织缺氧方面通常是不敏感的。(2)CO正常型组织缺氧:当CO正常时,机体可以将血液中的CO2正常清除,CO2 gap不升高。因此CO2 gap正常并不能排除组织缺氧,不能作为反映组织缺氧的指标。
3.3 CO2 gap的临床应用研究发现,CO2 gap对于指导脓毒性休克液体复苏、病情程度及预后判断具有重要价值[27]。EGDT方案的复苏目标已经不利于准确判断组织灌注情况。研究显示,当休克患者的ScvO2 > 70%,机体仍可能存在灌注不足,此时CO2 gap恰好可弥补这一缺陷,给临床治疗提供指导[28]。
Ospina-Tascón等[29]根据入院时(T0)及复苏6 h(T6)后的CO2 gap将脓毒性休克患者分为4组:CO2 gap持续升高组(T0高、T6高)、CO2 gap升高组(T0正常、T6高)、CO2 gap下降组(T0高、T6正常)、CO2 gap正常组(T0正常、T6正常),发现持续升高组和升高组的第3天序贯器官衰竭评分更高,28天病死率更高;复苏成功后ScvO2 ≥70%但CO2 gap持续升高的患者病死率更高。另一项研究将46例脓毒性休克患者分为CO2 gap正常和增高组,发现CO2 gap增高组的心脏指数和ScvO2较低[30]。Mallat等[31]也发现心脏指数和CO2 gap具有相关性,且复苏后CO2 gap恢复正常的病人乳酸浓度和Sofa评分下降更快。有报道[32]对CO2 gap升高与正常的脓毒性休克患者病死率(29%/21%)做对比,得出结论:CO2 gap≥6 mm Hg提示预后不良。Du等[33]将172例脓毒性休克患者(按照EGDT方案治疗)按照复苏6 h后的ScvO2和CO2 gap分组,发现ScvO2 < 70%和ScvO2 ≥70%组的死亡率分别为50%和29.5%(P=0.009),而ScvO2≥70%的病人中CO2 gap < 6 mm Hg者比CO2 gap ≥6 mm Hg的死亡率低(56.1% /16.1%,P < 0.001)。提示CO2 gap联合ScvO2比单独ScvO2能更好地判断预后。2014年陈容欣等[34]对48例脓毒性休克患儿进行液体复苏,发现低CO2 gap组病死率低于高CO2 gap组;复苏24 h后,低CO2 gap组的24 h乳酸清除率较高。2012年一项多中心研究[35]发现,ScvO2 ≥70%但Lac < 10%的脓毒性休克患者死亡率远高于ScvO2 < 70%但Lac≥10%的患者(41% vs 8%)。
因此,CO2 gap升高是脓毒性休克患者ScvO2下降的独立预测指标,并可评估液体复苏效果[36]。
4 结语综上所述,乳酸及乳酸清除率、ScvO2及CO2 gap对于指导脓毒性休克患者液体复苏及判断组织缺氧具有重要意义,联合应用这三个指标可在一定程度上避免单一氧代谢指标缺陷导致的假象,更有利于对脓毒性休克病情的准确判断及合理治疗。
| [1] |
Kumar A. An alternate pathophysiologic paradigm of sepsis and septic shock:Implications for optimizing antimicrobial therapy[J]. Virulence, 2014, 5(1): 80-97. DOI:10.4161/viru.26913 (  0) 0) |
| [2] |
Saugel B, Huber W, Nierhaus A, et al. Advanced hemodynamic management in patients with septic shock[J]. Biomed Res Int, 2016, 2016(2): 8268569. (  0) 0) |
| [3] |
Ranzani OT, Monteiro MB, Ferreira EM, et al. Reclassifying the spectrum of septic patients using lactate:severe sepsis, cryptic shock, vasoplegic shock and dysoxic shock[J]. Rev Bras Ter Intensiva, 2013, 25(4): 270-278. (  0) 0) |
| [4] |
Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign:International Guidelines for Management of Sepsis and Septic Shock:2016[J]. Crit Care Med, 2017, 45(3): 486-552. DOI:10.1097/CCM.0000000000002255 (  0) 0) |
| [5] |
Mikkelsen ME, Miltiades AN, Gaieski DF, et al. Serum lactate is associated with mortality in severe sepsis independent of organ failure and shock[J]. Crit Care Med, 2009, 37(5): 1670-1677. DOI:10.1097/CCM.0b013e31819fcf68 (  0) 0) |
| [6] |
Dettmer M, Holthaus CV, Fuller BM. The impact of serial lactate monitoring on emergency department resuscitation interventions and clinical outcomes in severe sepsis and septic shock:an observational cohort study[J]. Shock, 2015, 43(1): 55-61. DOI:10.1097/SHK.0000000000000260 (  0) 0) |
| [7] |
王涛, 夏永富, 郝东, 等. 乳酸在脓毒性休克早期诊断及目标导向治疗中的意义[J]. 中华危重病急救医学, 2014, 26(1): 51-55. (  0) 0) |
| [8] |
Jasso-Contreras G, González-Velázquez F, Bello-Aguilar L, et al. Lactate levels as a predictor of mortality in patients with septic shock[J]. Rev Med Inst Mex Seguro Soc, 2015, 53(3): 316-321. (  0) 0) |
| [9] |
吕晓春, 许强宏, 蔡国龙, 等. ScvO2联合乳酸清除率指导脓毒症休克患者的容量复苏[J]. 中华医学杂志, 2015, 95(7): 496-500. (  0) 0) |
| [10] |
Choudhary R, Sitaraman S, Choudhary A. Lactate cleanrance as the predictor of outcome in pediatric septic shock[J]. J Emerg Trauma Shock, 2017, 10(2): 55-59. DOI:10.4103/JETS.JETS_103_16 (  0) 0) |
| [11] |
包磊, 张敏, 颜培夏, 等. 动脉血乳酸及其清除率预测感染性休克患者预后的回顾性研究[J]. 中华危重病急救医学, 2015, 27(1): 38-42. (  0) 0) |
| [12] |
Hernández G, Tapia P, Alegría L, et al. Effects of dexmedetomidine and esmolol on systemic hemodynamics and exogenous lactate clearance in early experimental septic shock[J]. Crit Care, 2016, 20(1): 234. DOI:10.1186/s13054-016-1419-x (  0) 0) |
| [13] |
Gupta RG, Hartigan SM, Kashiouris MG, et al. Early goal-directed resuscitation of patients with septic shock:current evidence and future directions[J]. Critl Care, 2015, 19(1): 286. DOI:10.1186/s13054-015-1011-9 (  0) 0) |
| [14] |
Maddirala S, Khan A. Optimizing hemodynamic support in septic shock using central and mixed venous oxygen saturation[J]. Crit Care Clin, 2010, 26(2): 323-333. DOI:10.1016/j.ccc.2009.12.006 (  0) 0) |
| [15] |
Christensen M. Mixed venous oxygen saturation monitoring revisited:thoughts for critical care nursing practice[J]. Aust Crit Care, 2012, 25(2): 78-90. DOI:10.1016/j.aucc.2011.10.001 (  0) 0) |
| [16] |
Sankar J, Sankar MJ, Suresh CP, et al. Early goal-directed therapy in pediatric septic shock:comparison of outcomes "with" and "without" intermittent superior venacaval oxygen saturation monitoring:a prospective cohort study[J]. Pediatr Crit Care Med, 2014, 15(4): e157-e167. DOI:10.1097/PCC.0000000000000073 (  0) 0) |
| [17] |
Boulain T, Garot D, Vignon P, et al. Prevalence of low central venous oxygen saturation in the first hours of intensive care unit admission and associated mortality in septic shock patients:a prospective multicentre study[J]. Crit Care, 2014, 18(6): 609. DOI:10.1186/s13054-014-0609-7 (  0) 0) |
| [18] |
Pope JV, Jones AE, Gaieski DF, et al. Multicenter study of central venous oxygen saturation (ScvO2) as a predictor of mortality in patients with sepsis[J]. Ann Emerg Med, 2010, 55(1): 40-46. DOI:10.1016/j.annemergmed.2009.08.014 (  0) 0) |
| [19] |
Shin TG, Jo IJ, Hwang SY, et al. Comprehensive interpretation of central venous oxygen saturation and blood lactate levels during resuscitation of patients with severe sepsis and septic shock in the emergency department[J]. Shock, 2016, 45(1): 4-9. DOI:10.1097/SHK.0000000000000466 (  0) 0) |
| [20] |
Textoris J, Fouché L, Wiramus S, et al. High central venous oxygen saturation in the latter stages of septic shock is associated with increased mortality[J]. Crit Care, 2011, 15(4): R176. DOI:10.1186/cc10325 (  0) 0) |
| [21] |
Permpikul C, Noppakaorattanamanee K, Tongyoo S, et al. Dynamics of central venous oxygen saturation and serum lactate during septic shock resuscitation[J]. J Med Assoc Thai, 2013, 96(Suppl 2): S232-S237. (  0) 0) |
| [22] |
Kipnis E, Ramsingh D, Bhargava M, et al. Monitoring in the intensive care[J]. Crit Care Res Pract, 2012, 2012: 473507. (  0) 0) |
| [23] |
Mookerjee SA, Goncalves RL, Gerencser AA, et al. The contributions of respiration and glycolysis to extracellular acid production[J]. Biochim Biophys Acta, 2015, 1847(2): 171-181. DOI:10.1016/j.bbabio.2014.10.005 (  0) 0) |
| [24] |
Wittayachamnankul B, Chentanakij B, Sruamsiri K, et al. The role of central venous oxygen saturation, blood lactate, and central venous-to-arterial carbon dioxide partial pressure difference as a goal and prognosis of sepsis treatment[J]. J Crit Care, 2016, 36: 223-229. DOI:10.1016/j.jcrc.2016.08.002 (  0) 0) |
| [25] |
Mallat J, Lemyze M, Tronchon L, et al. Use of venous-to-arterial carbon dioxide tension difference to guide resuscitation therapy in septic shock[J]. World J Crit Care Med, 2016, 5(1): 47-56. DOI:10.5492/wjccm.v5.i1.47 (  0) 0) |
| [26] |
Bakker J, Vincent JL, Gris P, et al. Veno-arterial carbon dioxide gradient in human septic shock[J]. Chest, 1992, 101(2): 509-515. DOI:10.1378/chest.101.2.509 (  0) 0) |
| [27] |
Ospinatascón-Tascón GA, Umaña M, Bermúdez W, et al. Combination of arterial lactate levels and venous-arterial CO2 to arterial-venous O2 content difference ratio as markers of resuscitation in patients with septic shock[J]. Intensive Care Med, 2015, 41(5): 796-805. DOI:10.1007/s00134-015-3720-6 (  0) 0) |
| [28] |
Naumann DN, Midwinter MJ, Hutchings S. Venous-to-arterial CO2 differences and the quest for bedside point-of-care monitoring to assess the microcirculation during shock[J]. Ann Transl Med, 2016, 4(2): 37. (  0) 0) |
| [29] |
Ospina-Tascón GA, Bautista-Rincón DF, Umaña M, et al. Persistently high venous-to-arterial carbon dioxide differences during early resuscitation are associated with poor outcomes in septic shock[J]. Crit Care, 2013, 17(6): R294. DOI:10.1186/cc13160 (  0) 0) |
| [30] |
Mallat J, Salaun P, Gasan G, et al. Veno-arterial carbon dioxide gradient at the early stage of septic shock[J]. Crit Care, 2010, 14(S1): P156. (  0) 0) |
| [31] |
Mallat J, Pepy F, Lemyze M, et al. Central venous-to-arterial carbon dioxide partial pressure difference in early resuscitation from septic shock:a prospective observational study[J]. Eur J Anaesthesiol, 2014, 31(7): 371-380. DOI:10.1097/EJA.0000000000000064 (  0) 0) |
| [32] |
van Beest PA, Lont MC, Holman ND, et al. Central venous-arterial pCO2, difference as a tool in resuscitation of septic patients[J]. Intensive Care Med, 2013, 39(6): 1034-1039. DOI:10.1007/s00134-013-2888-x (  0) 0) |
| [33] |
Du W, Liu DW, Wang XT, et al. Combining central venous-to-arterial partial pressure of carbon dioxide difference and central venous oxygen saturation to guide resuscitation in septic shock[J]. J Crit Care, 2013, 28(6): 1110. (  0) 0) |
| [34] |
陈容欣, 张育才, 崔云, 等. 动静脉血二氧化碳分压差测定在小儿脓毒性休克中的意义[J]. 中华儿科杂志, 2014, 52(12): 918-922. DOI:10.3760/cma.j.issn.0578-1310.2014.12.009 (  0) 0) |
| [35] |
Puskarich MA, Trzeciak S, Shapiro NI, et al. Prognostic value and agreement of achieving lactate clearance or central venous oxygen saturation goals during early sepsis resuscitation[J]. Acad Emerg Med, 2012, 19(3): 252-258. DOI:10.1111/acem.2012.19.issue-3 (  0) 0) |
| [36] |
Mesquida J, Saludes P, Gruartmoner G, et al. Central venous-to-arterial carbon dioxide difference combined with arterial-to-venous oxygen content difference is associated with lactate evolution in the hemodynamic resuscitation process in early septic shock[J]. Crit Care, 2015, 19(1): 126. DOI:10.1186/s13054-015-0858-0 (  0) 0) |
| [37] |
Lamia B, Monnet X, Teboul JL. Meaning of arterio-venous PCO2 difference in circulatory shock[J]. Minerva Anestesiol, 2006, 72(6): 597-604. (  0) 0) |
 2017, Vol. 19
2017, Vol. 19

