原发性肉碱缺乏症(primary carnitine deficiency, PCD, MIM 212140),又称肉碱转运障碍或肉碱摄取障碍,是由于细胞膜肉碱转运体OCTN2的编码基因SLC22A5突变致脂肪酸β氧化障碍,导致血浆肉碱水平降低及组织细胞内肉碱缺乏,进而引起一系列生化代谢异常和心肌、骨骼肌、肝脏等多系统损害。临床表现为低酮性低血糖、扩张型心肌病、肝大、肌无力等,属常染色体隐性遗传代谢性疾病。近年来,随着串联质谱技术在新生儿筛查的广泛应用,越来越多的PCD患者在早期得以检出[1-5]。左旋肉碱替代治疗的介入,也使PCD患者的预后得到显著改善[6-7]。本研究采用血酰基肉碱谱筛查的方法,对可疑PCD患者及父母进行基因突变分析,为PCD的早期诊断和治疗提供科学依据。
1 资料与方法 1.1 研究对象选择2012年10月至2016年10月在柳州市妇幼保健院新生儿疾病筛查中心进行新生儿串联质谱筛查的34 167份滤纸干血片进行血酰基肉碱谱分析。并对其中游离肉碱(free carnitine, C0)水平低于10 μmol/L[8-9],且母亲孕期正常摄入肉类食品、血酰基肉碱谱分析未见异常的10例患儿及其中7例患儿的父母进行SLC22A5基因突变分析。
排除标准:(1)其它遗传代谢疾病引起的继发性肉碱缺乏,如异戊酸血症、甲基丙二酸血症等;(2)严重摄入不足或丢失过多者(如严重营养不良、先天性消化道畸形、腹膜透析),且营养改善后游离肉碱不能恢复正常;(3)严重肝肾疾病者;(4)有特殊药物应用史,如环抱霉素、丙戊酸纳等。
1.2 血液酯酰肉碱谱分析采患儿末梢血滴于专用采血滤纸(英国沃特曼公司S & S903#),室温自然晾干,将血滤纸片打孔置于96孔过滤板中,每孔加入含氨基酸和酰基肉碱同位素内标的甲醇300 μL,室温密封震荡30 min,萃取血片中的氨基酸和酰基肉碱,然后离心至另一个96孔聚丙烯板,50℃加热氮气吹干,再加入50 μL盐酸正丁醇(3 mol/L),Teflon膜覆盖,置65℃恒温箱15 min,50℃氮气吹干后加入80%乙腈100 μL,铝膜覆盖后上样检测。根据同位素内标和各种丁酯化的氨基酸和酰基肉碱的离子峰强度,采用定量分析软件,由已知浓度的内标自动计算出所测样品中氨基酸和酰基肉碱浓度。对C0偏低的患儿母亲同时进行血酰基肉碱分析。
1.3 SLC22A5基因突变分析获得研究对象监护人知情同意后,采集C0水平低于10 μmol/L的新生儿及其父母静脉血2 mL(EDTA抗凝),常规酚-氯法提取基因组DNA。针对SLC22A5基因外显子,采用Primer Premier 5.0设计引物,扩增全部外显子以及与外显子交界的部分内含子区域。PCR反应体系为25 μL,包括TaKaRa LA Taq premix 12.5 μL,上、下游引物混合液0.75 μL(10 pmol/μL),基因组DNA100 ng,加去离子水至25 μL。PCR反应条件:95℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸40 s,38个循环;72℃延伸8 min。PCR扩增产物经1.5%琼脂糖凝胶电泳鉴定,测序结果与人类基因组SLC22A5基因序列进行比较。
2 结果 2.1 血液酯酰肉碱谱分析结果34 167份新生儿滤纸干血片标本中10例患儿血游离肉碱水平低于10 μmol/L,母亲酰基肉碱谱分析未见异常。病例1、6、7因肝功能异常、低血糖及黄疸住院行血酰基肉碱谱筛查发现C0降低,其余7例患儿均为新生儿串联质谱筛查发现C0降低、无任何临床症状。见表 1。
| 表 1 患儿游离肉碱水平及基因突变类型 |
|
|
10例患儿SLC22A5基因诊断共检测到10种突变,分别为c.51C>G、c.976C>T、c.1411C>T、c.1195C>T、c.760C>T、c.919delG、c.1400C>G(p.S467C)、c.517delC、c.839C>T、c.505C>T,其中c.976C>T、c.919delG、c.517delC、c.338G>A四个突变在HGMD(http://www.hgmd.cf.ac.uk/ac/)人类突变数据库中未见收录,SNP数据库无该突变记录。新发突变c.976C>T经软件PolyPhen-2预测有害风险值高达0.99,SIFT预测分数为0,均提示有害突变;c.338G>A突变的PolyPhen-2预测风险值为1.0,SIFT预测分数0,提示有害突变。多物种间保守性分析提示c.976C>T、c.338G>A突变位点高度保守。根据文献[10]报道,移码突变导致蛋白翻译终止或截短,生物学活性受到影响,为致病突变。见表 1、图 1~2。

|
图 1 肉碱缺乏症患儿SLC22A5基因新发突变测序结果 ① ~ ④示正常对照序列;⑤ ~ ⑧示检测到的新发突变,突变位点如箭头所指。 |
|
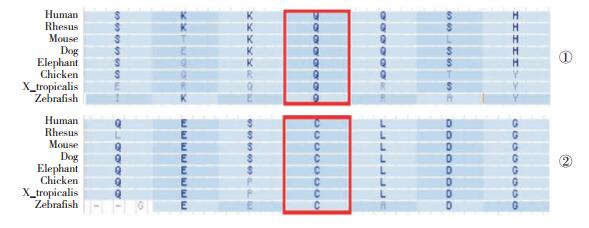
图 2 突变位点的物种保守性分析 ①、②分别示突变位点c.976C>T(p.Gln326X)和c.338G>A(p.Cys113Tyr)在多种物种间高度保守。 |
原发性肉碱缺乏症属常染色体隐性遗传病,致病基因SLC22A5定位于染色体5q31.1,包括10个外显子和9个内含子,其编码的肉碱转运蛋白由557个氨基酸组成,包含12个跨膜区和一个ATP结合区,广泛分布于心肌、骨骼肌、小肠、肾小管、皮肤成纤维细胞及胎盘等组织细胞膜上。研究发现,跨膜区在肉碱的识别和转运中起关键作用,N-末端可能存在Na+结合位点,C-末端与Na+-肉碱复合物的转运有关,其中位于跨膜区10与跨膜区11之间的细胞内环路是耦联Na+的电化学梯度及Na+-肉碱复合物穿过细胞膜的重要场所,该环路中酪氨酸残基起重要作用[11-12]。基因突变导致其编码的肉碱转运蛋白无法锚定细胞膜而滞留于细胞质中,或结构及功能域不同程度受损,导致该蛋白的转运功能缺陷以及肉碱由肠道转入到血液及由血液转运到细胞的量减少,从而引起脂肪酸β氧化代谢受阻。患者表现为心肌病、骨骼肌张力减低及肝功能异常等。目前已报道的SLC22A5基因突变有180余种,多为错义突变,无义突变和移码突变次之,而剪接位点的突变比较少见,发生突变最为频繁的是1号外显子[10]。不同种族和地区SLC22A5基因的热点突变不同,高加索人群常见R282X突变[13-15],东亚人群中W132X和W283C突变最为常见[16-18],中国台湾及上海新华医院对PCD患儿基因检测发现R254X突变发生率最高[19-20]。与以往报道不同的是,本研究的10例患儿中,c.51C>G(p.Phe17Leu)突变多达5次,出现频率约25%(5/20),c.760C>T(p.Arg254X)突变出现3次(15%,3/20)。并且,本研究检测到的10种突变中,4种突变:c.976C>T、c.919delG、c.517delC、c.338G>A未见相关报道,生物信息学分析提示其具有高致病风险,导致蛋白翻译终止或截短,影响正常的生物学活性。同时,PCD在不同地区患病率存在差异,德国约为0.3/10万,美国约为0.5/10万,葡萄牙约为1/10万,澳大利亚约为0.8/10万,沙特阿拉伯约为1.2/10万,日本约为2.5/10万,我国上海地区约为2.4/10万、浙江地区3.1/10万、台湾地区0.8/10万[8-9, 20, 21]。本研究对34 167例新生儿进行血酰基肉碱谱筛查,10例游离肉碱降低且基因诊断全部确诊为PCD。由此推断本地区PCD检出率约为1/3 416(10/34 167),高于文献所报道,可能与检测例数较少有关,但PCD发病率是否在国内存在地区或民族差异,尚需扩大样本进一步验证。
PCD可见于任何年龄,多数于1个月至7岁发病。临床主要表现为:①急性能量代谢障碍危象,表现为低酮性低血糖、高血氨及代谢性酸中毒等[22];②心肌病,表现为心室肥厚、心功能不全、心率失常及肌酸激酶升高等;③肌病,表现为肌无力、肌张力减退、肌痛、运动耐力差等;④肝脏损害,表现为肝大、脂肪肝、肝功能异常等。少数患儿表现为抽搐、进行性意识障碍等,常被误诊为Reye综合征[23]。反复腹痛、呕吐、胃食管反流等消化道症状以及贫血等也有报道。值得注意的是,PCD患儿可因急性能量代谢障碍危象或急性心衰而猝死[24]。PCD治疗的原则是避免感染、饥饿及高强度运动,需终身应用肉碱替代治疗,维持血浆游离肉碱水平正常或接近正常。出现能量代谢障碍危象时,立即静脉输注葡萄糖以维持血糖在5 mmol/L以上,并静脉或口服左旋肉碱(每日100~400 mg/kg);病情缓解期需根据患者血浆游离肉碱和酰基肉碱水平进行个体化治疗,推荐口服左旋肉碱每日100~300 mg/kg维持。本研究10例患儿确诊后给予左卡尼汀替代治疗,目前均无临床症状。
PCD基因型与临床表型的相关性尚不明确,相同的突变可导致不同的临床表型,不同的突变也可呈现相似的临床表型[25]。研究发现,无义突变和移码突变多引起肉碱转运体功能降低,患者多表现出明显症状;而错义突变和缺失突变的肉碱转运体残留部分活性,在无症状患者中多见。PCD纯合子患者OCTN2转运肉碱的能力严重损坏或完全破坏,尿液肉碱排泄量增多,血浆及组织细胞内肉碱水平极低,可表现出不同程度的临床症状和体征,但部分患者缺乏典型的临床表现。Spiekerkoetter等[26]报道1个土耳其家系,父亲和2个儿子均为R471H的纯合子(该突变的OCTN2肉碱转运活性为正常对照的1.5%),仅1个儿子在婴儿期出现严重症状(表现为Reye综合征样发作),28岁的父亲和5岁的哥哥均无症状。Shibbani等[27]研究发现,携带纯合无义突变的患者肉碱水平最低,且突变越接近肽链C-末端,肉碱水平越低,推断SLC22A5基因突变位置和类型可影响肉碱水平。本研究中3例为纯合错义突变,其游离肉碱水平与复合杂合突变病例的差异无显著性。
PCD是一种潜在的致死性疾病,早期诊断和治疗是决定预后的关键。目前我国部分地区已将此病列入新生儿疾病常规筛查项目,对于筛查发现游离肉碱降低的进一步行SLC22A5基因测序有助于确诊,使PCD的早期诊断成为可能,也为PCD的遗传咨询和产前诊断提供了重要信息。
| [1] |
王洪允, 江骥, 胡蓓. 串联质谱在新生儿遗传代谢性疾病筛查中的应用[J]. 质谱学报, 2011, 32(1): 24-30. (  0) 0) |
| [2] |
林壹明, 林卫华, 余科, 等. 八例原发性肉碱缺乏症SLC22A5基因突变分析[J]. 中华医学遗传学杂志, 2017, 34(1): 35-39. (  0) 0) |
| [3] |
苏艳华, 刘洋, 谢建生, 等. 原发性肉碱缺乏症一家系的SLC22A5基因突变检测与产前诊断[J]. 中华医学遗传学杂志, 2015, 32(4): 490-494. (  0) 0) |
| [4] |
饶姣, 曾国洪, 王树水, 等. 原发性肉碱缺乏症性心肌病患儿基因突变及家系分析[J]. 中华儿科杂志, 2014, 52(7): 544-547. (  0) 0) |
| [5] |
Han L, Wang F, Wang Y, et al. Analysis of genetic mutations in Chinese patients with systemic primary carnitine deficiency[J]. Eur J Med Genet, 2014, 57(10): 571-575. DOI:10.1016/j.ejmg.2014.08.001 (  0) 0) |
| [6] |
顾学范, 韩连书, 高晓岚, 等. 串联质谱技术在遗传性代谢病高危儿童筛查中的初步应用[J]. 中华儿科杂志, 2004, 42(6): 401-404. (  0) 0) |
| [7] |
Magoulas PL, El-Hattab AW. Systemic primary carnitine deficiency:an overview of clinical manifestations, diagnosis, and management[J]. Orphanet J Rare Dis, 2012, 7: 68. DOI:10.1186/1750-1172-7-68 (  0) 0) |
| [8] |
韩连书. 原发性肉碱缺乏症[M]//顾学范临床遗传代谢病. 北京: 人民卫生出版社, 2015: 135-139.
(  0) 0) |
| [9] |
韩连书, 叶军, 邱文娟, 等. 原发性肉碱缺乏症17例诊治与随访[J]. 中华儿科杂志, 2012, 50(6): 405-409. (  0) 0) |
| [10] |
Li FY, EI-Hattab AW, Bawle EV, et al. Molecular spectrum of SLC22A5(OCTN2) gene mutations detected in 143 subjects evaluated for systemic carnitine deficiency[J]. Hum Mutat, 2010, 31(8): E1632-E1651. DOI:10.1002/humu.v31:8 (  0) 0) |
| [11] |
Amat di San Filippo C, Wang Y, Longo N. Functional domains in the carnitine transporter OCTN2, defective in primary carnitine deficiency[J]. J Biol Chem, 2003, 278(48): 47776-47784. DOI:10.1074/jbc.M307911200 (  0) 0) |
| [12] |
Amat di San Filippo C, Longo N. Tyrosine residues affecting sodium stimulation of carnitine transport in the OCTN2 carnitine/organic cationtransporter[J]. J Biol Chem, 2004, 279(8): 7247-7253. DOI:10.1074/jbc.M309171200 (  0) 0) |
| [13] |
Burwinkel B, Kreuder J, Schweitzer S, et al. Carnitine transporter OCTN2 mutations in systemic primary carnitine deficiency:a novel Arg169Gln mutation and a recurrent Arg282ter mutation associated with an unconventional splicing abnormality[J]. Biochem Biophys Res Commun, 1999, 261(2): 484-487. DOI:10.1006/bbrc.1999.1060 (  0) 0) |
| [14] |
Vaz FM, Scholte HR, Ruiter J, et al. Identification of two novel mutations in OCTN2 of three patients with systemic carnitine deficiency[J]. Hum Genet, 1999, 105(1-2): 157-161. DOI:10.1007/s004399900105 (  0) 0) |
| [15] |
Wang Y, Ye J, Ganapathy V, et al. Mutations in the organic cation/carnitine transporter OCTN2 in primary carnitine deficiency[J]. Proc Natl Acad Sci U S A, 1999, 96(5): 2356-2360. DOI:10.1073/pnas.96.5.2356 (  0) 0) |
| [16] |
Koizumi A, Nozaki J, Ohura T, et al. Genetic epidemiology of the carnitine transporter OCTN2 gene in a Japanese population and phenotypic characterization in Japanese pedigrees with primary systemic carnitine deficiency[J]. Hum Mol Genet, 1999, 8(12): 2247-2254. DOI:10.1093/hmg/8.12.2247 (  0) 0) |
| [17] |
Nezu J, Tamai I, Oku A, et al. Primary systemic carnitine deficiency is caused by mutations in a gene encoding sodium ion-dependent carnitine transporter[J]. Nat Genet, 1999, 21(1): 91-94. DOI:10.1038/5030 (  0) 0) |
| [18] |
Tang NL, Ganapathy V, Wu X, et al. Mutations of OCTN2, an organic cation/carnitine transporter, lead to deficient cellular carnitine uptake in primary carnitine deficiency[J]. Hum Mol Genet, 1999, 8(4): 655-660. DOI:10.1093/hmg/8.4.655 (  0) 0) |
| [19] |
Lee NC, Tang NL, Chien YH, et al. Diagnoses of newborns and mothers with carnitine uptake defects through newborn screening[J]. Mol Genet Metab, 2010, 100(1): 46-50. DOI:10.1016/j.ymgme.2009.12.015 (  0) 0) |
| [20] |
Tang NL, Hwu WL, Chan RT, et al. A founder mutation (R254X) of SLC22A5(OCTN2) in Chinese primary carnitine deficiency patients[J]. Hum Mutat, 2002, 20(3): 232. (  0) 0) |
| [21] |
Yang LL, Huang XW, Yang JB, et al. Screening and diagnosis of children with primary carnitine deficiency in Zhejiang Province, China[J]. HK J Paediatr, 2013, 18(3): 167-173. (  0) 0) |
| [22] |
Jun JS, Lee EJ, Park HD, et al. Systemic primary carnitine deficiency with hypoglycemic encephalopathy[J]. Ann Pediatr Endocrinol Metab, 2016, 21(4): 226-229. DOI:10.6065/apem.2016.21.4.226 (  0) 0) |
| [23] |
Mahale RR, Mehta A, Timmappaya A, et al. Primary carnitine deficiency as a cause of metabolic leukoencephalopathy:Report of one case[J]. Neurol India, 2016, 64(1): 166-168. DOI:10.4103/0028-3886.173650 (  0) 0) |
| [24] |
Lahrouchi N, Lodder EM, Mansouri M, et al. Exome sequencing identifies primary carnitine deficiency in a family with cardiomyopathy and sudden death[J]. Eur J Hum Genet, 2017, 25(6): 783-787. DOI:10.1038/ejhg.2017.22 (  0) 0) |
| [25] |
黄倬, 韩连书. 原发性肉碱缺乏症发病机制及基因突变研究进展[J]. 中国实用儿科杂志, 2012, 27(5): 393-396. (  0) 0) |
| [26] |
Spiekerkoetter U, Huener G, Baykal T, et al. Silent and symptomatic primary carnitine deficiency within the same family due to identical mutations in the organic cation-carnitine transporter OCTN2[J]. J Inherit Metab Dis, 2003, 26(6): 613-615. DOI:10.1023/A:1025968502527 (  0) 0) |
| [27] |
Shibbani K, Fahed AC, Al-Shaar L, et al. Primary carnitine deficiency:novel mutations and insights into the cardiac phenotype[J]. Clin Genet, 2014, 85(2): 127-137. DOI:10.1111/cge.2014.85.issue-2 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


