Rubinstein-Taybi综合征(Rubinstein-Taybi syndrome, RSTS; OMIM 180849)是一种有明确定义的多发性先天畸形-智力发育迟缓综合征,以出生后生长迟缓、小头畸形、特定的面部特征、拇指大、脚趾大、智力发育迟缓为特征,发病率1:100 000~125 000[1]。1963年由Rubinstein Taybi首次报道该病,1991年首次明确了其遗传机制,目前发现的相关基因有2个,即编码cAMP调节的增强子结合蛋白(CREBBP)基因及其同源体,编码E1A结合蛋白(EP300)基因[2]。RSTS为常染色体显性遗传,绝大多数病例为新生突变,垂直传递极为罕见,所以几乎无家族史[3]。
本研究对1例无粗大拇指、趾,但有其他RSTS临床表现的患儿采用二代测序技术进行相关基因检测,发现CREBBP基因突变,再用Sanger测序法验证患者和父母,确诊患儿为CREBBP基因新突变致RSTS。本研究对患儿的临床特点及基因突变进行分析,现报告如下。
1 病例报告患儿女,汉族,3岁8个月,因生长迟缓伴语言发育落后到我院门诊就诊。患儿生后母乳喂养,吃奶差,身高体重增长慢,曾在国外就诊,考虑为进食少所致。9个月时身长66 cm,体重6.6 kg。5个月时会翻身,至8个月时仍不能独坐,13个月时能站立,24个月时会独走。2岁会叫“爸爸、妈妈”,目前仍然不能说较为完整的长句。能认自己的东西,但不能辨别颜色。曾在外院多次就医,诊断“精神发育迟滞”,行康复治疗。6个月出牙, 牙齿易断裂,门齿尖,曾行牙齿磨平。
患儿系第2胎第2产,孕39周足月剖宫产出生,出生体重3.3 kg,身长50 cm。出生时有胎盘破裂、新生儿窒息,在美国医院抢救,具体不详,后曾因黄疸接受过光疗。父母体健,非近亲婚配,无家族遗传病史。母孕期无异常,无围产期并发症。
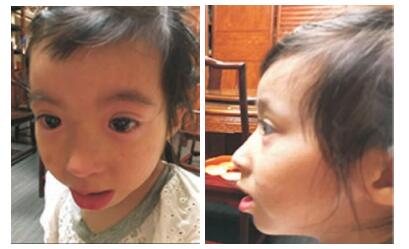
体格检查:体重11.2 kg,身高88.5 cm,头围45 cm,均低于第3百分位。头颅外形正常,发际线不低;拱形眉,眉毛浓密,睫毛长,内眦赘皮,双眼裂长且眼外角下斜,宽鼻梁(图 1)。上中切牙、侧切牙脱落,右上第一尖牙余留残根。胸廓对称无畸形,心肺腹检查未见异常。脊柱无侧弯,四肢活动正常,手、足未见异常,四肢肌力、肌张力正常,病理征未引出。
|
图 1 患儿的面部特征 拱形粗眉、内眦赘皮,双眼裂外下斜、宽鼻梁。 |
血、尿、粪常规、血生化及甲状腺功能检查均正常。心脏、腹部B超检查均正常。四肢长骨X线检查未见异常,骨龄正常。头颅MRI示额部外形稍窄,脑实质未见异常。脑电图检查示异常儿童脑电图(清醒背景θ活动稍增多,ẞ活动增多)。听力筛查及诱发电位未发现异常。发育测试示适应性、大运动为轻度迟缓,精细动作及个人社交为中度迟缓,语言发育为重度迟缓。
经我院医学伦理委员会批准,并经患儿家长签署知情同意书后,抽取患儿及其父母静脉血2.5~3 mL置于EDTA抗凝管,送北京迈基诺基因科技股份有限公司行基因测序。采用二代测序法进行基因测序,发现CREBBP基因突变,再用Sanger测序法对患儿及父母的CREBBP基因突变进行验证,对测序发现的突变在人类基因突变数据库(HGMD)专业版数据库中进行比对查阅。
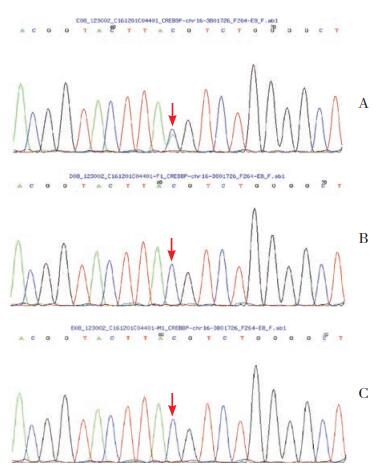
经基因测序分析,发现患儿CREBBP基因存在c.3779+1G>T杂合突变,第3779+1号核苷酸由鸟嘌呤变异为胸腺嘧啶(图 2A),该突变为剪接位点突变,位于20号内含子。患儿父母该位点无变异(图 2B、C)。该变异在HGMD专业版数据库中未见报道,为新的致病性突变。
|
图 2 CREBBP基因测序 A:患儿CREBBP基因c.3779+1G>T杂合突变(箭头所示);B、C分别为患儿父亲和母亲CREBBP基因测序结果,均显示无变异(箭头所示)。 |
患儿明确诊断为RSTS。完善眼科检查,未发现异常。嘱患儿继续康复治疗,半年后进行再次发育评估、复查脑电图。目前患儿门诊随访3个月,由于时间短,尚未评估康复治疗疗效。
2 讨论RSTS是一种非常罕见的由于基因突变导致组蛋白合成异常的疾病。国内报道数例[4-6]。该病为常染色体显性遗传,然而有明确家族史的病人非常罕见,因绝大多数病例为基因的新生突变所致[3],RSTS再发的风险约0.5%~1%[2]。
RTST的主要表现为生长发育落后、智力障碍、小头畸形、特殊面容、宽拇指、粗大的第一脚趾[2]。虽然RSTS在出生时就有相应的临床表现,但随着患儿年龄的增长,该病特征才逐渐明显[2],其外形特征主要表现在颜面部、手指及脚趾[7]。
RSTS的颅面部特征主要表现为:小头畸形、“外八字”下斜的双眼裂、宽鼻梁、喙状鼻尖、鼻中隔过伸超过鼻孔、高弓上颚及轻度的小颌畸形、拱形粗眉等[2, 8]。宽拇指、粗大的第一脚趾是一个特征性体征[9]。但有很少一部分患者的手指和脚趾正常[10]。此外,少数病人可出现跖骨增宽,拇指成角也较常见,严重成角者需要外科手术治疗[3]。
21%的RSTS患儿有生长发育迟缓。患儿出生时身长、体重正常,生后数月内出现身长及体重的落后,常低于同龄儿童的第5百分位以下[2-3],这个特点也是提供诊断的线索之一[3]。
神经精神发育障碍是RSTS的一个常见表现。典型的RSTS表现为新生儿期肌张力低,精神运动发育延迟,有不同程度的智力残疾,IQ值在29~79之间[2],90%的患儿说话延迟,部分患儿随着年龄的增长智商进一步倒退[11]。RSTS继发性癫癎的发生率较高,约为28%,脑电图异常约为57%~66%[12]。除此之外,孤独症、行为异常等在RSTS患者中的发生率也明显高于普通人群[13]。
此外,RSTS还可能存在的畸形、并发症包括:牙齿的异常(73%的患儿有恒切牙的舌侧畸形尖状凸起)、胃食道反流、便秘、先天性心脏病、肾脏畸形、隐睾、眼部病变、耳聋、内分泌紊乱、瘢痕疙瘩,恶性肿瘤的发生率3%~10%[2],以脑瘤和白血病为主,往往发生在15岁之前[1]。
在本研究中,患儿出生体重、身长正常,生后喂养困难,出现生长迟缓、头围小,智力障碍,尤其语言发育落后明显。患儿有特殊面容:拱形粗眉、内眦赘皮、双眼裂外下斜、宽鼻梁,同时并发牙齿的异常,主要的临床表现与RSTS吻合。患儿无指趾粗大,这种情况有文献报道[10]。因患儿进行过牙齿磨平,目前未发现恒切牙的舌侧畸形尖状凸起。
迄今,发现与RSTS相关的基因有两个,即CREBBP及EP300[1],50%~70%的RSTS患者为CREBBP基因突变,EP300突变占5%~8%[2],无种族差异的报道。CREBBP基因位于16p13.3,含31个外显子,编码含2 442个氨基酸的CREB结合蛋白;EP300基因位于22q13.2, 长度为2 415个氨基酸[2, 14]。CREBBP及EP300为一对高度同源化的基因,它们都有一个反式激活结构域(transactivation domain),即反式作用因子的转录调控结构域,不与特定的DNA绑定,编码的蛋白具有高度同源性,与体内许多转录因子及基因蛋白编码区相互影响,其三维结构包括受体结合部位如锌指蛋白CRBP结合区(KIX编码区)、组蛋白乙酰转移酶(histone acetyl transferase, HAT)活性区(该区位于19~30外显子,编码1173-1849位氨基酸)、EIA癌蛋白结合区、蛋白激酶A磷酸化位点、谷氨酰胺富含区、C-末端、溴结构域等[3, 15-16]。这些蛋白通过本身具有的组蛋白乙酰转移酶活性发挥转录因子与靶DNA之间的桥梁作用;可以抑制细胞复制,并具有抑癌作用,参与多条抑癌信息传导通路。
综合国内外的报道,CREBBP基因的突变总共有230余种,包括无义/错义突变、缺失突变、剪接位点突变、插入、异位重排及大片段插入/重复突变。与EP300基因相关的突变总共有9种,包括无义/错义突变、缺失突变[4]。本研究中,患儿CREBBP基因存在c.3779+1G>T杂合突变,第3779+1号核苷酸由鸟嘌呤变异为胸腺嘧啶,该突变位于20号内含子,为剪接位点突变。该突变可能导致转录产物的异常剪接,影响HAT区及EIA癌蛋白结合区等多个功能区,使蛋白功能严重受损,从而导致RSTS的发生。该变异在HGMD专业版数据库中未见报道,推测为新的致病性突变。
目前,基因突变类型与临床表现的相关性尚无定论。有学者认为RTS中CREBBP基因缺失大小与疾病严重程度相关[17],但Schorry等[16]认为RSTS患者的典型畸形(面部及宽拇指、粗大的脚趾)在CREBBP各种突变中无差别。不过目前普遍认为,大段的缺失突变与严重的智力低下及儿童孤独症的发生有一定的联系[2, 18]。
目前RSTS尚无诊疗指南。超过90%的患者都可以活到成年,其所面临的医学问题随着年龄的增长而变化。青春期出现诸如焦虑、情绪不稳定、好斗等一系列的行为表现,成年患者最大的问题是超重或肥胖。2015年Milani等[2]提出,RSTS患儿临床诊断后需进行神经精神、听力、视力、骨骼、心血管、皮肤及内分泌系统评估,以及头颅和脊髓MRI、肾脏超声检查和基因检测;青春期时,需再次进行上述所有评估,以及压力测试。而在年龄6个月、1岁、18个月、2岁、30个月、大于3岁时,评估以听力、视力、骨骼和牙齿为重点。本研究中患儿听力、视力、骨骼、心血管、皮肤及内分泌系统无异常,头颅MRI检查无异常,目前治疗主要是针对患儿语言及运动发育落后进行康复训练,尽可能减轻发育落后的程度;每半年复查脑电图,观察是否可能发生癫癎。同时关注患儿的饮食情况,防止青春期体重的急剧增加导致肥胖。此外,要注意识别恶性肿瘤的早期表现,及时干预。
综上所述,RSTS极为罕见,虽然已经明确了一些临床表现,但还需要大量的研究来扩展对临床表型的认识,识别特定的基因与表型的相关性, 评估体内是否有体细胞嵌合的存在导致轻微表型,并发现除CREBBP及EP300外的新的致病基因,为诊断和治疗提供帮助。
| [1] |
Hennekam RC. Rubinstein-Taybi syndrome[J]. Eur J Hum Genet, 2006, 14(9): 981-985. DOI:10.1038/sj.ejhg.5201594 (  0) 0) |
| [2] |
Milani D, Manzoni FM, Pezzani L, et al. Rubinstein-Taybi syndrome:clinical features, genetic basis, diagnosis, and management[J]. Ital J Pediatr, 2015, 41: 4. DOI:10.1186/s13052-015-0110-1 (  0) 0) |
| [3] |
Roelfsema JH, Peters DJ. Rubinstein-Taybi syndrome:clinical and molecular overview[J]. Expert Rev Mol Med, 2007, 9(23): 1-16. (  0) 0) |
| [4] |
张江伟, 王长燕, 李明, 等. CREBBP基因突变所致Rubinstein-Taybi综合征二例临床和遗传学特征[J]. 中华儿科杂志, 2014, 52(9): 673-677. (  0) 0) |
| [5] |
王艳, 洪小杨, 彭薇, 等. 应用单核苷酸多态性微阵列技术诊断Rubinstein-Taybi综合征1例报告[J]. 临床儿科杂志, 2016, 34(9): 686-688. (  0) 0) |
| [6] |
廖若西, 姜艳, 王鸥, 等. CREBBP基因突变导致的伴有双侧股骨头坏死的Rubinstein-Taybi综合征1例[J]. 中华骨质疏松和骨矿盐疾病杂志, 2015, 8(4): 343-346. (  0) 0) |
| [7] |
Spena S, Milani D, Rusconi D, et al. Insights into genotype-phenotype correlations from CREBBP point mutation screening in a cohort of 46 Rubinstein-Taybi syndrome patients[J]. Clin Genet, 2015, 88(5): 431-440. DOI:10.1111/cge.2015.88.issue-5 (  0) 0) |
| [8] |
Hutchinson DT, Sullivan R. Rubinstein-Taybi syndrome[J]. J Hand Surg Am, 2015, 40(8): 1711-1712. DOI:10.1016/j.jhsa.2014.08.043 (  0) 0) |
| [9] |
Hosek J, Borková A. The Rubinstein-Taybi syndrome or a broad thumb-hallux syndrome[J]. Cas Lek Cesk, 2008, 147(3): 136-140. (  0) 0) |
| [10] |
Sharma N, Mali AM, Bapat SA. Spectrum of CREBBP mutations in Indian patients with Rubinstein-Taybi syndrome[J]. J Biosci, 2010, 35(2): 187-202. DOI:10.1007/s12038-010-0023-5 (  0) 0) |
| [11] |
Burke SL, Maramaldi P. The Social Security Administration's Compassionate Allowances Initiative:condition spotlight on Rubinstein-Taybi syndrome[J]. Health Soc Work, 2017, 42(1): e32-e43. DOI:10.1093/hsw/hlw062 (  0) 0) |
| [12] |
Wiley S. Rubinstein-Taybi syndrome medical guidelines[J]. Am J Med Genet A, 2003, 119A(2): 101-110. DOI:10.1002/(ISSN)1096-8628 (  0) 0) |
| [13] |
Waite J, Moss J, Beck SR, et al. Repetitive behavior in Rubinstein-Taybi syndrome:parallels with autism spectrum phenomenology[J]. J Autism Dev Disord, 2015, 45(5): 1238-1253. DOI:10.1007/s10803-014-2283-7 (  0) 0) |
| [14] |
Wincent J, Luthman A, van Belzen M, et al. CREBBP and EP300 mutational spectrum and clinical presentations in a cohort of Swedish patients with Rubinstein-Taybi syndrome[J]. Mol Genet Genomic Med, 2015, 4(1): 39-45. (  0) 0) |
| [15] |
Bartsch O, Locher K, Meinecke P, et al. Molecular studies in 10 cases of Rubinstein-Taybi syndrome, including a mild variant showing a missense mutation in codon 1175 of CREBBP[J]. J Med Genet, 2002, 39(7): 496-501. DOI:10.1136/jmg.39.7.496 (  0) 0) |
| [16] |
Schorry EK, Keddache M, Lanphear N, et al. Genotype-phenotype correlations in Rubinstein-Taybi syndrome[J]. Am J Med Genet A, 2008, 146A(19): 2512-2519. DOI:10.1002/ajmg.a.v146a:19 (  0) 0) |
| [17] |
Murata T, Kurokawa R, Krones A, et al. Defect of histone acetyl transferase activity of the nuclear transcriptional coactivator CBP in Rubinstein-Taybi syndrome[J]. Hum Mol Genet, 2001, 10(10): 1071-1076. DOI:10.1093/hmg/10.10.1071 (  0) 0) |
| [18] |
Bartsh O, Rasi S, Delicado A, et al. Evidence for a new contiguous gene syndrome, the chromosoma 16p13.3 deletion syndrome alias severe Rubinstein-Taybi syndrome[J]. Hum Genet, 2006, 120(2): 179-186. DOI:10.1007/s00439-006-0215-0 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19

