阵发性运动诱发性运动障碍(paroxysmal kinesigenic dyskinesia, PKD)属于阵发性运动障碍的一个类型,是一种罕见的神经系统发作性疾病,多在儿童和青少年早期发病,患病率约为1/150 000,男性患者多于女性患者[1-2]。有家族史的PKD病例约占60%,遗传方式为常染色体显性遗传,但存在外显不全现象[3]。Chen等[4]利用全外显子测序的方法发现PKD致病基因为富脯氨酸跨膜蛋白2(proline-rich transmenbrane protein 2, PRRT2)。本文利用DNA测序结合染色体微阵列技术对5例疑似PKD患者进行分子诊断,分析PKD的临床表现及基因突变特点,进一步加深临床医师对该病的认识。
1 资料与方法 1.1 研究对象以武汉大学人民医院儿科收治的5例疑似PKD患者为研究对象,其中4例男性、1例女性。均以运动或精神紧张等诱发的突发肌张力障碍就诊。发病年龄为6~9岁。发作时意识清楚,单侧或双侧肢体姿势异常、手足徐动、面部肌肉抽搐以及身体姿势异常等。5例患者的发作频率从每月3~5次到每天2~7次,每次发作的持续时间不超过30 s。患者均非早产,均无神经系统异常,患者父母均非近亲结婚,但3例患者(P1、P3、P4)有类似发作家族史。患者血、尿常规及肝肾功能、血糖、血脂、电解质以及甲状腺功能均未见异常。5例患者的临床特点详见表 1。
| 表 1 5例阵发性运动诱发性运动障碍患者的临床特点 |
|
|
PKD诊断标准[5]:特定的触发因素(如突然的运动),短促的发作持续时间( < 1 min),发作时无意识障碍或疼痛,抗癫癎药物治疗有效,排除其他器质性疾病,起病年龄为1~20岁(有家族史的病例除外)。
研究得到医院医学伦理委员会批准及患者家属知情同意。
1.2 高通量测序及Sanger测序验证取每个患儿外周血2 mL,利用全血基因组提取试剂盒提取基因组DNA(上海生工公司),并使用分光光度计测定其浓度。委托华大基因公司进行高通量测序。
对于高通量测序发现突变的患者及其家属取外周静脉血提取基因组DNA,利用基因特异性引物(上海生工合成)扩增PRRT2基因相应外显子,引物序列见表 2。PCR反应体系为基因组DNA 50~100 ng、dNTP 150 μmol/L、MgCl2 1.5 mmol/L,上下游引物各0.5 μmol/L,Taq DNA聚合酶0.5 U(TAKARA),补水至终体积25 μL。PCR反应条件:94℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。PCR产物经电泳检测以后进行Sanger测序分析。
| 表 2 PRRT2基因各外显子引物 |
|
|
对于DNA测序未见PRRT2基因突变的患者利用染色体微阵列技术进行全基因组水平的微缺失微重复检测。取患儿及其父母EDTA抗凝静脉血2 mL,提取DNA,并调整DNA浓度至50 ng/μL。采用Illumina SNP芯片进行染色体微缺失/微重复检测,采用KaryoStudio软件进行数据分析。
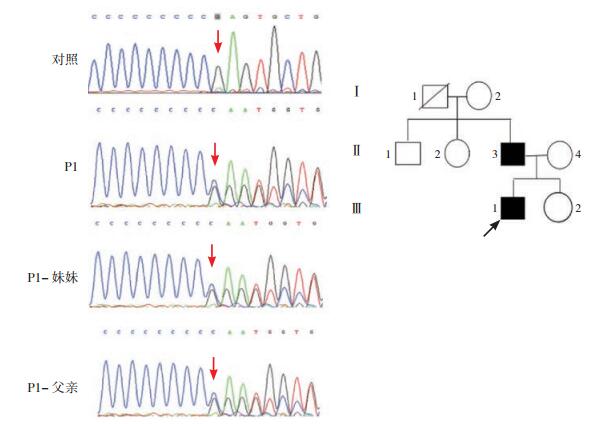
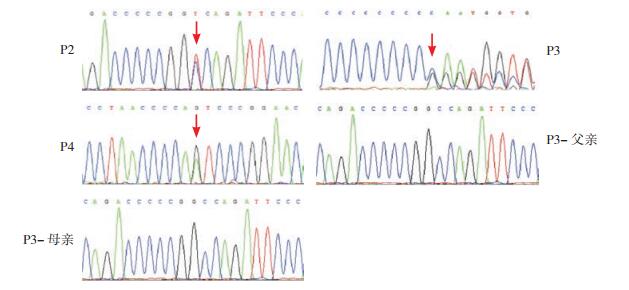
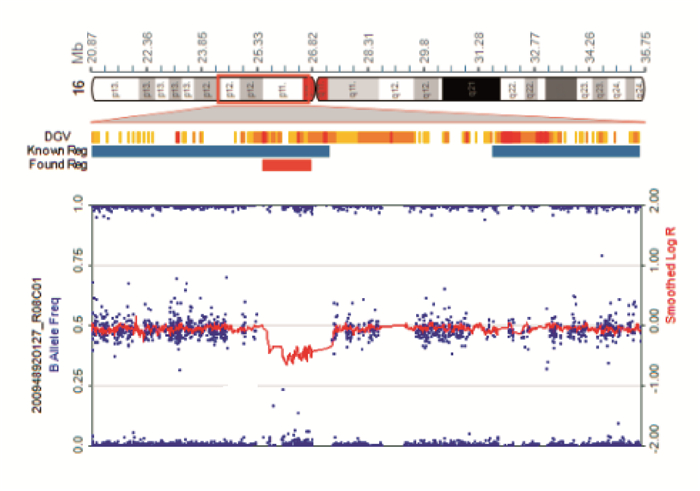
2 结果 2.1 基因检测结果基因检测结果显示患者P1(图 1)的PRRT2基因2号外显子存在c.649_650insC杂合突变,该突变导致编码蛋白在217位及之后的氨基酸序列发生改变,并在224位提前终止(p.R217PfsX8)。对患儿的父母、奶奶及妹妹进行相应位点的Sanger测序检测,发现患儿的父亲和妹妹均携带该突;患儿父亲儿童期起病,药物控制较好,35岁以后几乎无症状;患者妹妹(7岁)暂无临床表型。见图 1。P2的PRRT2基因2号外显子存在c.649_650insC杂合突变;P3的PRRT2基因存在c.436C>T杂合突变,其父母该位点未见异常;P4的PRRT2基因存在IVS2-1G>A剪接位点突变。见图 2。P5 SNP芯片染色体微缺失/微重复检测(图 3)显示:46, XY, del(16p11.2). seq[GRCh37/hg19] (29343657-29889614)*1,即16号染色体p11.2区域存在缺失,片段的大小为0.55 Mb,该区域包括:BOLA2,KIF22,PRRT2,SLX1B等基因。
|
图 1 患者1的PRRT2基因突变分析及家系图 患者P1的PRRT2基因存在c.649_650insC突变,患者妹妹及父亲均携带该突变,突变位点如箭头所示。□示正常表型男性;〇示正常表型女性;  示男性患者; 示男性患者; 示其他原因死亡的男性;箭头所指为先证者。 示其他原因死亡的男性;箭头所指为先证者。 |
|
图 2 患者P2、P3、P4以及P3父母的PRRT2基因突变分析 患者P2的PRRT2基因存在c.649_650insC突变;P3存在c.436C>T杂合突变,其父母该位点未见异常;P4存在IVS2-1G>A剪接位点突变。突变位点如箭头所示。 |
|
图 3 患者P5染色体芯片检测分析 患者16p11.2区域缺失0.55 Mb。箭头所指为染色体缺失区域。 |
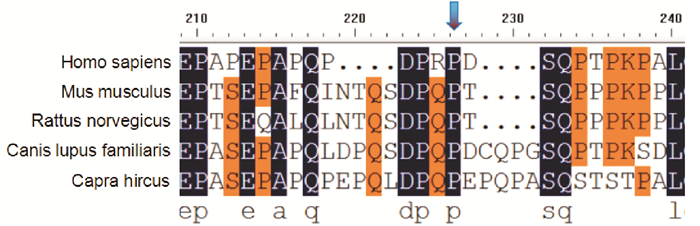
P3的436C>T杂合突变(p.P146S)尚未见致病报道。采用Polyphen2软件预测其致病性,得分为0.994;SIFT软件预测得分为0.01,说明该位点可能为致病性突变。不同物种之间(人、家鼠、褐家属、家犬、山羊)突变位点的保守序列分析(图 4)提示该位点较保守,说明该位点对维持蛋白的结构和功能发挥起重要作用。患者P4存在IVS2-1G>A剪接位点突变,该位点位于剪接位点GT-AG的保守区域,对PRRT2基因的RNA加工成熟可能有影响,但需要从RNA水平进一步验证。
|
图 4 突变位点(p.P146S)的保守序列分析 突变位点(p.P146S)在人、家鼠、褐家属、家犬以及山羊等物种中保守。 |
5例患者确诊后均服用卡马西平(每日8 mg/kg),两个月后发作明显减少,5个月后发作控制;但P1治疗8个多月后家长自行停药,症状复发,恢复用药症状控制。目前所有患者症状均控制。
3 讨论阵发性运动障碍(paroxysmal dyskinesias, PD)是以突发性不自主的异常运动以及姿势障碍为主要表现的神经系统疾病,根据发作特点分为四类:阵发性运动诱发性运动障碍、阵发性过度运动诱发性运动障碍、阵发性非运动诱发性运动障碍以及阵发性睡眠诱发性运动障碍,以PKD最常见,多于儿童期发病,男性多于女性[6]。本文5例患者中4例为男性。PKD虽是PD中最常见的类型,但大多因症状较轻未能及时诊治,而且容易被误诊为癫癎;PKD发作有随年龄增长而减少的趋势,成年后可逐渐缓解[2]。
PKD可为原发性,也可继发于缺氧性脑病、基底节钙化、甲状腺功能减低等,表现为突发的运动诱发的运动障碍,即肌张力障碍、单侧或双侧面部或肢体抽搐,持续时间一般不超过1分钟,发作频率可从每月1次到每天数次或上百次[7]。多数患者发作时意识清醒,部分患者发作之前有肢体麻木等症状,但患者的脑电图及头部磁共振多为正常。本研究5例患者均有运动或精神紧张等诱发因素,发作持续时间均短于30s,发作频率存在较大差异,符合PKD的临床特点。
原发性PKD以常染色体显性遗传为主,部分存在外显不全的现象, 外显率为61%~90%[8]。2011年,我国学者Chen等[4]首次发现PRRT2是PKD的致病基因。PRRT2基因位于染色体16p11.2区域,主要在大脑组织表达[9]。该蛋白含有两个N端糖基化位点(包括富含脯氨酸的保守区)、两个跨膜结构域、一个胞质区及C末端序列,其跨膜端高度保守具有重要生理功能[10]。PRRT2蛋白与突触相关蛋白25(SNAP25)作用,在钙离子诱导的神经递质胞外分泌中发挥重要作用,PRRT2突变或者缺失则影响该信号通路,导致临床症状产生[11]。
PRRT2基因已报道的突变有90多种,而其突变在PKD家系的检出率超过90%,在散发病例中的检出率约35%。c.649_650insC是PRRT2基因的热点突变,约占检出总数的60%以上[12]。本研究2例患者发现该突变。本研究P1及其父亲和妹妹均检测到该突变,但妹妹无症状。基因型相同而表型不同,可能与PRRT2基因外显不全有关[8]。P3检测到的c. 436C>T(p.P146S)突变未见报道,该突变位于富含脯氨酸的保守区,生物信息学分析推测该位点为致病性突变;P4存在IVS2-1G>A剪接位点突变,该位点对mRNA的加工成熟至关重要;P5的缺失突变可能导致PRRT2基因单倍剂量不足,导致症状发生。
抗癫癎药物如卡马西平和苯妥英钠对PKD患者有效,小剂量即能控制发作,但随意停药可能导致复发[13]。本研究的5例患者均使用卡马西平治疗,用药5个月后发作均控制。PRRT2基因突变除导致PKD外,研究发现在良性家族性婴儿惊厥、热性惊厥以及PED等神经系统疾病中亦可发现该基因的异常,说明PRRT2基因突变存在表型异质性,而且这些疾病均对抗癫癎药物敏感[14-15]。
综上所述,PKD患者一般在儿童期起病,为运动诱发,PRRT2基因突变是主要致病基因,低剂量抗癫癎药物治疗有效。对PRRT2基因进行突变筛查有助于PKD诊断。
| [1] |
Huang XJ, Wang T, Wang JL, et al. Paroxysmal kinesigenic dyskinesia:Clinical and genetic analyses of 110 patients[J]. Neurology, 2015, 85(18): 1546-1553. DOI:10.1212/WNL.0000000000002079 (  0) 0) |
| [2] |
杨小玲, 张月华, 许小菁, 等. 阵发性运动诱发的运动障碍临床特点和PRRT2基因突变研究[J]. 中华儿科杂志, 2015, 53(8): 621-625. (  0) 0) |
| [3] |
Lamperti C, Invernizzi F, Solazzi R, et al. Clinical and genetic features of paroxysmal kinesigenic dyskinesia in Italian patients[J]. Eur J Paediatr Neurol, 2016, 20(1): 152-157. DOI:10.1016/j.ejpn.2015.08.006 (  0) 0) |
| [4] |
Chen WJ, Lin Y, Xiong ZQ, et al. Exome sequencing identifies truncating mutations in PRRT2 that cause paroxysmal kinesigenic dyskinesia[J]. Nat Genet, 2011, 43(12): 1252-1255. DOI:10.1038/ng.1008 (  0) 0) |
| [5] |
Bruno MK, Hallett M, Gwinn-Hardy K, et al. Clinical evaluation of idiopathic paroxysmal kinesigenic dyskinesia:new diagnostic criteria[J]. Neurology, 2004, 63(12): 2280-2287. DOI:10.1212/01.WNL.0000147298.05983.50 (  0) 0) |
| [6] |
Demirkiran M, Jankovic J. Paroxysmal dyskinesias:clinical features and classification[J]. Ann Neurol, 1995, 38(4): 571-579. DOI:10.1002/(ISSN)1531-8249 (  0) 0) |
| [7] |
张卉, 时伟丽, 肖海, 等. 一个发作性运动诱发性肌张力障碍家系的PRRT2基因突变研究[J]. 中华医学遗传学杂志, 2016, 33(1): 61-63. (  0) 0) |
| [8] |
van Vliet R, Breedveld G, de Rijk-van Andel J, et al. PRRT2 phenotypes and penetrance of paroxysmal kinesigenic dyskinesia and infantile convulsions[J]. Neurology, 2012, 79(8): 777-784. DOI:10.1212/WNL.0b013e3182661fe3 (  0) 0) |
| [9] |
Liu YT, Nian FS, Chou WJ, et al. PRRT2 mutations lead to neuronal dysfunction and neurodevelopmental defects[J]. Oncotarget, 2016, 7(26): 39184-39196. DOI:10.18632/oncotarget.v7i26 (  0) 0) |
| [10] |
Méneret A, Gaudebout C, Riant F, et al. PRRT2 mutation and paroxysmal disorder[J]. Eur J Neurol, 2013, 20(6): 872-878. DOI:10.1111/ene.2013.20.issue-6 (  0) 0) |
| [11] |
Jarvis SE, Zamponi GW. Masters or slaves? Vesicle release machinery and the regulation of presynaptic calcium channels[J]. Cell Calcium, 2005, 37(5): 483-488. DOI:10.1016/j.ceca.2005.01.017 (  0) 0) |
| [12] |
Li HF, Chen WJ, Ni W, et al. PRRT2 mutation correlated with phenotype of paroxysmal kinesigenic dyskinesia and drug response[J]. Neurology, 2013, 80(16): 1534-1535. DOI:10.1212/WNL.0b013e31828cf7e1 (  0) 0) |
| [13] |
Charlesworth G, Bhatia KP. Primary and secondary dystonic syndromes:an update[J]. Curr Opin Neurol, 2013, 26(4): 406-412. DOI:10.1097/WCO.0b013e3283633696 (  0) 0) |
| [14] |
Gardiner AR, Jaffer F, Dale RC, et al. The clinical and genetic heterogeneity of paroxysmal dyskinesias[J]. Brain, 2015, 138(Pt 12): 3567-3580. (  0) 0) |
| [15] |
Schubert J, Paravidino R, Becker F, et al. PRRT2 mutations are the major cause of benign familial infantile seizures[J]. Hum Mutat, 2012, 33(10): 1439-1443. DOI:10.1002/humu.v33.10 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


