2. 潍坊医学院 医学影像学系, 山东 潍坊 261053;
3. 潍坊医学院附属医院 眼科, 山东 潍坊 261031;
4. 潍坊医学院附属医院 儿科, 山东 潍坊 261031
早产儿视网膜病变(retinopathy of prematurity, ROP)是一种增殖性视网膜病变,是目前儿童致盲的主要原因[1-2],因此,防治ROP对减少儿童失明有重要意义。由于ROP是视网膜血管发育异常所致的疾病,表现为视网膜新生血管增生,且形态和功能异常,因此,减轻异常增生的新生血管是ROP治疗的重点。研究发现骨髓间充质干细胞(bone marrow mesenchymal stem cell, BMSC)眼内移植可减轻氧诱导视网膜病变(oxygen-induced retinopathy, OIR)及眼高压大鼠等模型视网膜细胞的凋亡[3-4]。然而,BMSC对OIR大鼠新生血管的影响目前尚不清楚。研究发现BMSC可减轻非感染性眼角膜新生血管的形成,并能促进脉络膜新生血管的成熟[5-6],HIF-1α和VEGF是与新生血管生成密切相关的两种蛋白,HIF-1α激活VEGF蛋白的表达,而VEGF表达增加诱导新生血管的生成。故本研究探讨BMSC移植对OIR大鼠视网膜新生血管的影响;HIF-1α/VEGF信号通路与ROP患儿新生血管的形成密切相关[7-8],故本研究将探讨BMSC移植对HIF-1α/VEGF信号通路重要信号分子HIF-1α、VEGF蛋白的影响,以期为BMSC临床上治疗ROP提供科学的理论依据。
1 材料与方法 1.1 实验动物及其分组健康7日龄Sprague-Dawley(SD)新生大鼠72只,雌雄不限,体重为12.1~15.5 g,随机分为正常对照组、OIR模型组和BMSC移植组(n=24)。
1.2 主要仪器与试剂全自动常压动物氧舱(DYC-Ⅱ型,中国船舶重工集团公司七O一研究所),正置荧光显微镜(BX-51,日本OLYMPUS公司),化学发光成像分析系统(FluorChem HD2,美国Protein Simple公司);兔抗大鼠HIF-1α一抗购自美国Sigma公司,兔抗大鼠VEGF一抗购自美国Chemicon公司,山羊抗兔二抗试剂盒购自北京中杉金桥生物试剂公司,辣根过氧化物酶标记的山羊抗兔二抗购自美国Jackson ImmunoResearch公司,GAPDH购自美国Proteintech Group公司,ECL化学发光试剂盒购自美国KPL公司。
1.3 OIR模型的制作采用氧诱导法制成OIR模型[9-10]:新生大鼠生后4 h内和母鼠一起放入全自动常压动物氧舱内,设定氧气浓度50%±0.1%与10%±0.1%,每24 h交替1次,连续7个循环后,即生后14 d,放回空气常氧中饲养4 d,动物房内,明暗各12 h进行交替照明。
1.4 大鼠BMSC的体外培养与标记4周龄健康SD大鼠,颈椎脱臼处死,75%无水乙醇浸泡5 min,无菌条件下分离大鼠股骨、胫骨并冲出其骨髓,离心10 min,弃上清,制成骨髓细胞悬液,200目滤网过滤,反复吹打,调整细胞浓度为1×106个/ mL,接种于培养瓶,置于37℃、5% CO2培养箱,24~48 h后半换液,以后每2~3 d全量换液1次。收集传3~5代的BMSC行Hoechst33324标记,24 h后移植[5, 10]。
1.5 细胞移植及眼内检测BMSC移植组新生大鼠生后12 d,腹腔麻醉后,玻璃体腔内注入3×106个活细胞/2 μL[5],注射方法参考文献[3],余各组注入等量的磷酸盐缓冲液(PBS),红霉素眼膏防感染。移植后7 d,各组大鼠腹腔麻醉后常规灌注,并取眼球,制成视神经矢状轴冰冻切片(厚度为16 μm),正置荧光显微镜下观察[5, 11]。
1.6 组织包埋及切片的制作各组于移植后7 d(即生后19 d)分别取8只大鼠,腹腔麻醉,心脏灌注后取眼球,去角膜及晶状体,置于4%多聚甲醛中固定过夜,常规石蜡包埋,平行于视神经矢状轴且以其为平面的视网膜进行切片,厚度为4 μm。
1.7 苏木精-伊红染色石蜡切片脱蜡至水,Harris苏木素液染核,去离子水冲洗,10%盐酸乙醇分化,梯度乙醇复水,1%伊红染胞浆,95%乙醇分色,无水乙醇脱水,二甲苯透明,中性树胶封片,观察各组视网膜前新生血管细胞(preretinal neovascular cells, pre-RNC),每只大鼠取8张非连续切片(每隔5张切片取1张切片),正置荧光显微镜下观察并拍片,计数pre-RNC数[12-13]。
1.8 免疫组化法检测HIF-1α及VEGF蛋白表达石蜡切片脱蜡至水,0.01 mol/L枸橼酸盐缓冲液中热修复抗原2次,3% H2O2去除内源性过氧化物酶,正常山羊血清37℃封闭1 h,分别加入兔抗大鼠HIF-1α(1 : 200)或VEGF(1 : 200)一抗,37℃孵育30 min,4℃冰箱过夜后,0.01 mol/L PBS冲洗,依次加入山羊抗兔二抗试剂盒试剂,0.01 mol/LPBS冲洗后DAB显色,至镜下可见细胞核或细胞浆染为棕黄色,中性树胶封片。正置荧光显微镜下观察,每只大鼠取4~5张非连续视网膜切片(每隔5张切片取1张切片),分别计数HIF-1α+细胞数与VEGF+细胞数,并计算其平均值。
1.9 视网膜铺片法观察BMSC对OIR大鼠视网膜新生血管的影响各组于移植后7 d(即生后19 d)分别取8只大鼠,腹腔麻醉后暴露心脏,左心室注入墨汁,直至大鼠四肢及口周变黑。取大鼠双眼,置于4%多聚甲醛的培养皿中,去掉角膜和晶状体,分离视网膜,沿鼻上、鼻下、颞上、颞下四个方向剪开视网膜并逐渐展平,中性树胶封片,正置荧光显微镜下观察并拍照。
1.10 Western blot法检测HIF-1α及VEGF蛋白表达各组于移植后7 d(即生后19 d)分别取8只大鼠,麻醉后取眼球,去角膜取视网膜,液氮研磨并加入组织裂解液裂解提取总蛋白,考马斯亮蓝G-250染色法定量。10%聚丙稀酰胺分离胶分离蛋白并转膜至PDVF膜上,5%牛血清封闭后,分别加入HIF-1α(1 : 1 000)、VEGF(1 : 1 000)或GAPDH(1 : 10 000)一抗,4℃冰箱过夜,0.1%TBS(0.1%Tween 20+0.01 mol/L PBS)冲洗,加入辣根过氧化物酶标记的山羊抗兔二抗(1 : 2 000),室温下孵育1 h;弃二抗,0.1% TBS冲洗3次,ECL化学发光试剂盒显色,化学发光成像分析系统分析条带的光密度值,结果以目的条带相对于内参GAPDH的相对表达量表示。
1.11 统计学分析采用SPSS 18.0统计软件对数据进行统计学分析,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 BMSC移植后的眼内检测生后19 d(即BMSC移植后7 d),正置荧光显微镜下可见:BMSC组大鼠移植侧视网膜神经节细胞层、内核层均可见Hoechst33324+细胞,细胞核染成蓝色,余各组均未见Hoechst33324+细胞。
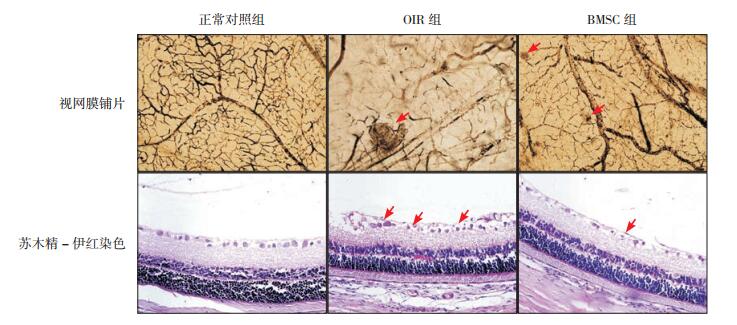
2.2 BMSC移植对OIR大鼠视网膜新生血管形成的影响视网膜铺片法示正常对照组大鼠视网膜可见血管分布呈均匀的网状结构,血管呈放射状规则地向周边部走行;OIR组视盘周围毛细血管闭塞,可见大片无灌注区,视网膜大血管走行迂曲,不规则扩张,周边部正常毛细血管网消失;BMSC组无灌注区明显减少,视网膜大血管走行稍迂曲,视网膜血管可见网状结构(图 1)。苏木精-伊红染色法示正常对照组极少见pre-RNC,而OIR组可见大量pre-RNC(73±8.2个),BMSC组pre-RNC(56±6.9个)明显减少,显著少于OIR组(n=8,t=4.4867,P < 0.01),见图 1。
|
图 1 各组大鼠视网膜新生血管形成情况比较 各组视网膜铺片结果示(×200):正常对照组可见血管密集,分布均匀;OIR组可见毛细血管闭塞,大片无灌注区,血管较杂乱,分布不均匀;BMSC组血管稍迂曲,无灌注区少于OIR组,新生血管数少于OIR组,血管排列较OIR组整齐。各组苏木精-伊红染色结果示(×400):正常对照组可见极少量新生血管;OIR组可见较多杂乱的新生血管;BMSC组亦可见新生血管,分布较不均匀,新生血管数较OIR组明显减少,分布较OIR组均匀。箭头所示为新生血管。 |
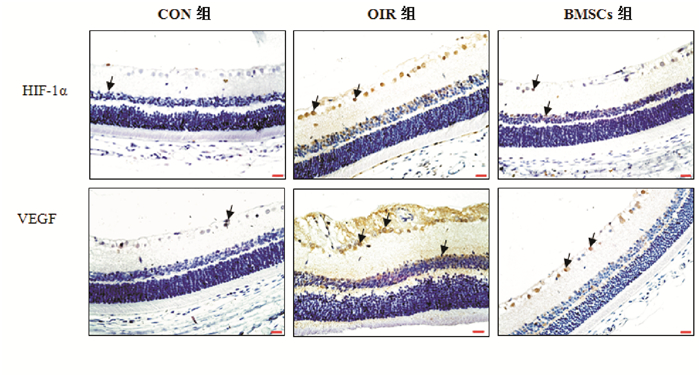
免疫组织化学结果示HIF-1α阳性细胞核染为棕黄色,正常对照组视网膜仅见少量HIF-1α阳性细胞;OIR组可见大量HIF-1α阳性细胞,且显著多于正常对照组(P < 0.05);BMSC组HIF-1α阳性细胞数明显少于OIR组(P < 0.05),但仍多于正常对照组(P < 0.05)。见表 1,图 2。
| 表 1 各组大鼠视网膜HIF-1α阳性与VEGF阳性细胞数比较 (x±s,个/mm2) |
|
|
|
图 2 各组大鼠视网膜HIF-1α及VEGF表达结果(免疫组化,×400) HIF-1α阳性细胞核呈棕黄色,VEGF阳性细胞呈棕黄色。正常对照组视网膜偶见极少量HIF-1α阳性及VEGF阳性细胞,OIR组视网膜可见较多的HIF-1α阳性及VEGF阳性细胞,BMSC组视网膜可见HIF-1α阳性及VEGF阳性细胞,但明显少于OIR组。 |
VEGF免疫组织化学结果示细胞浆染为棕黄色,细胞核染为蓝色。正常对照组视网膜仅见少量VEGF阳性细胞,OIR组可见大量VEGF阳性细胞,且显著多于正常对照组(P < 0.05);BMSC组仍可见VEGF阳性细胞表达,显著少于OIR组,但仍多于正常对照组(P < 0.05)。见表 1,图 2。
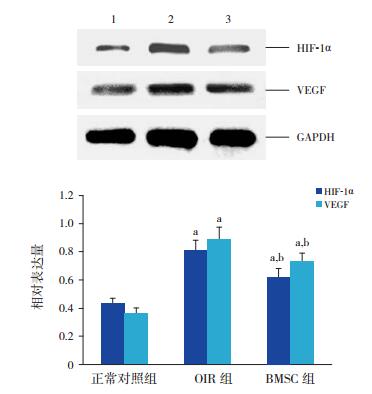
2.4 各组大鼠视网膜HIF-1α及VEGF蛋白的表达水平Western blot结果显示正常对照组仅见少量HIF-1α及VEGF蛋白表达,OIR组HIF-1α及VEGF蛋白相对表达显著高于正常对照组(P < 0.01);BMSC组HIF-1α及VEGF蛋白的相对表达量较OIR组减少,但仍多于正常对照组(P < 0.01)。见图 3。
|
图 3 Western blot检测各组HIF-1α及VEGF蛋白表达 上图为电泳条带图:1为正常对照组,2为OIR组,3为BMSC组;下图为各组视网膜HIF-1α及VEGF蛋白表达水平比较统计图(n=8):a示与正常对照组比较,P < 0.01,b示与OIR组比较,P < 0.01。 |
高氧诱导的视网膜新生血管形成是导致ROP的主要原因,其中新生血管形成早期,促进视网膜早期血管正常发育将有效防止ROP的发生。BMSC可抑制眼角膜新生血管的形成,BMSC能否促进OIR模型大鼠血管的正常发育,减轻新生血管形成,并弄清其机制是本研究的重点。
视网膜铺片可以直观显示眼底视网膜血管的发育情况,本研究发现OIR新生大鼠视网膜血管紊乱,可见大量无灌注区,而BMSC移植后血管排列较规整,无灌注区明显减少,提示大鼠BMSC玻璃体内移植可减轻大鼠视网膜新生血管的形成。苏木精-伊红染色可观察突破视网膜内界膜的内皮细胞核,反映视网膜组织切片大量突破内界膜的视网膜新生血管变化,本研究发现OIR大鼠视网膜新生血管内皮细胞核数显著增加,而BMSC移植后新生血管内皮细胞核数减少,进一步证明大鼠BMSC玻璃体内移植可促进OIR大鼠视网膜血管的发育,减少新生血管的形成。但单纯BMSC移植不能完全治愈OIR大鼠视网膜新生血管的异常增殖,优化BMSC移植将可能进一步改善OIR的疗效。BMSC不仅具有神经分泌功能,发挥神经保护作用,而且是一种基因转染的良好载体,如能基因修饰BMSC将更好地发挥BMSC的神经保护作用,并促进视网膜血管的发育。
近年来,越来越多的研究发现,VEGF在诱导新生血管的形成过程中受多种信号因子的调控,其中,缺血、缺氧组织中的转录活化主要受HIF-1α调控,可通过调节VEGF的稳定性,从而调控缺血、缺氧诱导的新生血管形成[14-15]。本研究免疫组织化学结合Western blot结果示OIR大鼠视网膜HIF-1α及VEGF蛋白表达均增加,BMSC移植后HIF-1α及VEGF蛋白表达降低,提示BMSC减轻OIR大鼠视网膜新生血管的形成可能与BMSC降低OIR大鼠视网膜HIF-1α及VEGF蛋白的表达有关。BMSC如何降低HIF-1α及VEGF蛋白的表达,以及是否可以调控HIF-1α/VEGF信号通路促进眼底视网膜发育,减轻OIR大鼠视网膜新生血管形成有待于进一步研究。
总之,大鼠BMSC玻璃体内移植治疗OIR大鼠,可减轻视网膜新生血管的形成,其机制可能与其抑制HIF-1α、VEGF蛋白的表达有关。
| [1] |
Holmström G, Larsson E. Outcome of retinopathy of prematurity[J]. Clin Perinatol, 2013, 40(2): 311-321. DOI:10.1016/j.clp.2013.02.008 (  0) 0) |
| [2] |
Solebo AL, Teoh L, Rahi J. Epidemiology of blindness in children[J]. Arch Dis Child, 2017, 102(9): 853-857. DOI:10.1136/archdischild-2016-310532 (  0) 0) |
| [3] |
赵岩松, 赵堪兴, 王晓莉, 等. 骨髓间充质干细胞移植对视网膜病变新生大鼠视网膜细胞凋亡的影响[J]. 中国当代儿科杂志, 2012, 14(12): 971-975. (  0) 0) |
| [4] |
Emre E, Yüksel N, Duruksu G, et al. Neuroprotective effects of intravitreally transplanted adipose tissue and bone marrow-derived mesenchymal stem cells in an experimental ocular hypertension model[J]. Cytotherapy, 2015, 17(5): 543-559. DOI:10.1016/j.jcyt.2014.12.005 (  0) 0) |
| [5] |
Oh JY, Roddy GW, Choi H. Anti-inflammatory protein TSG-6 reduces inflammatory damage to the cornea following chemical and mechanical injury[J]. Proc Natl Acad Sci U S A, 2010, 107(39): 16875-16880. DOI:10.1073/pnas.1012451107 (  0) 0) |
| [6] |
Dufourcq P, Descamps B, Tojais NF, et al. Secreted frizzled-related protein-1 enhances mesenchymal stem cell function in angiogenesis and contributes to neovessel maturation[J]. Stem Cells, 2008, 26(11): 2991-3001. DOI:10.1634/stemcells.2008-0372 (  0) 0) |
| [7] |
Park SW, Kim JH, Kim KE, et al. Beta-lapachone inhibits pathological retinal neovascularization in oxygen-induced retinopathy via regulation of HIF-1α[J]. J Cell Mol Med, 2014, 18(5): 875-884. DOI:10.1111/jcmm.2014.18.issue-5 (  0) 0) |
| [8] |
Ma X, Bi H, Qu Y, et al. The contrasting effect of estrogen on mRNA expression of VEGF in bovine retinal vascular endothelial cells under different oxygen conditions[J]. Graefes Arch Clin Exp Ophthalmol, 2011, 249(6): 871-877. DOI:10.1007/s00417-010-1594-4 (  0) 0) |
| [9] |
Hartmann JS, Thompson H, Wang H, et al. Expression of vascular endothelial growth factor and pigment epithelial-derived factor in a rat model of retinopathy of prematurity[J]. Mol Vis, 2011, 17: 1577-1587. (  0) 0) |
| [10] |
Penn JS, Henry MM, Tolman BL. Exposure to alternating hypoxia and hyperoxia causes severe proliferative retinopathy in the newborn rat[J]. Pediatr Res, 1994, 36(6): 724-731. DOI:10.1203/00006450-199412000-00007 (  0) 0) |
| [11] |
谢岷, 杨于嘉, 王晓莉, 等. 骨髓基质细胞移植治疗新生大鼠缺氧缺血性脑损伤时间窗探讨[J]. 中华儿科杂志, 2007, 45(5): 396-397. (  0) 0) |
| [12] |
Yuan LH, Chen XL, Di Y, et al. CCR7/p-ERK1/2/VEGF signaling promotes retinal neovascularization in a mouse model of oxygen-induced retinopathy[J]. Int J Ophthalmol, 2017, 10(6): 862-869. (  0) 0) |
| [13] |
Li Z, He T, Du K, et al. Overexpression of 15-lipoxygenase-1 in oxygen-induced ischemic retinopathy inhibits retinal neovascularization via downregulation of vascular endothelial growth factor-A expression[J]. Mol Vis, 2012, 18: 2847-2859. (  0) 0) |
| [14] |
Wu J, Ke X, Ma N, et al. Formononetin, an active compound of Astragalus membranaceus (Fisch) Bunge, inhibits hypoxia-induced retinal neovascularization via the HIF-1α/VEGF signaling pathway[J]. Drug Des Devel Ther, 2016, 10: 3071-3081. DOI:10.2147/DDDT (  0) 0) |
| [15] |
Jiang J, Xia XB, Xu HZ, et al. Inhibition of retinal neovascularization by gene transfer of small interfering RNA targeting HIF-1alpha and VEGF[J]. J Cell Physiol, 2009, 218(1): 66-74. DOI:10.1002/jcp.v218:1 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


