新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是围生期急性缺氧缺血导致的最常见中枢神经系统疾病。尽管多种综合治疗包括亚低温治疗(therapeutic mild hypothermia)已用于中重度的HIE,但是其不良的神经发育预后仍没有根本改变[1]。虽然很多国家包括我国已经普遍接受了美国妇产科学会的关于严重产时窒息(可导致脑瘫的严重产时窒息)的诊断标准[2],并作为临床诊断HIE的依据,但是HIE的诊断与临床分度缺少神经病理学依据[3-4],因此很难用于准确的预后分析;同时,由于缺氧缺血损伤的异质性即病因、程度、表现形式、持续时间,及脑发育成熟度的不同,HIE的神经损伤类型可表现多种形式[5-6]。因此,客观准确地描述脑损伤的结构、代谢、功能和发育异常是HIE治疗和预后评价的必然需求。
超声或者CT检查都不能准确反映HIE神经病理类型。CT因射线损伤风险已不再建议用于稳定的HIE患儿,只用于有明确产伤史表现出贫血或凝血功能障碍的HIE患儿,以除外颅内出血。MRI已成为急性新生儿脑病的首选[7]。MRI常规扫描序列、弥散加权序列(MRI-diffusion weighted imaging, DWI)和磁共振波谱(magnetic resonance spectroscopy, MRS)最常应用于HIE的诊断与评价,提供了丰富的损伤、发育与脑代谢信息[7]。合理选择MRI检查有助于明确HIE的损伤类型、损伤发生时间、病理演变性质、不同时期脑代谢变化,指导HIE治疗及客观评价预后[8-10]。
迄今为止,MRI应用于新生儿脑损伤与发育的评估已有近30年历史,然而在我国尚没有普遍开展,更缺少统一的诊断评价规范。HIE的诊断与预后评价研究众多,为科学制定HIE-MRI诊断规范提供了客观依据。在HIE诊断与预后评价方面广泛科学地应用MRI技术,将提升对新生儿脑损伤的认识,提高我国HIE诊断与预后评价水平。
1 MRI设备选择与检查的准备新生儿接受MRI检查既要获得较好的图像质量,又要兼顾检查过程安全,因此要尽可能缩短检查时间,检查过程应有新生儿医生参加,配备与MRI检查兼容的心电和脉搏血氧监护仪,以及必要的新生儿急救物品。MRI仪磁场强度最好为1.5Tesla或3.0Tesla。患儿在检查前应做以下准备:(1)去除患儿身上的金属物品,若需要输液,可在非头部留置管(可用MRI兼容的输液泵);(2)镇静,足月新生儿可以应用水合氯醛(25~50 mg/kg)鼻饲或直肠注入,早产儿可用苯巴比妥(5~10 mg/kg)缓慢静脉注射。实际上,新生儿若有抽真空的保温被,绝大部分不需要镇静;(3)MRI扫描过程中在射频脉冲梯度转换时会产生巨大噪声,因此必须护耳;(4)检查前应清理气道,保持气道通畅,并注意很好地包裹患儿、保温;(5)连接好血氧、心电监护仪,保证其在检查过程中正常工作;(6)特别需要保温的早产儿,可以应用与MRI仪兼容的保温箱;(7)需要机械通气的患儿可应用与MRI仪兼容的呼吸机,也可以短时间手动人工通气,但是应有血氧、心电监护。
2 常规MRI检查时机选择及参数设置 2.1 检查序列参数设置HIE患儿的MRI常规检查序列包括T1WI、T2WI和DWI,这三种序列主要用于结构性损伤的诊断和一般的发育评价。
若进行脑内不同区域的代谢物分析可应用1H-MRS,主要分析乳酸(Lac)、N-乙酰天门冬氨酸盐(NAA)、胆碱(Cho)、肌酐(Cr)、谷氨酸盐(Glu)、谷氨酰胺(Gln)、肌醇(myo),以及31P-MRS,主要分析能量代谢物质ATP、ADP、PCr、Pi和pH。
若怀疑有血管源性的损伤或发育畸形可选择MRA(磁共振血管成像,多半为动脉血管成像)、MRV(磁共振静脉血管成像),鉴别出血和非出血性损伤可选用MRI磁敏感加权成像(susceptibility weighted imaging, SWI)。
新生儿时期大脑快速发育,不同的脑发育成熟度脑含水量不同、髓鞘化发育程度不同,MRI常规扫描序列参数完全不同于成人。序列扫描参数的选择应结合不同场强和检查目的作出相应调整,供应商提供的参数仅供参考,并且放射诊断医师和设备工程师应与新生儿医师相配合。以下常规扫描序列参数供参考(表 1、2)[11]。
| 表 1 1.5T MRI仪建议扫描参数 |
|
|
| 表 2 3T MRI仪建议扫描参数 |
|
|
1H-MRS常用于HIE脑损伤时脑代谢评价。系统分析研究表明,新生儿时期采用基底节区Lac/NAA对HIE预后判定的敏感性和特异性比常规MRI要好,分别为82%和95%。目前可以选用单体素或多体素MRS进行脑不同区域MRS分析。既往常用的单体素检查序列有PRESS(single-voxel point resolved spectroscopy)或STEAM(stimulate echo acquisition mode),建议使用更长的回波时间(echo time, ET)如136 ms或272 ms。ET时间越短所分析代谢物浓度的标准差越大,而且ET 136 ms时Lac峰倒置,有助于与脂类物质鉴别[12-13]。目前多体素1H-MRS空间分辨高于单体素,能更准确地分析不同区域代谢物质浓度。
2.2 常规MRI及DWI检查的时机选择由于导致窒息的病因和程度不同,以及不同个体脑发育成熟度的不同,临床上不同严重程度HIE有不同的神经病理类型,脑损伤既表现有选择性,又表现出等级性。任何MRI检查反映的都是检查时刻的脑损伤状态,合理选择检查时机对准确判定脑损伤程度尤为重要。缺氧缺血后脑损伤的细胞代谢和病理改变不同于急性缺血性脑损伤(脑梗死),细胞代谢在缺血再灌注后表现暂时性代谢正常(多在生后6 h内),但很快可发生继发性能量衰竭,这是严重细胞坏死的表现,多在损伤后24~72 h脑组织细胞毒性水肿达到高峰[14]。DWI研究表明,生后2~4 d的水分子运动受限最严重(水分子表观扩散系数,即ADC值达到最低),随后逐渐上升,8~10 d与正常儿的差异无显著性,ADC变化与是否接受亚低温治疗无明显关系[15-16]。所以,MRI-DWI检查的最佳时机是生后2~4 d。当然不同区域损伤的变化并不完全一致,严重HIE在生后24 h内丘脑和基底节即可有明显异常。国外建议首次常规T1WI和T2WI检查可选择在损伤后的2~8 d,我们认为损伤后4~8 d更好[17]。研究表明晚期的T2WI改变对HIE预后评价意义更大[18]。
3 新生儿缺氧缺血性脑病MRI诊断与分类 3.1 丘脑基底节+内囊后肢受累急性完全性窒息通常使丘脑最先受累,特别是丘脑腹外侧核;基底节最易受累核团为壳核,通常苍白球很少受累。HIE急性期T1WI表现为高信号,T2WI为低信号,DWI为高信号;慢性期表现为萎缩或坏死:T2WI表现为高信号,而T1WI信号正常或降低,DWI正常信号或低信号。依据受累范围划分损伤的严重程度,严重者丘脑或基底节完全受累,常伴有罗兰氏区周围皮层、间脑和脑干受累。内囊后肢(posterior limb of internal capsules, PLIC)正常情况下为T1WI高信号、且接近内囊的膝部,T2WI为低信号至少占整个后肢的1/3。PLIC受累可表现为:(1)可疑受累:PLIC在T1WI/T2WI信号减低或出现不对称性改变;(2)明显受累:PLIC在T1WI/T2WI信号出现反转。见图 1~4。
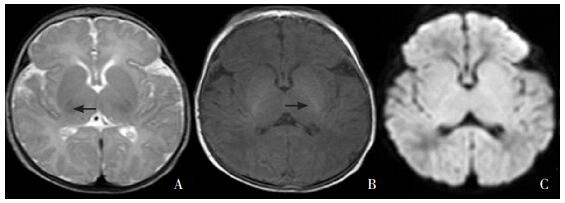
|
图 1 正常足月新生儿MRI的T2WI(A)、T1WI(B)与DWI(C)序列图像 内囊后肢在T2WI表现为低信号、T1WI为对称性高信号(如箭头所示),DWI通常不明显,深部灰质及皮层的信号在三个序列的表现一致。 |
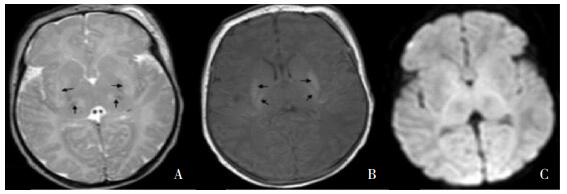
|
图 2 基底节/丘脑PLIC损伤 HIE患儿生后10天,壳核、丘脑腹外侧核在T2WI(A)表现为对称性高信号、T1WI(B)亦表现高信号,如箭头所示;内囊后肢信号消失;DWI(C)仅表现为双侧丘脑信号降低。 |
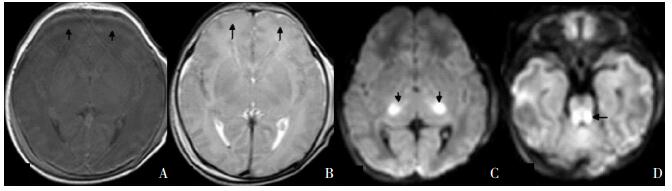
|
图 3 基底节/丘脑、内囊后肢及脑干损伤 重度HIE生后30 h的MRI可见T1WI(A)、T2WI(B)额叶皮层及皮层下白质信号可清晰分辨,内囊后肢正常信号消失,似乎整个基底节/丘脑均有受累,DWI(C)明显丘脑受累异常高信号,脑干后部(锥体束)DWI异常高信号(D),如箭头所示。 |
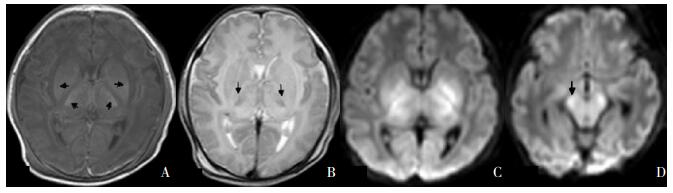
|
图 4 基底节/丘脑、内囊后肢及大脑脚损伤 重度HIE患儿生后8 d的MRI可见T1WI(A)、T2WI(B)绝大部分基底节与丘脑受累,如箭头所示;内囊后肢正常信号完全消失;DWI(C、D)丘脑、基底节、大脑脚表现异常高信号,如箭头所示。 |
分水岭受累区域的血流供应处于血管的边界区或终末区,依据受累程度表现为单一梗死、前部或后部分水岭白质异常、前部或后部分水岭区皮层和白质异常、前后白质均受累和广泛性皮层受累。受累区域T1WI表现为低信号,T2WI为高信号,DWI为高信号。见图 5、7。广泛严重的皮层与皮层下白质受累,T1WI/T2WI灰白质分辨不清,DWI为广泛高信号。临床上确实发现广泛皮层下白质受累有的最后发生广泛脑萎缩,还应与代谢原因所致的白质损伤进行鉴别[11, 19-20]。
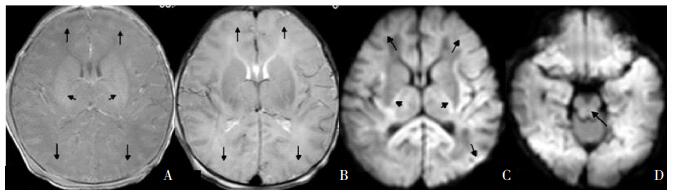
|
图 5 分水岭样损伤 重度HIE患儿生后96 h MRI的T1WI(A)表现为灰白质分辨不清,额叶及顶枕区皮层及白质弥漫性低信号,内囊后肢正常高信号消失;T2WI(B)表现为高信号,内囊后肢可见少许低信号;DWI(C,D)的上述区域表现为高信号,内囊后肢、胼胝体压部、颞叶皮层、白质、脑干均有受累,如箭头所示,符合全脑型损伤。 |
|
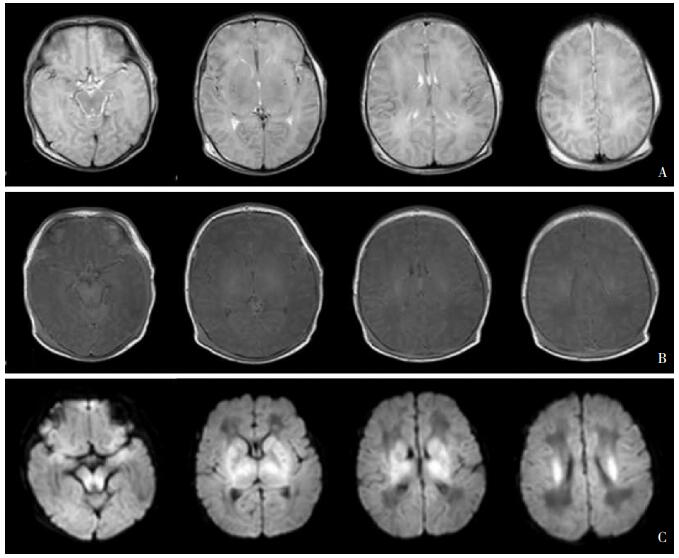
图 7 全脑型损伤 重度HIE生后72 h MRI见脑肿胀,T2WI(A)、T1WI(B)灰白质广泛分辨不清,基底节、丘脑脑干及半卵圆中心DWI(C)表现高信号。 |
白质损伤主要分布在脑室周围及半卵圆中心区白质,病变特征为点状,数量不等,有时呈线状或成簇存在。早期T1WI为高信号,T2WI为低信号或等信号,DWI为高信号。见图 6。SWI多数不表现信号的缺失(低信号),提示改变的主要原因是胶质细胞增生。多灶性损伤病灶周围的白质可表现明显的T2WI高信号。也有放射诊断专家认为局灶-多灶性微小性白质损伤属于分水岭样损伤,不过最近研究表明它是足月新生儿HIE很常见的一种损伤,可能与胎盘炎症反应程度有关[21-24],但尚不清楚是否是由于炎症反应导致胎盘功能不全、进而发生胎儿缺氧缺血和新生儿窒息所致[25]。此外该类型多发生在早期足月新生儿,也是早产儿常见的脑白质损伤类型。因此,我们把它单独作为一种类型。
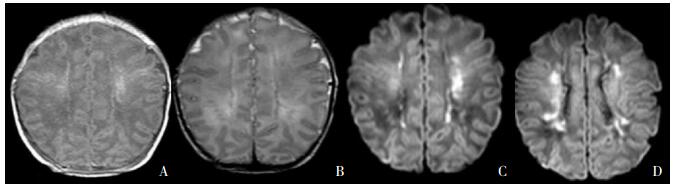
|
图 6 局灶性白质损伤 中度HIE生后4 d MRI的T1WI(A)表现为半卵圆中心白质对称性线状高信号,T2WI(B)低信号,DWI(C、D)为高信号。 |
广泛全脑性损存在深部灰质和皮层广泛受累,也可累及广泛的白质,受累区域表现为严重脑水肿(脑肿胀)、灰白质分辨不清、MRI长T1和T2信号(T1WI低信号,T2WI高信号)、DWI广泛高信号。见图 7。由于检查时机不同,受累区域可有不同表现,早期主要为灰质区域受累,逐渐累及广泛白质。值得说明的是,罗兰氏区、基底节、内囊后肢、间脑和脑干是高能量代谢区,也是髓鞘化成熟的区域,它们的受累不但体现了神经损伤的选择性,发生在严重HIE患儿时也体现了明显的等级性。脑干损伤的HIE患儿死亡风险极高。
3.5 新生儿缺氧缺血性脑病MRI分类的评分系统上述HIE的MRI分类表现常混合存在,也就是HIE可有多个区域脑组织获得损伤,但严重程度可以有很大差异,体现了神经损伤的选择性和等级性。依据Barkovich的早期评分系统[18],结合DWI-MRI表现,改良HIE-MRI分类的损伤评分系统,可以定量评价脑损伤类型和严重程度(见表 3)。
| 表 3 改良Barkovich的HIE MRI影像学评分* |
|
|
Volpe[6]总结众多HIE的MRI研究结果,提出MRI四种基本类型与HIE神经病理类型(足月新生猴和羊)的相关性:(1)脑皮层/皮层下白质+基底节+脑干受累与严重持久的缺氧缺血有关;(2)脑皮层/皮层下白质或基底节常同时存在,与中等程度持久和/或间断性缺氧缺血有关;(3)基底节和脑干受累与严重短暂的缺氧缺血有关;(4)脑白质受累往往与轻中度间歇性或反复的缺氧缺血有关,这个过程有时合并低血糖或感染的炎症反应性损伤。
本建议提出的HIE MRI诊断及分类与Volpe的研究相近。对于严重HIE患儿,一次MRI检查很难发现所有的结构受累,Volpe的分类没有阐明PLIC的改变。PLIC受累的严重程度与HIE的运动发育高度相关:HIE越重,PLIC受累越重,严重的BG/T+PLIC受累既表现有运动障碍,又表现有认知障碍[6, 26-27]。通常,严重完全性窒息损伤的区域主要沿着皮质脊髓束分布,而部分性窒息损伤区域主要是血管边界区。围产期窒息患儿常有低血糖发生,严重低血糖可导致顶枕部皮层和白质受累,在T1WI为低信号,T2WI为高信号,早期DWI为高信号,DWI改变往往比T1WI/T2WI更敏感。低血糖脑损伤与HIE脑损伤具有相对的独立性[28]。在应用MRI诊断HIE时除了要结合窒息的严重程度,也应该关注病因。急性围产期不良事件是导致急性完全性窒息的重要原因,而反复缺血和/或缺氧以及感染导致部分性窒息而发生白质损伤。此外,HIE的严重程度与影像学分类虽然有很好的对应关系,但同为重度或中度的HIE其MRI损伤可以表现出多样性,也预示远期结局不同;不同时期的损伤表现代表着神经损伤的发展过程,因此动态MRI检查对HIE预后的判定具有重要意义。
| [1] |
Robertson NJ, Tan S, Groenendaal F, et al. Which neuroprotective agents are ready for bench to bedside translation in the newborn infant?[J]. J Pediatr, 2012, 160(4): 544-552. DOI:10.1016/j.jpeds.2011.12.052 (  0) 0) |
| [2] |
Phelan JP, Korst LM, Martin GI. Application of criteria developed by the task force on neonatal encephaloapthy and cerebral palsy to acutely asphyxiated neonates[J]. Obstet Gynecol, 2011, 118(4): 824-830. DOI:10.1097/AOG.0b013e31822f1713 (  0) 0) |
| [3] |
Graham EM, Ruis KA, Hartman AL, et al. A systematic review of the role of intrapartum hypoxia-ischemia in the causation of neonatal encephaloapthy[J]. Am J Obstet Gynecol, 2008, 199(6): 587-595. DOI:10.1016/j.ajog.2008.06.094 (  0) 0) |
| [4] |
中华医学会儿科学分会新生儿学组. 新生儿缺氧缺血性脑病诊断标准[J]. 中国当代儿科杂志, 2005, 7(2): 97-98. (  0) 0) |
| [5] |
Barkovich AJ, Westmark K, Partridge C, et al. Perinatal asphyxia:MR findings in the first 10 days[J]. AJNR Am J Neuroradiol, 1995, 16(3): 427-438. (  0) 0) |
| [6] |
Volpe JJ. Neonatal encephalopathy:an inadequate term for hypoxic-ischemic encephaloapthy[J]. Ann Neurol, 2012, 72(2): 156-166. DOI:10.1002/ana.v72.2 (  0) 0) |
| [7] |
Barkovich AJ, Miller SP, Bartha A, et al. MR imaging, MR spectroscopy, and diffusion tensor imaging of sequential studies in neonates with encephalopathy[J]. AJNR Am J Neuroradiol, 2006, 27(3): 533-547. (  0) 0) |
| [8] |
Thayyil S, Chandrasekaran M, Taylor A, et al. Cerebral magnetic resonance biomarkers in neonatal encephalopahty:a meta-analysis[J]. Pediatrics, 2010, 125(2): e382-e395. DOI:10.1542/peds.2009-1046 (  0) 0) |
| [9] |
Rutherford M, Ramenghi LA, Edwarsds AD, et al. Assessment of brain tissue injury after moderate hypothermia in neonates with hypoxic-ischemic encephaloapthy:a nested substudy of a randomized controlled trial[J]. Lancet Neurol, 2010, 9(1): 39-45. DOI:10.1016/S1474-4422(09)70295-9 (  0) 0) |
| [10] |
Cheong JL, Coleman L, Hunt RW, et al. Prognostic utility of magnetic resonance imaging in neonatal hypoxic-ischemic encephalopahty[J]. Arch Pediatr Adolesc Med, 2012, 166(7): 634-640. (  0) 0) |
| [11] |
Rutherford M, Malamatensiou C, McGuinness A, et al. Magnetic resonance imaging in hypoxic-ischemic encephalopathy[J]. Early Hum Dev, 2010, 86(3): 351-360. (  0) 0) |
| [12] |
Holshouser BA, Ashwal S, Shu S, et al. Proton MR spectroscopy in children with acute brain injury:comparison of short and long echo time acquisitions[J]. J Magn Reson Imaging, 2000, 11(1): 9-19. DOI:10.1002/(ISSN)1522-2586 (  0) 0) |
| [13] |
Roelants-Van Rijn AM, van der Grond J, de Vries LS, et al. Value of 1H-MRS using different echo times in neonates with cerebral hypoxia-ischemia[J]. Pediatr Res, 2001, 49(3): 356-362. DOI:10.1203/00006450-200103000-00009 (  0) 0) |
| [14] |
Azzopardi D, Edwards AD. Magnetic resonance biomarkers of neuroprotective effects in infants with hypoxic-ischemi encephaloapthy[J]. Semin Fetal Neonatal Med, 2010, 15(2): 261-269. (  0) 0) |
| [15] |
McKinstry RC, Miller JH, Snyder AZ, et al. A prospective, longitudinal diffusion tensor imaging study of brain injury in newborns[J]. Neurology, 2002, 59(6): 824-833. DOI:10.1212/WNL.59.6.824 (  0) 0) |
| [16] |
Bednarek N, Mathur A, Inder T, et al. Impact of therapeutic hypothermia on MRI diffusion changes in neonatal encephalopathy[J]. Neurology, 2012, 78(18): 1420-1427. DOI:10.1212/WNL.0b013e318253d589 (  0) 0) |
| [17] |
Ment LR, Bada HS, Barnes P, et al. Practice parameter:Neuroimaging of the neonate:report of the quality standards subcommittee of the American academy of neurology and the practice committee of the child neurology society[J]. Neurology, 2002, 58(12): 1726-1738. DOI:10.1212/WNL.58.12.1726 (  0) 0) |
| [18] |
Barkovich AJ, Hajnal BL, Vigneron D, et al. Prediction of neuromotor outcome in perinatal asphyxia:evaluation of MR scoring systems[J]. AJNR Am J Neuroradiol, 1998, 19(1): 143-149. (  0) 0) |
| [19] |
Perlman JM. Intrapartum asphyxia and cerebral palsy is there link?[J]. Clin Perinatol, 2006, 33(2): 335-353. DOI:10.1016/j.clp.2006.03.004 (  0) 0) |
| [20] |
Otaduy MC, Leite CC, Lacerda MT, et al. Proton MR spectroscopy and imaging of a galactosemic patient before and after dietary treatment[J]. AJNR Am J Neuroradiol, 2006, 27(1): 204-207. (  0) 0) |
| [21] |
Chau V, Poskitt KJ, Sargent MA, et al. Comparison of computer tomography and magnetic resonance imaging scans on the third day of life in term newborns with neonatal encephalopathy[J]. Pediatrs, 2009, 123(1): 319-326. DOI:10.1542/peds.2008-0283 (  0) 0) |
| [22] |
Martinez-Biarge M, Bregant T, Countney J, et al. White matter and cortical injury in hypoxic-ischemic encephalopathy:antecedent factor and 2 year outcome[J]. J Pediatr, 2012, 161(5): 799-807. DOI:10.1016/j.jpeds.2012.04.054 (  0) 0) |
| [23] |
Li AM, Chau V, Poskitt KJ, et al. White matter injury in term newborns with neonatal encephalopathy[J]. Pediatr Res, 2009, 65(1): 85-89. DOI:10.1203/PDR.0b013e31818912d2 (  0) 0) |
| [24] |
Barrett MJ, Donoghue V, Mooney EE, et al. Isolated acute non-cystic white matter injury in term infants presenting with neonatal encephalopathy[J]. Arch Dis Child Fetal Neonatal, 2013, 98(2): F158-F160. DOI:10.1136/archdischild-2011-301505 (  0) 0) |
| [25] |
Harteman JC, Nikkels PG, Benders MJ, et al. Placental pathology in full-term infants with hypoxic-ischemic neonatal encephalopathy and association with magnetic resonance imaging pattern of brain injury[J]. J Pediatr, 2013, 163(4): 968-995. DOI:10.1016/j.jpeds.2013.06.010 (  0) 0) |
| [26] |
Martinez-Biarge M, Diez-Sebastian J, Rurherford MA, et al. Outcome after central grey matter injury in term perinatal hypoxic-ischemic encephalopathy[J]. Early Hum Dev, 2010, 86(11): 675-682. DOI:10.1016/j.earlhumdev.2010.08.013 (  0) 0) |
| [27] |
Martinez-Biarge M, Diez-Sebastian J, Kapellou O, et al. Predicting motor outcome and death in term hypoxic-ischemic encephalopathy[J]. Neurology, 2011, 76(24): 2055-2061. DOI:10.1212/WNL.0b013e31821f442d (  0) 0) |
| [28] |
Wong DS, Poskitt KJ, Chau V, et al. Brai injury patterns in hypoglycemia in neonatal encephalopathy[J]. AJNR Am J Neuroradiol, 2013, 34(7): 1456-1461. DOI:10.3174/ajnr.A3423 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


