急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)是儿童时期最常见的恶性肿瘤。儿童ALL疗效好,5年无事件生存率达70%~90%。但感染尤其是肺部感染发生率高,是导致ALL患儿早期死亡的首要原因[1]。部分ALL患儿肺部感染可仅表现为发热,而且感染的病原体难以明确,影响早期抗感染疗效[2-4]。肺部多层螺旋CT不仅灵敏度高,亦有利于肺部感染性质及程度的早期判断,是肺部感染早期定性诊断的重要方法[5]。但目前关于儿童ALL化疗后合并肺部感染的肺部CT影像学特点研究较少。为此,本研究拟通过分析化疗后合并肺部感染ALL患儿的临床特征、肺部CT影像学特点,探讨化疗后肺部感染的早期诊断方法,以指导临床治疗,从而缩短肺部感染病程、降低死亡率。
1 资料与方法 1.1 研究对象以南方医科大学南方医院儿科2015年1月至2016年12月146名采用CCCG-ALL-2015方案[6]化疗的ALL患儿为研究对象,其中108名共115例次在化疗过程中出现新发肺部感染,并经过肺部多层螺旋CT确诊。肺部CT检查指征:(1)广谱抗生素治疗3天后发热、咳嗽、气促等临床表现无好转;(2)临床表现及胸片提示重症肺炎;(3)感染部位不明确的感染性发热。108名患儿中男71名、女37名,年龄为1~14岁,平均5±3岁。
ALL的诊断参照CCCG-ALL-2015方案[6]进行。肺部真菌感染根据血液病/恶性肿瘤患者侵袭性真菌病(invasive fungal infection, IFI)的诊断标准[7]进行诊断,分为确诊、临床诊断及拟诊。肺部细菌感染者根据临床表现,以及血培养或咽拭子培养阳性的标准进行诊断[8]。肺部非典型病原体和病毒感染根据临床表现,以及血清学特异性抗体滴度的测定阳性的标准进行诊断[9]。
1.2 研究方法收集化疗后合并肺部感染ALL患儿的临床资料,包括一般情况、化疗阶段、中性粒细胞绝对计数、病原体检测结果及肺部多层螺旋CT表现,探究化疗方案、中性粒细胞绝对计数与肺部感染的关系,比较细菌性肺部感染与真菌性肺部感染肺部CT表现的差异。
采用GE公司Lightspeed16层螺旋CT扫描仪对肺尖至肺底进行扫描,扫描的层厚是5 mm,层间隔是0.1 mm。对选取的CT影像资料,采用影像中心PACS系统通过肺窗(窗宽:1 300~1 500 HU,窗位:-350~-550 HU)和软组织窗(窗宽:340~360 HU,窗位:30~50 HU)完成测量。CT图像由三位资深影像科医师进行分析并得出结果,肺部感染的CT特点主要为:磨玻璃影、实变影、晕轮征、空洞、结节、空气支气管征、网格影、索条影、胸腔积液、肺门或纵膈淋巴结和胸膜增厚。
1.3 统计学分析使用SPSS 22.0软件进行统计学处理。正态分布的计量资料用均数±标准差(x±s)表示;多个样本率间的两两比较采用χ2分割法;四格表资料采用Fisher's精确概率检验。P < 0.05为差异有统计学意义。
2 结果 2.1 肺部感染与化疗阶段的关系115例次完成诱导缓解化疗且合并肺部感染的患儿中有89例次(77.4%)发生于诱导缓解阶段;完成巩固化疗的105例次患儿在该阶段未发生肺部感染;76例次患儿于间期化疗中24例次(31.6%)发生肺部感染;因患者均未完成维持阶段化疗,故该阶段的肺部感染发生率没有进行统计。肺部感染发生率以诱导缓解阶段最高、巩固阶段最低(χ2=141.17,P < 0.05)。89例次诱导缓解阶段感染的患儿中,7例次(8%)感染发生于开始化疗后的15 d,12例次(14%)发生于16~30 d,37例次(42%)发生于31~45 d,33例次(37%)发生于46~60 d,可见诱导缓解阶段的肺部感染绝大部分发生于化疗后的31~60 d。见图 1。
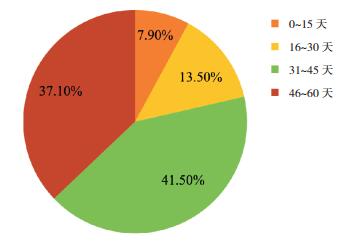
|
图 1 诱导缓解阶段发生肺部感染的89例次ALL患儿的感染发生时间 |
115例次化疗后合并肺部感染的ALL患儿中,粒缺(N < 0.5×109/L)患儿所占比例最高(67.0%,77/115),粒细胞减少(N:0.5~1.5×109/L)患儿占12.2%(14/115),N > 1.5×109/L患儿的比例为20.9%(24/115),差异具有统计学意义(χ2=89.713,P < 0.05)。
2.3 肺部感染的病原学特征115例次化疗后合并肺部感染的ALL患儿中,病原学确诊或拟诊的41例次,其中细菌感染15例次,临床诊断真菌感染14例次、拟诊真菌感染3例次,混合感染6例次,支原体感染2例次,病毒感染1例次。见表 1。
| 表 1 病原学明确或拟诊的41例次肺部感染ALL儿童的病原体分布情况 |
|
|
在115例次化疗后合并肺部感染ALL患儿中,最常见的肺部CT表现为磨玻璃影(66/115,57.4%),其次为磨玻璃影与实变影同时出现(39/115,33.9%),网格或索条影的发生率均为33.0%(38/115)。再其次为胸膜增厚(33/115,28.7%)、结节(31/115,27.0%)、肺门或纵膈淋巴结肿大(26/115,22.6%)、胸腔积液(24/115,20.9%),空气支气管征(20/115,17.4%),晕轮征或空洞(9/115,7.8%)以及实变影(1/115,0.9%)。细菌感染的肺部CT表现以网格或索条影(47%)、磨玻璃影(40%)、磨玻璃影与实变影(40%)为主,真菌感染主要表现为磨玻璃影与实变影(65%)、胸腔积液(53%),支原体感染基本表现为网格或索条影(100%),病毒或混合感染以及病原体不明者均以磨玻璃影(100%、83%、64%)为主。见表 2。
| 表 2 化疗后合并肺部感染的115例次ALL患儿的CT表现 |
|
|
化疗过程中合并肺部感染患者的肺部CT表现复杂多样,对细菌与真菌肺部感染的肺部CT表现的发生率进行统计分析,差异无统计学意义(P > 0.05),见表 3。
| 表 3 细菌或真菌肺部感染患儿的肺部CT表现比较 |
|
|
本研究结果显示,ALL患儿化疗后合并的肺部感染77.4%发生于诱导缓解阶段,发生于巩固阶段的比例最低,诱导缓解阶段又以化疗第31~60天为感染高峰期。Inaba等[10]和陈再生等[11]的研究也表明,儿童ALL化疗后感染多发生于诱导缓解阶段。这可能与诱导缓解治疗的激素剂量大且时间长有关。一方面,激素可抑制多形核细胞的趋化作用;另一方面,激素通过抑制非氧化过程和损害溶酶体活性来抑制单核、巨噬细胞杀死细菌或真菌的能力[12]。此外,Biswal等[13]认为ALL诱导缓解阶段感染风险增加还与粒缺、黏膜损伤、有创操作、骨穿和输血等有关。本研究结果也显示化疗后合并肺部感染的患儿中粒缺患儿所占比例最高。故当患者处于诱导缓解阶段的粒缺状态时,应加强全环境保护预防感染发生。
本研究结果显示115例次化疗后合并肺部感染的ALL患儿中,真菌感染发生率稍高于细菌感染。可能与本研究患儿肺部感染在诱导缓解阶段发生率高,该阶段存在糖皮质激素使用超过3周的IFI宿主因素有关。研究表明,过去十年间,急性白血病合并感染的患者中,G-菌感染发生率逐渐下降,而G+菌感染的发生率上升[14]。Ali等[15]研究表明,干细胞移植继发感染的患者中表皮葡萄球菌为常见的G+菌,而G-菌以大肠杆菌为多。本研究合并肺部细菌感染的儿童ALL患者中,G+菌感染高于G-菌,G+菌以表皮葡萄球菌和星座链球菌常见,G-菌以铜绿假单胞菌,与文献相符。
儿童ALL化疗后合并肺部感染时,肺部CT的表现复杂且多样。本研究结果显示,各种肺部CT表现在细菌和真菌肺部感染间的发生率差异虽无统计学意义,但晕轮征或空洞在肺部真菌感染患儿中的发生率稍高。肺部CT的晕轮征和新月形空气征是肺部IFI的特征性表现[16]。这主要是因为真菌可能侵蚀肺部小血管,在肺部CT则表现为肺结节影周围环绕低密度影,即“晕轮征”;病灶内的坏死物质排出形成“空洞”,而坏死物质未完全经支气管排出的,CT表现为“新月征”。
综上所述,ALL患儿在化疗诱导缓解阶段尤其是粒细胞缺乏时,肺部感染发生率高,细菌和真菌是主要病原体,但也应注意混合感染或其他病原体感染的可能。肺部影像学的改变缺乏特异性,肺部感染性质的明确需结合临床表现、实验室检查进行综合分析。当ALL患儿出现严重肺部感染的临床表现时,有必要行肺部CT检查。
| [1] |
Cheng S, Pole JD, Sung L. Early deaths in pediatric acute leukemia:a population-based study[J]. Leuk Lymphoma, 2014, 55(7): 1518-1522. DOI:10.3109/10428194.2013.850685 (  0) 0) |
| [2] |
Depasse J, Caniza M A, Quessar A, et al. Infections in hospitalized children and young adults with acute leukemia in Morocco[J]. Pediatr Blood Cancer, 2013, 60(6): 916-922. DOI:10.1002/pbc.v60.6 (  0) 0) |
| [3] |
Taj M, Farzana T, Shah T, et al. Clinical and microbiological profile of pathogens in febrile neutropenia in hematological malignancies:A single center prospective analysis[J]. J Oncol, 2015, 2015: 596504. (  0) 0) |
| [4] |
Noorifard M, Sekhavati E, Jalaei Khoo H, et al. Epidemiology and clinical manifestation of fungal infection related to Mucormycosis in hematologic malignancies[J]. J Med Life, 2015, 8(Spec Iss 2): 32-37. (  0) 0) |
| [5] |
Gulati M, Kaur R, Jha V, et al. High-resolution CT in renal transplant patients with suspected pulmonary infections[J]. Acta Radiol, 2000, 41(3): 237-241. DOI:10.1080/028418500127345415 (  0) 0) |
| [6] |
徐基昕, 孔令军, 张淑红, 等. 甲氨蝶呤治疗儿童急性淋巴细胞白血病致白质脑病二例[J]. 白血病·淋巴瘤, 2016, 25(10): 623-625. DOI:10.3760/cma.j.issn.1009-9921.2016.10.014 (  0) 0) |
| [7] |
黄晓军. 血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第四次修订版)[J]. 中华内科杂志, 2013, 52(8): 710-711. (  0) 0) |
| [8] |
Driscoll A J, Deloria Knoll M, Hammitt LL, et al. The effect of antibiotic exposure and specimen volume on the detection of bacterial pathogens in children with pneumonia[J]. Clin Infect Dis, 2017, 64(Suppl 3): S368-S377. (  0) 0) |
| [9] |
Chen K, Jia R, Li L, et al. The aetiology of community associated pneumonia in children in Nanjing, China and aetiological patterns associated with age and season[J]. BMC Public Health, 2015, 15: 113. DOI:10.1186/s12889-015-1422-1 (  0) 0) |
| [10] |
Inaba H, Pei D, Wolf J, et al. Infection-related complications during treatment for childhood acute lymphoblastic leukemia[J]. Ann Oncol, 2017, 28(2): 386-392. (  0) 0) |
| [11] |
陈再生, 郑灵, 陈以乔, 等. 儿童急性淋巴细胞白血病诱导缓解期感染的病原菌及耐药情况分析[J]. 中国当代儿科杂志, 2017, 19(2): 176-181. DOI:10.7499/j.issn.1008-8830.2017.02.010 (  0) 0) |
| [12] |
Pagano L, Caira M. Risks for infection in patients with myelodysplasia and acute leukemia[J]. Curr Opin Infect Dis, 2012, 25(6): 612-618. DOI:10.1097/QCO.0b013e328358b000 (  0) 0) |
| [13] |
Biswal S, Godnaik C. Incidence and management of infections in patients with acute leukemia following chemotherapy in general wards[J]. Ecancermedicalscience, 2013, 7: 310. (  0) 0) |
| [14] |
Hakim H, Flynn PM, Knapp KM, et al. Etiology and clinical course of febrile neutropenia in children with cancer[J]. J Pediatr Hematol Oncol, 2009, 31(9): 623-629. DOI:10.1097/MPH.0b013e3181b1edc6 (  0) 0) |
| [15] |
Ali N, Adil SN, Shaikh MU. Bloodstream and central line isolates from hematopoietic stem cell transplant recipients:data from a developing country[J]. Transpl Infect Dis, 2014, 16(1): 98-105. DOI:10.1111/tid.2014.16.issue-1 (  0) 0) |
| [16] |
Patterson TF, Kirkpatrick WR, White M, et al. Invasive aspergillosis. Disease spectrum, treatment practices, and outcomes. I3 Aspergillus Study Group[J]. Medicine (Baltimore, 2000, 79(4): 250-260. DOI:10.1097/00005792-200007000-00006 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


