颞叶癫癎是儿童临床上最常见的难治性癫癎之一[1],其发病机制一直是目前癫癎研究的热点。颞叶癫癎的病理表现主要为海马齿状回(DG)、CA1及CA3区的神经元丢失、代偿的胶质增生、新生颗粒细胞的形成及突触的重建和异常神经环路的形成。癫癎后海马DG新生神经元可出现树突的延长并伸入至CA3区内分子层与锥体细胞树突形成新的突触联系,从而形成新的异常的神经环路,成为自发性癎性发作的爆发点[2]。研究表明,在人类颞叶癫癎及其动物模型中,其海马环路内的苔藓纤维出芽和突触重建与癫癎的发生、发展关系密切[3]。苔藓纤维出芽及突触重建的分子机制与轴突导向相关的分子密不可分,而在脊椎动物中枢神经系统的正常发育中,Eph受体及其配体ephrin发挥着轴突导向的重要作用,并在海马内有着广泛的表达[4]。本课题组以前的研究发现EphA5受体和ephrinA3配体在癫癎后海马CA1区中的表达变化及对轴突出芽的影响[5],在最新的研究中发现EphA5受体也可与配体ephrinA5相互作用[6],并可在海马发育的突触连接和突触重建上发挥重要的作用[7]。Shu等[8]应用匹罗卡品(PILO)癫癎小鼠模型发现慢性期海马内ephrinA5表达上调,并通过将相应的ephrinA5干扰剂注入致癎海马后,发现对癫癎的发作有抑制作用,提示了ephrinA5与癫癎发生、发展的密切关系。因此,本研究将癫癎后海马的CA3区及DG作为主要的研究区域,应用与人颞叶癫癎的临床及病理特征相似的氯化锂(LiCl)-PILO致癎大鼠模型,分别在致癎后的急性期、静止期和慢性期,观察ephrinA5 mRNA及EphA5蛋白在海马的CA3区及DG表达的动态变化,并研究海马CA3区的苔藓纤维出芽的情况,探讨EphA5/ephrinA5在颞叶癫癎苔藓纤维出芽、突触重建中可能作用,进一步研究其在颞叶癫癎中的作用机制。
1 材料与方法 1.1 动物模型制作6~8周龄健康雄性Sprague-Dawley(SD)大鼠240只,体重220~250 g,由中南大学湘雅医学院动物学部提供,将240只大鼠随机分为对照组(n=120)和癫癎组(n=120)。癫癎组动物腹腔注射LiCl(美国Boehringer Mannheim公司)3 mEq/kg(约125 mg/kg),18 h后腹腔注射PILO(美国Sigma公司),每次10 mg/kg,每30 min 1次,直至大鼠出现癫癎持续状态(SE)30 min则可以10%水合氯醛终止发作,发作程度按Racine制定的标准进行分级[9]。在致癎后分别选取12 h、24 h、7 d、15 d、30 d和60 d 6个时间点为亚组(n=20),其时间点分别位于LiCl-PILO模型的急性期(SE后24 h内)、静止期(SE后7~15 d)和慢性期(SE后30~60 d),对照组选取与癫癎组相对应的6个时间点进行对照研究,每个时间点为20只,对照组的腹腔注射时间与癫癎组相同,注射液以生理盐水125 mg/kg代替。
1.2 免疫组织化学检测EphA5蛋白表达分别在两组大鼠致癎后12 h、24 h、7 d、15 d、30 d及60 d各取9只大鼠进行灌注取材,腹腔注射10%水合氯醛麻醉大鼠,仰卧位在木板上固定四肢,眼科剪在剑突处剪开腹部皮肤、肌肉和膈肌,用眼科镊分离心脏与胸壁之间的筋膜并暴露心脏,手持钝头针从心尖部向主动脉处刺入并固定,注入4℃生理盐水250 mL,同时迅速剪开右心耳,待肝脏变苍白色后缓慢灌注4% 4℃多聚甲醛250 mL,至头颈僵直。灌注后断头取脑,眼科剪仔细剥离头皮枕骨,完全暴露脑组织并轻柔取出,放置4℃冰箱中,4%多聚甲醛固定12 h。取出脑组织后常规梯度酒精脱水,二甲苯透明,在石蜡中浸泡并进行包埋,冰箱4℃保存。将包埋好的脑组织固定在石蜡切片机上,以切片厚度4 μm进行连续冠状切片,贴片后室温下保存。每个脑组织随机选取10~15张切片,染色严格按照免疫组化试剂盒说明书进行操作。石蜡切片常规二甲苯脱蜡,梯度酒精至水;加入含1% Triton和3% H2O2的PBS溶液,于4℃冰箱中孵育30 min,以去除内源性过氧化物酶,PBS漂洗3次,每次5 min;滴加含有10%BSA的封闭液封闭约2 h;加入1 : 100稀释的兔抗大鼠EphA5多克隆抗体(一抗),于4℃冰箱中孵育过夜,PBS漂洗3次,每次5 min;然后滴加生物素标记羊抗兔IgG(二抗)工作液,室温下孵育约1 h,PBS漂洗3次,每次5 min;DAB显色液显色,显微镜下观察显色情况并予PBS终止显色反应。对照组用PBS代替一抗,余操作与癫癎组相同。
1.3 原位杂交检测ephrinA5 mRNA表达分别在两组大鼠致癎后12 h、24 h、7 d、15 d、30 d及60 d各取9只大鼠进行灌注取材并切片,方法同1.2小节,但过程中用到的所有溶剂均以稀释度为1:1 000的DEPC水替代。每个脑组织随机选取10~15张切片,石蜡切片常规二甲苯脱蜡、梯度酒精至水,滴加3%柠檬酸稀释的胃蛋白酶液暴露mRNA核酸片段,37℃室温下消化5 min,PBS漂洗3次,每次5 min;使用含地高辛标记探针ephrinA5进行杂交,恒温水浴箱37℃过夜,然后分别以稳定液、封闭液处理,加用生物素化鼠抗地高辛在37℃下孵育60 min,并严格按照原位杂交试剂盒说明书对其进行显色操作。对照组探针用0.1 mol/L PBS代替,余操作与癫癎组相同。
1.4 Neo-Timm银染法观察纤维苔藓出芽情况分别在两组大鼠致癎后12 h、24 h、7 d、15 d、30 d及60 d各取2只大鼠进行灌注取材,方法同1.2小节,将固定后的脑组织置于-20℃的冰冻切片机切成30 μm的连续冠状切片。切片时取大鼠海马组织所在区域(前囟-3.6 mm~-4.0 mm),
每个脑组织随机取10~15张切片,将50%阿拉伯胶60 mL,柠檬酸缓冲液10 mL,5.6%氢醌30 mL,17%硝酸银1.5 mL于暗室中混合均匀,并在暗室中将冰冻切片浸入上述混合液中,置于恒温水浴箱孵育约1 h,后用自来水冲洗10 min;待切片晾干后,苏木素复染细胞核5 min,PBS漂洗10 min×3次;切片用梯度酒精脱水,二甲苯透明,中性树胶封片。普通光学显微镜下观察海马CA3区的Timm银染苔藓纤维出芽情况。
1.5 图象分析用HMIAS-1000病理图象分析系统对切片进行图象分析,每张切片随机选择5个200倍视野,对海马的CA3区和DG进行染色区域积分光密度值的测定,以均值来表示EphA5蛋白或ephrinA5 mRNA的表达水平。
1.6 统计学分析采用SPSS 21.0统计软件包对数据进行统计学分析,计量资料用均数±标准差(x±s)表示,两组均数比较采用单样本t检验;多组均数的比较采用单因素方差分析,组间两两比较采用SNK-q检验;P < 0.05为差异有统计学意义。
2 结果 2.1 ephrinA5 mRNA在癫癎大鼠海马CA3区的表达变化原位杂交结果显示:ephrinA5 mRNA在对照组海马CA3区的锥体细胞层表达,但在DG无表达。与对照组比较,在致癎后12 h及24 h时,ephrinA5 mRNA在癫癎组大鼠海马CA3区的表达差异无统计学意义(P > 0.05);ephrinA5 mRNA在癫癎组大鼠致癎后7 d,表达较对照组下调(P < 0.01);在癫癎组大鼠致癎后15 d时,ephrinA5 mRNA表达仍较对照组减少(P < 0.05);而在癫癎组大鼠致癎后30 d和60 d时,ephrinA5 mRNA表达较致癎后7 d及15 d升高(P < 0.05),但仍低于对照组,但与对照组相比差异无统计学意义(P > 0.05)。见图 1,表 1。
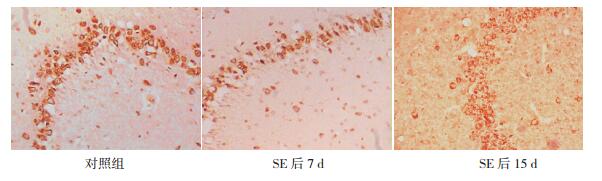
|
图 1 ephrinA5 mRNA在海马CA3区的表达变化(原位杂交,×200) 与对照组相比,ephrinA5 mRNA在癫癎组大鼠致癎后7 d、15 d海马CA3区表达明显下降。ephrinA5 mRNA阳性表达呈棕色。 |
| 表 1 ephrinA5 mRNA在海马CA3区的表达变化 |
|
|
免疫组化结果显示:EphA5在对照组大鼠海马DG、CA3区锥体细胞层均有广泛表达。与对照组比较,在致癎后12 h及24 h时,EphA5蛋白在癫癎组大鼠海马DG及CA3区的表达差异无统计学意义(P > 0.05);在致癎后7 d时,EphA5蛋白在癫癎组大鼠海马CA3区和DG的表达下调最为显著(P < 0.01);在致癎后15 d时,EphA5蛋白在癫癎组大鼠海马CA3区和DG的表达较7 d时有所升高,但仍低于对照组(P < 0.05);在致癎后30 d和60 d时,癫癎组大鼠海马CA3区和DG EphA5蛋白表达水平与对照组比较差异无统计学意义(P > 0.05)。因此,EphA5蛋白在癫癎大鼠海马CA3区和DG的表达结果与ephrinA5 mRNA的表达变化相一致。见图 2,表 2~3。
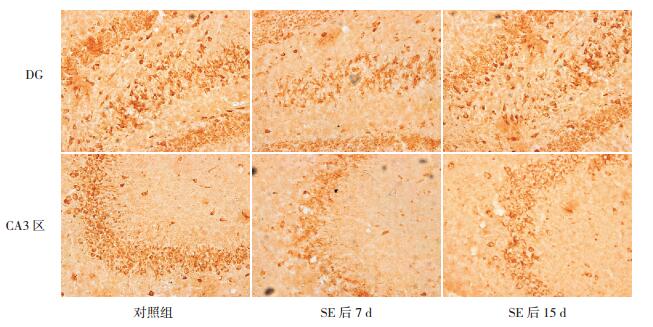
|
图 2 EphA5在海马CA3区及DG的表达变化(免疫组化,×200) EphA5在海马CA3区和DG均有表达,并在癫癎组大鼠致癎后7 d、15 d表达与对照组相比明显下降。EphA5阳性表达呈棕色。 |
| 表 2 EphA5蛋白在海马CA3区的光密度值比较 |
|
|
| 表 3 EphA5蛋白在海马DG的光密度值比较 |
|
|
对照组大鼠CA3区苔藓纤维主要集中分布于锥体细胞层内侧,偶可见黑色浓染的苔藓纤维穿过CA3区锥体细胞层达CA3区外侧的起始层。当苔藓纤维出芽发生时,黑色的银染颗粒可出现在锥体细胞层外侧,甚至更外层的起始层内。癫癎组大鼠匹罗卡品致癎后7 d和15 d,CA3区起始层出现新生的黑色染色带,并可见苔藓纤维向起始层投射,且起始层的点状银染颗粒随着时间推移不断增加并呈带状分布。见图 3。
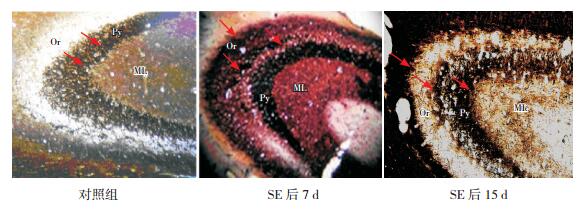
|
图 3 海马CA3区苔藓纤维出芽情况(Neo-Timm染色,×200) 对照组海马CA3区锥体细胞层内可见少量的黑色银染颗粒。癫癎组致癎后7 d,海马CA3区锥体细胞层开始出现密集浓染的黑色银染颗粒,并可见苔藓纤维向起始层投射。癫癎组致癎后15 d,海马CA3区锥体细胞层可见大量的黑色银染颗粒,密集呈带状,并不断的向起始层投射。[Or]起始层;[Py]锥体细胞层;[ML]内分子层。箭头所示为苔藓纤维出芽,即黑色银染颗粒。 |
Eph受体家族是哺乳动物中最大的酪氨酸激酶受体家族,并通过其配体ephrins,参与调制轴突的生长方向和功能。按照结构的同源性以及相互间的亲和力,Eph受体和配体ephrin都可分成A、B两个亚族[10]。最近的研究表明,成年脑中配体ephrinA5和它的受体EphA5有很高的表达[11]。ephrinA5与EphA5相互作用呈现接触排斥的效果,并由此行使它们的功能。有研究表明EphA5在大鼠海马DG颗粒细胞层及海马锥体细胞层均有不同程度的表达[12]。正常情况下,配体ephrinA5可强烈地排斥含有EphA5受体的DG颗粒细胞发出的苔藓纤维轴突侧枝出芽,阻止新突触的形成。在大脑皮质神经元的发育过程中,有研究表明,配体ephrinA5充当排斥信号的功能,在第Ⅵ层皮质神经元表达,并有选择地促进第Ⅵ层神经元的轴突出芽,而受体EphA5 mRNA在皮质神经元的Ⅱ层和Ⅲ层的轴突中表达,配体ephrinA5与受体EphA5的相互作用对皮质轴突的不同种类的生长、导向和分枝的形成发挥不同的效应[13]。在轴突的源区和靶区Eph受体和配体ephrin常常是以互补性的浓度梯度形式表达,配体可以充当排斥信号以免轴突或树突表达Eph受体。低量表达Eph受体的轴突优先有计划地向靶区表达高量的配体,反之亦然。
本实验中,LiCl-PILO致癎后,ephrinA5 mRNA在CA3区的表达明显下调,而其受体EphA5蛋白在DG和CA3区表达均下调,且与其配体的表达变化相一致。EphA5与ephrinA5相互作用产生排斥反应,在ephrinA5表达明显下调的情况下,EphA5表达不变或下调都使它们之间的排斥作用在LiCl-PILO致癎后进一步减弱,DG颗粒细胞的轴突侧枝出芽,CA3区锥体细胞之间也可能出现轴突出芽,引起突触的重建。
本实验中,癫癎组大鼠在致癎后7 d ephrinA5表达明显下调,持续1个月左右恢复正常,与Timm染色所证实苔藓纤维出芽的时间窗相一致。CA3区除典型的苔藓纤维出芽以外,其他的轴突出芽如锥体细胞之间的出芽有待轴突示踪等技术的进一步的证实。
综上所述,CA3区轴突导向分子ephrinA5及其受体EphA5的表达下调,在EphA5、ephrinA5相互排斥作用下,二者可能参与了颞叶癫癎大鼠海马CA3区苔藓纤维出芽的机制,这可能为颞叶癫癎的治疗提供新的靶点。
| [1] |
Vega C, Brenner LA, Madsen J, et al. Lexical retrieval pre-and posttemporal lobe epilepsy surgery in a pediatric sample[J]. Epilepsy Behav, 2015, 42: 61-65. DOI:10.1016/j.yebeh.2014.10.003 (  0) 0) |
| [2] |
Zhang YF, Xiong TQ, Tan BH, et al. Pilocarpine-induced epilepsy is associated with actin cytoskeleton reorganization in the mossy fiber-CA3 synapses[J]. Epilepsy Res, 2014, 108(3): 379-389. DOI:10.1016/j.eplepsyres.2014.01.016 (  0) 0) |
| [3] |
Häussler U, Rinas K, Kilias A, et al. Mossy fiber sprouting and pyramidal cell dispersion in the hippocampal CA2 region in a mouse model of temporal lobe epilepsy[J]. Hippocampus, 2016, 26(5): 577-588. DOI:10.1002/hipo.v26.5 (  0) 0) |
| [4] |
Barquilla A, Pasquale EB. Eph receptors and ephrins:therapeutic opportunities[J]. Annu Rev Pharmacol Toxicol, 2015, 55: 465-487. DOI:10.1146/annurev-pharmtox-011112-140226 (  0) 0) |
| [5] |
刘卫平, 肖波, 李蜀渝, 等. 氯化锂-匹罗卡品致癎大鼠海马EphA5及ephrinA3的表达及意义[J]. 中风与神经疾病杂志, 2007, 24(4): 403-405. (  0) 0) |
| [6] |
Szepietowska B, Horvath TL, Sherwin RS. Role of synaptic plasticity and EphA5-ephrinA5 interaction within the ventromedial hypothalamus in response to recurrent hypoglycemia[J]. Diabetes, 2014, 63(3): 1140-1147. DOI:10.2337/db13-1259 (  0) 0) |
| [7] |
Akaneya Y, Sohya K, Kitamura A, et al. Ephrin-A5 and EphA5 interaction induces synaptogenesis during early hippocampal development[J]. PLoS One, 2010, 5(8): e12486. DOI:10.1371/journal.pone.0012486 (  0) 0) |
| [8] |
Shu Y, Xiao B, Wu Q, et al. The Ephrin-A5/EphA4 interaction modulates neurogenesis and angiogenesis by the p-Akt and p-ERK pathways in a mouse model of TLE[J]. Mol Neurobiol, 2016, 53(1): 561-576. DOI:10.1007/s12035-014-9020-2 (  0) 0) |
| [9] |
Racine RJ. Modification of seizure activity by electrical stimulation. Ⅱ. Motor seizure[J]. Electroencephalogr Clin Neurophysiol, 1972, 32(3): 281-294. DOI:10.1016/0013-4694(72)90177-0 (  0) 0) |
| [10] |
Lisabeth EM, Falivelli G, Pasquale EB. Eph receptor signaling and ephrins[J]. Cold Spring Harb Perspect Biol, 2013, 5(9): pii:a009159. DOI:10.1101/cshperspect.a009159 (  0) 0) |
| [11] |
Klein R, Kania A. Ephrin signalling in the developing nervous system[J]. Curr Opin Neurobiol, 2014, 27: 16-24. DOI:10.1016/j.conb.2014.02.006 (  0) 0) |
| [12] |
Wu YJ, Xu MY, Wang L, et al. Analysis of EphA5 receptor in the developing rat brain:an in vivo study in congenital hypothyroidism model[J]. Eur J Pediatr, 2013, 172(8): 1077-1083. DOI:10.1007/s00431-013-2008-5 (  0) 0) |
| [13] |
Otal R, Burgaya F, Frisén J, et al. Ephrin-A5 modulates the topographic mapping and connectivity of commissural axons in murine hippocampus[J]. Neuroscience, 2006, 141(1): 109-121. DOI:10.1016/j.neuroscience.2006.03.052 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


