2. 江西省人民医院呼吸科, 江西 南昌 330006;
3. 江西省人民医院中心实验室, 江西 南昌 330006;
4. 江西省儿童医院中心实验室, 江西 南昌 330006
哮喘是一种呼吸系统常见病、多发病,是对病人和整个社会造成沉重负担的严重慢性疾病[1]。哮喘发病机制复杂,病因多样,治疗手段有限,寻找哮喘最新最好的治疗仍是目前哮喘研究的热点。
上皮间质转化(epithelial-mesenchymal transition, EMT)与胚胎的发生、器官发育及肿瘤的进展密切相关,EMT失调可导致脏器纤维化的发生,EMT已成为许多与组织重塑相关的慢性气道疾病临床治疗的新靶点[2-4]。已有研究证实气道反复炎症刺激可以导致气道EMT的发生,通过EMT气道上皮细胞分化为肌成纤维细胞从而加重上皮下纤维化,EMT可能参与了哮喘气道重塑的进程[5]。代表上皮化特征的E-Cadherin和间皮化特征的vimentin是EMT过程的重要蛋白,清楚了解EMT潜在的分子机制也是哮喘临床成功治疗的关键。溴化结构域蛋白4(bromodomain protein 4, BRD4)是人类结构域蛋白亚科溴化结构和超末端结构(bromodomains and extraterminal, BET)家族中的一员,是一重要的转录辅激活物。而小分子蛋白JQ1是最近新开发的BRD4抑制剂,它能与组蛋白上BRD4受体竞争性结合从而阻断BRD4的作用[6]。
本研究采用卵清蛋白(OVA, Sigma, USA)诱导建立小鼠哮喘动物模型,在激发期给予BRD4抑制剂JQ1(Sigma, USA)干预治疗哮喘小鼠,观察JQ1治疗后小鼠气道炎症的改变,以及EMT相关蛋白钙黏蛋白(E-Cadherin)及波形蛋白(vimentin)在各组小鼠肺部表达水平变化。通过该研究一方面确定OVA诱导哮喘小鼠模型成功建立,探讨小鼠哮喘气道重塑过程中EMT启动、发展的分子机制;另一方面从细胞分子学角度分析JQ1抑制哮喘小鼠气道重塑EMT、减轻气道炎症的过程,揭示溴化结构域蛋白抑制剂在未来哮喘治疗中的可能地位,为今后哮喘新的治疗方向提供更多的理论依据。
1 材料与方法 1.1 实验动物清洁级6~8周龄雌性昆明(KM)小鼠24只,体重22±5 g,购买并喂养于南昌大学医学部实验科学中心,喂养无OVA饲料,饲养环境温度20±5℃,湿度为50%±10%。所有实验均经医院医学伦理委员会审批(2015084)。
1.2 实验分组将小鼠按照随机数字表法分成对照组、OVA诱导哮喘组(OVA组)、JQ1干预哮喘组(JQ1+OVA组),每组8只。
1.3 OVA致敏混悬液及雾化液的制备用0.2 mL生理盐水溶解100 μg OVA及1 mg氢氧化铝,摇匀使之完全溶解,供腹腔注射致敏时使用;用1 mL生理盐水溶解50 mg OVA,摇匀使之完全溶解配成5%浓度溶液供雾化吸入激发时使用。
1.4 小鼠哮喘模型的建立OVA组、JQ1+OVA组小鼠于实验第1天和第15天分别腹腔注射OVA混悬液0.2 mL予以致敏,第22~28天放入30 cm3×30 cm3×20 cm3自制雾化箱中给予5% OVA雾化液雾化吸入激发,每天1次,每次30 min,连续7 d [7]。对照组用生理盐水替代OVA进行致敏和激发。
1.5 JQ1溶液的配置和使用用二甲基亚砜(DMSO, Sigma, USA)将JQ1溶解成50 mg/mL终浓度的溶液贮存,每次使用前按1 : 10比例用10%β-环糊精(Sigma-Aldrich, USA)进行稀释,在雾化激发前1 h,将预先配置好的JQ1溶液经腹腔注入JQ1+OVA组小鼠腹腔内,每次每只小鼠50 μg/g,连续7 d [8]。
1.6 支气管肺泡灌洗液的收集及处理所有小鼠均于末次激发后24 h给予腹腔注射2%戊巴比妥钠,麻醉后将小鼠固定于平板上,充分暴露颈部气管,钝性分离,将18 G留置针插入气管并固定,予冷生理盐水0.5 mL连续灌洗气管3次(回收率 > 80%),留取支气管肺泡灌洗液(BALF),以3 000 r/min离心10 min,上清液于-80℃保存备用,沉淀做细胞计数及分类用。
1.7 肺组织标本的收集及处理支气管肺泡灌洗完毕后,无菌操作下切取小鼠左肺组织,保存于4%多聚甲醛中固定24 h备用。留取新鲜右肺组织置于2 mL干燥、无菌的冻存管内,-80℃冰箱保存备用。
1.8 病理染色观察组织形态学、杯状细胞及黏液分泌变化甲醛固定24 h后,常规石蜡包埋、切片,切片厚度4 μm。石蜡切片常规脱蜡、梯度乙醇水化后,分别行苏木精-伊红(HE)染色、过碘酸-雪夫(periodic acid-Schiff, PAS)染色,显微镜下观察各组小鼠肺部病理学改变,Nikon DS-Ri2拍照并分析。
1.9 BALF细胞计数及分类BALF离心沉淀为肺泡灌洗液细胞,用1 mL磷酸缓冲盐溶液(PBS)重悬后存放于冰盒中,取10 μL重悬液注入计数板,由细胞计数仪计数BALF细胞总数,另取20 μL重悬液涂片,经瑞氏染色后计嗜酸性粒细胞百分比。
1.10 实时定量逆转录聚合酶链反应测定E-Cadherin及vimentin mRNA表达以GAPDH为内参设计合成各目的基因引物序列(表 1),目的基因引物序列由南京金斯瑞生物科技有限公司设计合成。提取各组细胞总RNA后进行逆转录及PCR扩增,按逆转录试剂盒(Promega, USA)、PCR试剂盒(北京全式金生物技术有限公司)操作说明进行,测定肺组织E-Cadherin、vimentin mRNA表达。反应结束后确认RT-PCR扩增曲线及融解曲线,由计算机自动计算定量结果Ct值,做3次独立试验,每次做3个复孔,取其平均值,采用△△CT法来计算所测目的基因E-Cadherin、vimentin mRNA的相对表达量,计算公式:△△CT=[CT(处理组目的基因)-CT(处理组内参)] -均值[CT(对照组目的基因)-CT(对照组内参)],相对表达量=2-△△CT。处理组包括对照组、OVA组、JQ1+OVA组。
| 表 1 引物序列 |
|
|
取新鲜肺组织提取总蛋白,配制浓缩胶、分离胶后将肺组织蛋白上样,进行电泳、膜转、封闭,4℃冰箱摇床孵育E-Cadherin(1 : 1 000)、vimentin(1 : 1 000)、β-actin(1 : 2 000)一抗(Abcam,美国)过夜,次日进行洗膜3次后在室温摇床上分别孵育山羊抗鼠、山羊抗兔IgG二抗(江苏康为世纪生物科技有限公司),再次洗膜3次后予以ECL(Thermo scientific, USA)显色,在Image Lab Version 6.0软件中用相对定量法与β-actin进行条带灰度值比较,均以对照组为1.0,分析肺组织E-Cadherin、vimentin蛋白水平表达。
1.12 统计学分析采用SPSS 19.0统计软件对数据进行统计学处理,计量资料用均数±标准差(x±s)表示,多组计量资料间比较采用单因素方差分析,组间两两比较采用SNK-q法,P < 0.05为差异有统计学意义。
2 结果 2.1 小鼠哮喘发作行为观察OVA组小鼠明显出现活动频繁、呼吸急促、鼻部瘙痒、腹肌抽搐、毛发竖起、大小便失禁等表现,JQ1+OVA组上述表现较OVA组减轻,对照组小鼠无明显上述症状。
2.2 肺组织病理染色观察小鼠气道重塑变化高倍镜HE染色下可见OVA组小鼠气道损伤明显,气管、支气管、血管周围大量炎症细胞浸润,肺泡壁增厚,气管上皮细胞紊乱、脱落、不完整,气道壁明显增厚,气道痉挛,管腔变狭窄、僵硬;高倍镜PAS染色下可见OVA组小鼠气管上皮杯状细胞增生、黏液腺分泌增加,管腔上皮见大量粉红色黏液分泌颗粒附着,部分有团状黏液栓形成。JQ1+OVA组小鼠气道损伤、炎症细胞浸润及气道结构破坏均较OVA组有减轻,杯状细胞增生减少,黏液分泌减弱。对照组小鼠支气管及肺泡壁结构基本正常,气道上皮无增厚,气道壁薄,厚度均匀,气道周围无炎症细胞浸润。见图 1。
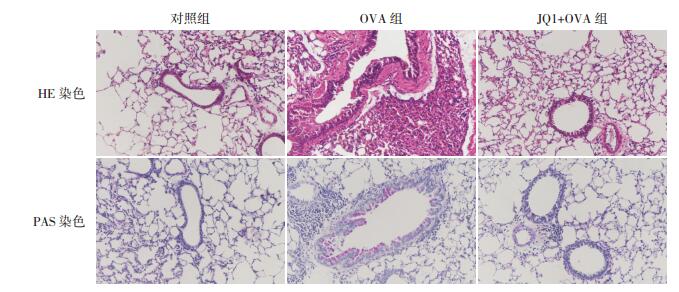
|
图 1 各组小鼠肺组织病理改变(×200) OVA组HE染色下可见小鼠支气管周围和血管周围有大量炎症细胞浸润,肺泡壁、气管壁增厚,完整性破坏;PAS染色下可见支气管上皮杯状细胞增生明显,黏液腺分泌增加,支气管管腔内有大量粉红色黏液分泌颗粒。JQ1+OVA组小鼠炎症细胞浸润及气道结构破坏均较OVA组有所减轻,杯状细胞增生减少,黏液分泌不明显。对照组小鼠支气管及肺泡壁结构基本正常,气道上皮无增厚,气道壁薄,厚度均匀,气道及血管周围无炎症细胞浸润。 |
OVA组小鼠BALF中细胞计数明显多于对照组及JQ1+OVA组(P < 0.01),嗜酸性粒细胞百分比亦明显高于对照组及JQ1+OVA组(P < 0.01),JQ1+OVA组与对照组BALF中细胞计数及嗜酸性粒细胞百分比比较,差异均无统计学意义(P > 0.05),见表 2。
| 表 2 各组小鼠BALF细胞计数及嗜酸性粒细胞百分比比较 |
|
|
与对照组比较,OVA组E-Cadherin mRNA表达降低,vimentin mRNA表达增强(P < 0.01);与OVA组比较,JQ1+OVA组E-Cadherin mRNA表达水平上调,而vimentin mRNA表达水平下调(P < 0.01);JQ1+OVA组与对照组比较上述指标表达差异均无统计学意义(P > 0.05)。见表 3,图 2。
| 表 3 各组小鼠E-Cadherin、vimentin mRNA及其蛋白水平表达比较 |
|
|
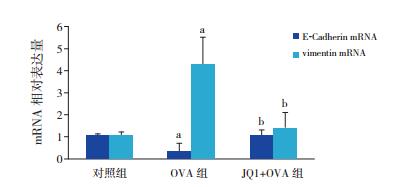
|
图 2 RT-PCR法检测各组小鼠E-Cadherin、vimentin mRNA表达(n=8) a示与对照组比较,P<0.01,b示与OVA组比较,P<0.01。 |
与对照组比较,OVA组E-Cadherin蛋白表达下调,vimentin蛋白表达上调(P < 0.01);与OVA组比较,JQ1+OVA组E-Cadherin蛋白表达增强,而vimentin蛋白表达减弱(P < 0.01);上述两种蛋白表达在对照组与JQ1+OVA组之间比较,差异无统计学意义(P > 0.05)。见表 3,图 3。
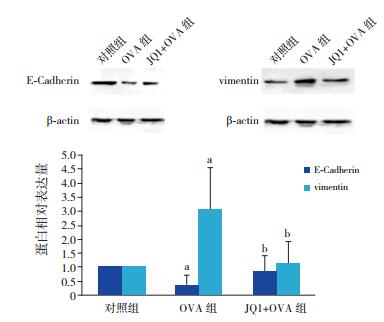
|
图 3 Western blot法检测各组小鼠E-Cadherin、vimentin蛋白表达 上图为电泳条带图;下图为统计图(n=8),a示与对照组比较,P<0.01,b示与OVA组比较,P<0.01。 |
哮喘发病机制复杂,气道重塑是哮喘发病机制的一个重要环节,气道重塑与哮喘患者的临床预后相关。反复慢性的炎症刺激可引起气道壁增厚,上皮下纤维化、平滑肌增厚,血管生成和黏液腺分泌增加,即为气道重塑[9],气道上皮细胞向杯状细胞的转化是气道重塑的关键,大量的杯状细胞分泌黏液形成黏液栓阻塞气道可造成致死性哮喘的发生,气道重塑是难治性哮喘的重要原因[10]。然而哮喘反复发作后气道重塑的分子学发生机制仍不清楚,针对气道重塑也没有很好的治疗手段。目前哮喘最有效的主要治疗方法是糖皮质激素、长效β2受体激动剂和白三烯受体拮抗剂的使用,但并不是所有患者均治疗有效,特别是严重哮喘发作在治疗上更为棘手[11],而这些药物也只是在减轻气道炎症上是有效的,对于阻止和逆转气道重塑却是疗效甚微[12],已有研究发现糖皮质激素治疗对于干预TGF-β1诱导EMT过程肌成纤维细胞的分化是无效的[13]。因此,了解气道重塑的发生机制,寻找更多、更好的针对上皮增厚、上皮下纤维化等这些分子结构变化相关的减轻哮喘气道重塑的治疗方法迫在眉睫。
EMT是上皮细胞逐渐分化为中间表型的间充质细胞的过程,不同类型的EMT普遍存在于器官发育和上皮损伤修复中[14]。内源性或外源性因子引起气道上皮长期受损致EMT,最终导致慢性肺疾病的发生,伴随着组织重塑,各种模式的纤维化变化广泛存在[15]。哮喘气道重塑与EMT密切相关,EMT是一种亚稳定状态,哮喘气道上皮细胞在发生局部损伤后诱发上皮细胞向肌纤维母细胞转分化,即发生EMT。异常的EMT被认为是哮喘气道病理生理特征的中心环节,对哮喘气道重塑的早期启动起重要作用,是气道重塑机制研究的新热点[16]。持续的EMT可最终引起肺功能的进行性下降[17],EMT还可诱导气道上皮敏感性改变从而影响糖皮质激素对严重哮喘的治疗效应[18]。
多种蛋白参与了哮喘的EMT发生发展过程,比如E-Cadherin、vimentin等,这些蛋白对于维持气道上皮细胞的形态、组织完整及气道重塑发挥着重要的作用。E-Cadherin是上皮细胞表面的黏附分子,对于细胞间的黏附起到重要的作用,是上皮细胞重要的生物标记物,E-Cadherin主要表达于上皮细胞膜上,E-Cadherin表达减少使支气管上皮结构失去稳定性和上皮细胞丧失极性, 有利于支气管上皮细胞的移行。vimentin又称波形蛋白,是间充质细胞中的一种中间丝蛋白,表达于间充质细胞(如成纤维细胞、内皮细胞)胞浆中,是间充质细胞重要的生物标记物,在维持和调节细胞功能中发挥重要的作用。哮喘患者E-Cadherin表达水平越低,气道屏障功能缺失越明显,从而进一步促进哮喘气道重塑的发生发展[19]。
我们用OVA诱导、激发建立小鼠哮喘的动物模型,通过肺组织切片染色观察病理改变,并与生理盐水诱导激发的对照组小鼠比较,可以发现哮喘小鼠气道上皮明显增厚,气管痉挛,大量炎症细胞浸润,气管内黏液分泌增加,杯状细胞增生,气管壁下层弹性纤维增生。RT-PCR及Western blot实验检测发现哮喘小鼠肺组织E-Cadherin表达减弱,而vimentin表达增加,揭示OVA诱导哮喘模型成功,哮喘小鼠气道存在EMT,OVA可促进小鼠气道重塑的发生[20],过敏性哮喘小鼠气道上皮细胞中E-Cadherin表达降低,vimentin表达增加[21],这些都与本研究结果一致。
BET蛋白是BRD家族中研究的最为广泛深入的一个,以BET蛋白溴化结构域为靶向进行肿瘤、炎症等疾病的研究,找寻更好、更安全、生物活性更高的小分子抑制剂是当前研究的重点和热点。BRD4与BRD2,BRD3和BRDt同属于BET蛋白家族[22],其结构特点是包含有2个氨基末端的溴结构域,溴结构域普遍存在于人体重要蛋白质中,例如转录辅激活因子、组蛋白乙酰化酶类、ATP依赖的染色质重塑复合物因子等,人体多种疾病的发生与其有着密切的关联。溴结构域可选择性识别组蛋白末端乙酰赖氨酸位点,与乙酰化的赖氨酸结合,直接装配胞核大分子结合到染色质上,调节DNA复制、损伤修复、染色质重塑、转录等过程,参与表观遗传基因的读取和调控,影响一些疾病的发生。研究发现,BRD4在调控基因转录过程中发挥重要的作用,包括在M/G1期转化的过程中,与基因表达的转录起始位点结合,影响有丝分裂的过程[23]。BET蛋白包括BRD4在调节B细胞特异性基因表达和免疫球蛋白的产生中发挥着至关重要的作用,BRD2、BRD3也已被证明在人类和小鼠免疫系统模型的细胞中发挥独立作用,BET蛋白可调节炎性基因的表达,与机体的免疫防御密切相关[24],可调控哮喘气道平滑肌中TGF-β诱导的细胞增殖和细胞因子的释放[25]。同样有研究发现,BRD4与人类气道上皮细胞IL-1β诱导炎症反应密切相关,在调控炎症基因作用上扮演重要角色[26]。
氮杂卓类化合物JQ1是最早发现的BET蛋白小分子抑制剂,JQ1与BET蛋白的溴结构域有着高度的亲和性,并能够使BET蛋白从染色质的乙酰化赖氨酸上置换下来,阻止BET与乙酰化的赖氨酸结合,越来越多的体内体外实验研究已证实JQ1在抗肿瘤细胞生长、迁移与侵袭方面作用明显[27-29]。Wang等[30]通过对肺纤维化小鼠动物模型研究发现,BRD4抑制剂JQ1可抑制肺纤维化,而且不同口服剂量JQ1可以不同程度抑制肺纤维化的发生。JQ1可以显著降低免疫球蛋白的基因转录,抑制IgG的产生和增殖,通过降低BRD4与OCT2免疫共沉淀的能力,从而抑制慢性炎症性疾病如哮喘等的炎症免疫反应过程[24]。
已有体外细胞实验研究发现,JQ1通过中断BRD4功能抑制EMT相关基因的表达调控,从而可阻止EMT的发生[31]。BRD4抑制剂JQ1能否抑制哮喘小鼠气道重塑EMT?如何从分子水平调控EMT?能否对小鼠哮喘起一定的治疗作用?
本实验用JQ1干预治疗OVA诱导哮喘小鼠,结果发现JQ1治疗后,哮喘小鼠气道炎症明显减轻,气道壁变完整、厚度减轻,气管内黏液分泌减少,杯状细胞增生不明显。用RT-PCR及Western blot法分别观察各组小鼠EMT相关蛋白E-Cadherin及vimentin表达水平,结果发现经JQ1治疗后哮喘小鼠肺组织E-Cadherin的mRNA表达较OVA组增强,而vimentin表达减弱,EMT过程被抑制,气道重塑减轻。在蛋白表达上,结果基本与mRNA表达水平相吻合,JQ1+OVA组小鼠E-Cadherin、vimentin的蛋白表达水平变化与OVA组相比差异显著。但本研究的动物样本例数仍偏少,今后将进一步增加样本量以更好的进一步观察EMT基因及蛋白表达的变化。
总之,通过该实验我们发现经OVA诱导哮喘小鼠存在明显的EMT相关气道重塑,JQ1能抑制小鼠哮喘的EMT过程,减轻气道炎症与损伤,通过调节EMT相关蛋白E-Cadherin和vimentin的表达变化从分子水平调控EMT,从而达到治疗哮喘的作用。综上,BRD4可能可以作为哮喘治疗潜在的药物靶点,且BRD4抑制剂JQ1可以发挥有效治疗作用,JQ1将为未来哮喘的治疗开辟新的天地,对哮喘治疗有重要意义。
| [1] |
Baldacci S, Maio S, Cerrai S, et al. Allergy and asthma:effects of the exposure to particulate matter and biological allergens[J]. Respir Med, 2015, 109(9): 1089-1104. DOI:10.1016/j.rmed.2015.05.017 (  0) 0) |
| [2] |
Bartis D, Thickett DR. Authors' response:epithelial-mesenchymal transition (EMT) is a common molecular programme in epithelial cells which can be triggered by injury[J]. Thorax, 2014, 69(8): 769. (  0) 0) |
| [3] |
Belkina AC, Nikolajczyk BS, Denis GV. BET protein function is required for inflammation:Brd2 genetic disruption and BET inhibitor JQ1 impair mouse macrophage inflammatory responses[J]. J Immunol, 2013, 190(7): 3670-3678. DOI:10.4049/jimmunol.1202838 (  0) 0) |
| [4] |
Berair R, Brightling CE. Asthma therapy and its effect on airway remodelling[J]. Drugs, 2014, 74(12): 1345-1369. DOI:10.1007/s40265-014-0250-4 (  0) 0) |
| [5] |
Bid HK, Phelps DA, Xaio L, et al. The bromodomain BET inhibitor JQ1 suppresses tumor angiogenesis in models of childhood sarcoma[J]. Mol Cancer Ther, 2016, 15(5): 1018-1028. DOI:10.1158/1535-7163.MCT-15-0567 (  0) 0) |
| [6] |
Chang H, Liu Y, Xue M, et al. Synergistic action of master transcription factors controls epithelial-to-mesenchymal transition[J]. Nucleic Acids Res, 2016, 44(6): 2514-2527. DOI:10.1093/nar/gkw126 (  0) 0) |
| [7] |
Chapman HA. Epithelial-mesenchymal interactions in pulmonary fibrosis[J]. Annu Rev Physiol, 2011, 73: 413-435. DOI:10.1146/annurev-physiol-012110-142225 (  0) 0) |
| [8] |
Chung KF. Targeting the interleukin pathway in the treatment of asthma[J]. Lancet, 2015, 386(9998): 1086-1096. DOI:10.1016/S0140-6736(15)00157-9 (  0) 0) |
| [9] |
de Boer WI, Sharma HS, Baelemans SM, et al. Altered expression of epithelial junctional proteins in atopic asthma:possible role in inflammation[J]. Can J Physiol Pharmacol, 2008, 86(3): 105-112. DOI:10.1139/Y08-004 (  0) 0) |
| [10] |
Doerner AM, Zuraw BL. TGF-beta1 induced epithelial to mesenchymal transition (EMT) in human bronchial epithelial cells is enhanced by IL-1beta but not abrogated by corticosteroids[J]. Respir Res, 2009, 10: 100. DOI:10.1186/1465-9921-10-100 (  0) 0) |
| [11] |
Emadali A, Rousseaux S, Bruder-Costa J, et al. Identification of a novel BET bromodomain inhibitor-sensitive, gene regulatory circuit that controls Rituximab response and tumour growth in aggressive lymphoid cancers[J]. EMBO Mol Med, 2013, 5(8): 1180-1195. DOI:10.1002/emmm.201202034 (  0) 0) |
| [12] |
Filippakopoulos P, Qi J, Picaud S, et al. Selective inhibition of BET bromodomains[J]. Nature, 2010, 468(7327): 1067-1073. DOI:10.1038/nature09504 (  0) 0) |
| [13] |
Fischer KD, Agrawal DK. Vitamin D regulating TGF-β induced epithelial-mesenchymal transition[J]. Respir Res, 2014, 15: 146. DOI:10.1186/s12931-014-0146-6 (  0) 0) |
| [14] |
Fischer KD, Hall SC, Agrawal DK. Vitamin D supplementation reduces induction of epithelial-mesenchymal transition in allergen sensitized and challenged mice[J]. PLoS One, 2016, 11(2): e0149180. DOI:10.1371/journal.pone.0149180 (  0) 0) |
| [15] |
Folli C, Descalzi D, Scordamaglia F, et al. New insights into airway remodelling in asthma and its possible modulation[J]. Curr Opin Allergy Clin Immunol, 2008, 8(5): 367-375. DOI:10.1097/ACI.0b013e32830a7086 (  0) 0) |
| [16] |
Hirota N, Martin JG. Mechanisms of airway remodeling[J]. Chest, 2013, 144(3): 1026-1032. DOI:10.1378/chest.12-3073 (  0) 0) |
| [17] |
Hussong M, Börno ST, Kerick M, et al. The bromodomain protein BRD4 regulates the KEAP1/NRF2-dependent oxidative stress response[J]. Cell Death Dis, 2014, 5: e1195. DOI:10.1038/cddis.2014.157 (  0) 0) |
| [18] |
Ijaz T, Pazdrak K, Kalita M, et al. Systems biology approaches to understanding Epithelial Mesenchymal Transition (EMT) in mucosal remodeling and signaling in asthma[J]. World Allergy Organ J, 2014, 7(1): 13. (  0) 0) |
| [19] |
Kalita M, Tian B, Gao B, et al. Systems approaches to modeling chronic mucosal inflammation[J]. Biomed Res Int, 2013, 2013: 505864. (  0) 0) |
| [20] |
Khan YM, Kirkham P, Barnes PJ, et al. Brd4 is essential for IL-1β-induced inflammation in human airway epithelial cells[J]. PLoS One, 2014, 9(4): e95051. DOI:10.1371/journal.pone.0095051 (  0) 0) |
| [21] |
Khan YM, Kirkham P, Barnes PJ, et al. Brd4 is essential for IL-1β-induced inflammation in human airway epithelial cells[J]. PLoS One, 2014, 9(4): e95051. DOI:10.1371/journal.pone.0095051 (  0) 0) |
| [22] |
Li M, Luan F, Zhao Y, et al. Epithelial-mesenchymal transition:an emerging target in tissue fibrosis[J]. Exp Biol Med (Maywood), 2016, 241(1): 1-13. DOI:10.1177/1535370215597194 (  0) 0) |
| [23] |
Liu T, Liu Y, Miller M, et al. Autophagy plays a role in FSTL1-induced epithelial mesenchymal transition and airway remodeling in asthma[J]. Am J Physiol Lung Cell Mol Physiol, 2017, 313(1): L27-L40. DOI:10.1152/ajplung.00510.2016 (  0) 0) |
| [24] |
Nawshad A, Lagamba D, Polad A, et al. Transforming growth factor-beta signaling during epithelial-mesenchymal transformation:implications for embryogenesis and tumor metastasis[J]. Cells Tissues Organs, 2005, 179(1-2): 11-23. DOI:10.1159/000084505 (  0) 0) |
| [25] |
Park IH, Kang JH, Shin JM, et al. Trichostatin A inhibits epithelial mesenchymal transition induced by TGF-β1 in airway epithelium[J]. PLoS One, 2016, 11(8): e0162058. DOI:10.1371/journal.pone.0162058 (  0) 0) |
| [26] |
Shahbazi J, Liu PY, Atmadibrata B, et al. The bromodomain inhibitor JQ1 and the histone deacetylase inhibitor panobinostat synergistically reduce N-Myc expression and induce anticancer effects[J]. Clin Cancer Res, 2016, 22(10): 2534-2544. DOI:10.1158/1078-0432.CCR-15-1666 (  0) 0) |
| [27] |
Shim JM, Lee JS, Russell KE, et al. BET proteins are a key component of immunoglobulin gene expression[J]. Epigenomics, 2017, 9(4): 393-406. DOI:10.2217/epi-2016-0147 (  0) 0) |
| [28] |
Tang X, Peng R, Phillips JE, et al. Assessment of Brd4 inhibition in idiopathic pulmonary fibrosis lung fibroblasts and in vivo models of lung fibrosis[J]. Am J Pathol, 2013, 183(2): 470-479. DOI:10.1016/j.ajpath.2013.04.020 (  0) 0) |
| [29] |
Wang J, Li FS, Pang NN, et al. Inhibition of asthma in OVA sensitized mice model by a traditional uygur herb nepeta bracteata benth[J]. Evid Based Complement Alternat Med, 2016, 2016: 5769897. (  0) 0) |
| [30] |
Wang L, Wu X, Wang R, et al. BRD4 inhibition suppresses cell growth, migration and invasion of salivary adenoid cystic carcinoma[J]. Biol Res, 2017, 50(1): 19. DOI:10.1186/s40659-017-0124-9 (  0) 0) |
| [31] |
Wang N, Yan D, Liu Y, et al. A HuR/TGF-β1 feedback circuit regulates airway remodeling in airway smooth muscle cells[J]. Respir Res, 2016, 17(1): 117. DOI:10.1186/s12931-016-0437-1 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


