虽然围产医学及新生儿重症监护医疗水平已取得了很大的进步,但出生窒息所致的缺氧缺血性脑病仍然是新生儿死亡的主要原因之一,许多幸存的新生儿会伴随脑瘫、精神发育迟滞、学习障碍、癫癎、听力和视力损伤等永久性神经系统后遗症[1]。近年来大量研究证明干细胞可能为新生儿脑损伤的治疗带来新策略,间充质干细胞(mesenchymal stem cell, MSC)是一类具有自我更新能力及多向分化潜能的干细胞,并具有低免疫原性的特点,被认为是最具治疗潜力的移植来源,其在早产儿严重的脑室内出血的应用已进入临床试验阶段[2],但其治疗机制尚不清楚。既往研究认为MSC可迁移到损伤组织并分化为具有治疗潜力的前体细胞,从而发挥治疗效应。但最近的研究发现MSC来源的培养基的移植可发挥与干细胞移植类似的治疗作用,进一步研究表明培养基的脑损伤保护作用可能是源于干细胞的旁分泌作用[3]。而外泌体作为MSC旁分泌的一种生物活性物质,成为近年来的研究热点。外泌体是由细胞多囊泡体与细胞质膜融合释放的直径在30~100 nm的小囊泡,最早一直被认为是细胞代谢产物的运输工具[4]。深入研究发现,外泌体由双层脂膜构成并包含有大量的蛋白、脂质以及核酸等生物活性物质,其可作为细胞间的通讯工具[5],参与免疫调节、血管增生、神经功能修复等复杂的病理生理过程[6-10]。外泌体具有半衰期长、免疫原性低、稳定性好、能通过血脑屏障等优点,在脑损伤治疗中显示出了极大的潜力。研究报道单用外泌体替代干细胞治疗亦发挥相似的生物学功能,甚至可发挥更好的治疗作用[3]。因此,MSC源性外泌体有望成为新生儿脑损伤治疗的新兴策略。
1 外泌体的生物学特性在干细胞治疗脑损伤机制的研究中,MSC的自我更新能力、多向分化潜能以及形成克隆细胞群体的能力以往一直是研究焦点,而近年来研究人员发现干细胞在神经系统的功能恢复方面有更加复杂的表现,移植后的干细胞仅有极少一部分能存活下来,并只有较短的存活期,亦没有显著迁移至损伤部位并分化形成新的永久性组织。而有趣的是移植的干细胞即使远离损伤部位亦能发挥治疗效应[6]。表明干细胞并非直接替代受损组织发挥治疗作用,而是通过分泌生物活性因子参与各类生物效应,如免疫调节、抗炎、抗凋亡、抗瘢痕以及促进新生血管形成等。这些生物活性因子主要来源于干细胞分泌的外泌体[8],它是一种细胞内吞来源的直径在30~100 nm之间的细胞外囊泡(extracellular vesicles, EVs)。外泌体的形成过程是:细胞膜内陷形成早期核内体,细胞将颗粒物质释放到早期核内体中,进一步成熟形成晚期核内体,也称为细胞多囊泡体,其与细胞膜特定部位融合后形成芽泡,将细胞多囊泡体中的囊泡释放到细胞外,这些囊泡即为外泌体[9, 11]。外泌体可通过配体-受体相互作用的方式粘附到受体细胞表面,亦可通过受体细胞内吞摄取或通过囊泡和细胞膜的直接融合使外泌体内容物释放到靶细胞内[5],发挥细胞间的通讯作用,从而调节靶细胞的生物学行为。外泌体的产生及与靶细胞的结合过程见图 1。
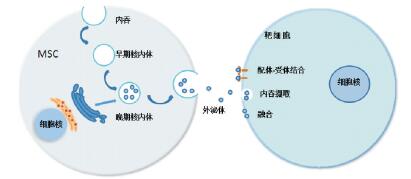
|
图 1 外泌体的产生及与靶细胞的结合 细胞膜内陷形成早期核内体,细胞将颗粒物质释放到早期核内体中,进一步成熟形成晚期核内体,晚期核内体与细胞膜特定部位融合后形成芽泡,将泡体中的外泌体释放到细胞外;外泌体可通过配体-受体相互作用的方式粘附到受体细胞表面,亦可通过受体细胞内吞摄取或囊泡和细胞膜的直接融合使外泌体内容物释放到靶细胞内。 |
外泌体中不仅包含蛋白、脂质,还含有大量核酸[5]。自2007年首次鉴定出外泌体含有mRNA以及miRNA以来,目前在外泌体中已鉴定出数千种mRNA和miRNA,并发现了siRNA、mtDNA、tRNA、双链DNA等其他特殊核酸的存在[12-13]。其中miRNA的研究较为清楚。miRNA为小非编码RNA,它通过与靶mRNA的互补序列相互结合,致使靶mRNA降解,导致翻译停止及基因沉默,从而在细胞分化、增殖、凋亡等生物进程中影响基因表达[14],如miR-125a可促进血管生成[14],miRNA-19a可抑制细胞凋亡[15]。
需要注意的是,外泌体几乎可由所有的真核细胞产生,其内容物的组成及成分依赖于其母细胞来源,并且受细胞外微环境的影响。研究人员发现,当MSC经过缺氧缺血处理后,外泌体中miR-133b以及miR-22的水平升高,这些miRNA又可通过调节细胞外的微环境从而促进神经恢复。表明MSC与外环境之间可通过外泌体进行信息的反馈[16-17]。
尽管针对外泌体生物学功能方面的研究在不断深入,但外泌体所包含的内容物仍不能被准确识别。因此,还需要进一步的研究以确定其内容物的组成及功能,以期阐明外泌体与组织修复的关系。
2 外泌体的提取与鉴定外泌体的提取是外泌体研究和临床应用的基础,目前外泌体的提取方式大致有5种[18-19]。
(1)差速离心法:通过不同的离心力去除细胞、碎片以及大囊泡,分离得到外泌体,是目前较为常用的外泌体提取方法。优点是成本较低,污染风险小,且可进行大样本量提取,缺点是过程较为繁琐,高速离心也可能会损伤外泌体的结构[20]。
(2)基于分子大小分离法:包括超滤法和体积排除色谱法。超滤法是利用超滤膜过滤得到外泌体,其提取时间短,较为便捷,但超滤的压力可造成外泌体的变形和损伤,并且外泌体附着于膜上也造成了一定的损失[21]。体积排除色谱法利用装填有多孔性材料的色谱柱进行外泌体分离,设定孔径的大小可选择性地分离出目标大小的分子及颗粒。该方法允许大小分子的精确分离,并且外泌体的结构不会被破坏,但其分离时间长,限制了其在大样本中的应用。
(3)免疫亲和捕获法:基于外泌体的膜抗原与抗体的特异性结合进行外泌体分离,目前主要有结合特异性抗体的磁珠分选法和酶联免疫吸附实验分离法。其优点是分离出的外泌体纯度高且特异性好,不足之处是试剂成本较高,产量较低,分离出的外泌体可能会失去功能活性[21]。
(4)外泌体沉淀法:使用除水的聚合物改变外泌体的溶解度和分散性以沉淀外泌体。其作用较为温和,设备成本低,缺点是其他蛋白质及聚合物的共沉淀对后续的实验分析造成了一定的影响。
(5)微流体分离技术(microfluidics-based isolation techniques):利用外泌体的各种性质如大小、免疫亲和力、密度等对外泌体进行微观分离。优点是快速便捷,易于自动化,样本量需求少,但尚处于研究阶段,缺乏临床样本的标准化及大规模的测试[22]。
外泌体在发育成熟过程中,一些跨膜蛋白可在其外膜表面形成特定的标志物,例如CD9、CD63、CD81分子等,这些跨膜蛋白可作为标记进行外泌体鉴定。除此之外,外泌体大小介于30~100 nm之间,亦可通过测定颗粒大小鉴定外泌体。目前可鉴定外泌体的技术有很多,包括流式细胞术、电子显微镜、生物免疫技术、动态光散射技术等,但这些技术各有优缺点,例如电子显微镜精度较高,但操作繁琐,检测速度较慢;生物免疫技术操作较为简单,适合高通量的检测,但无法测量颗粒的大小,因此目前常采取联合应用这些鉴定技术检测外泌体[23-24]。
3 外泌体的作用机制 3.1 促进血管增生众所周知,组织损伤后新生血管的形成和血运的重建是恢复组织生理功能的首要因素,外泌体内容物在促进内皮细胞迁移、增殖及血管形成中扮演了重要角色[14]。实验分析显示外泌体中含有某些生物活性分子,如纤维细胞生长因子、血管内皮细胞生长因子、白介素-8(interleukin-8, IL-8)等,它们与血管增生密切相关,特别是血管内皮细胞生长因子,被认为是促进血管形成及内皮细胞增生的关键因子[6, 25]。
研究发现外泌体内的一些信号分子可参与某些信号通路的激活。外泌体中HES1是Notch信号通路的关键下游效应分子,研究表明,激活Notch通路可调节血管重塑及内皮细胞的动脉化[26]。另外,Gonzalez-King等[27]研究表明外泌体中的Jagged 1蛋白可传递Notch信号,进而促进血管生成;Zhang等[28]发现外泌体中的Wnt蛋白可刺激内皮细胞β-连环蛋白的核转位,激活下游效应分子,促进血管生成及恢复组织损伤;Ma等[29]转染AKT至MSC,发现外泌体中高表达的AKT可通过激活血小板源性生长因子信号通路促进血管生成;Vrijsen等[30]研究表明外泌体中高表达的细胞外基质金属蛋白酶诱导因子可激活ERK/AKT信号通路,介导了内皮细胞的迁移以及血管网形成。
研究表明外泌体中的特定miRNA亦发挥促进血管生成的生物功能[31],如外泌体可向血管内皮细胞转运miRNA-125a及miRNA-30b,其可结合血管生成抑制剂DLL4的3'非翻译区从而抑制其表达。削弱DLL4的抑制作用,从而促进血管生成[14, 31]。miRNA-21可抑制靶基因PTEN的表达并激活AKT通路,从而调节血管增生及凋亡相关因子的表达[32]。外泌体促进血管增生的机制示意图见图 2。
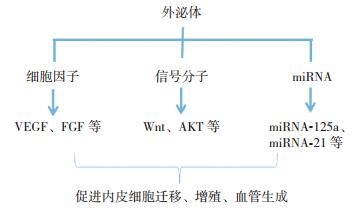
|
图 2 外泌体促进血管增生 外泌体中的细胞因子、信号分子、miRNA等可促进内皮细胞迁移、增殖及血管生成。 |
总之,外泌体在血管增生的多个关键环节发挥着重要作用,其不仅诱导内皮细胞增殖,还参与内皮细胞的迁移,并干预内皮细胞的凋亡。
3.2 免疫调节和抗炎作用脑损伤可促使胶质细胞激活、白细胞募集、炎症介质的产生和释放,这些炎症介质不仅作用于周围的胶质细胞和神经元,还招募外周免疫细胞如中性粒细胞、巨噬细胞、淋巴细胞等进入脑组织,加重神经系统损伤[4]。Zhang等[33]证实了MSC源性外泌体可降低促炎因子表达而诱导抗炎因子表达,并介导CD4+ T细胞转化为调节性T细胞,从而减轻免疫反应。Chen等[10]将外周血单核细胞与MSC来源的外泌体共培养发现,外泌体可诱导辅助性T细胞1型(Th1)转化为Th2,同时增加了调节性T细胞的水平,并促进了外周血单核细胞和CD3+ T细胞的凋亡,从而减轻炎症。
在脑损伤中,小胶质细胞及星形胶质细胞在介导炎症中发挥了重要作用,它们是促炎细胞因子产生的主要来源。Drommelschmidt等[8]表明MSC来源的EVs可抑制小胶质细胞和星型胶质细胞的激活,从而减轻炎症诱导的脑损伤,恢复白质微结构。
大量研究报道了外泌体中某些特定内容物具有免疫调节作用。例如血管内皮细胞生长因子等可抑制促炎因子的表达而发挥抗炎作用[34];前列腺素E2及转化生长因子β可抑制NK细胞的活性并抑制T细胞的增殖和激活;IL-10可抑制巨噬细胞与中性粒细胞的功能,抑制Th1细胞的免疫反应,并促进抗炎分子的表达[35];这些因子还与抗原提呈细胞如树突细胞相互作用影响抗原提呈,IL-10通过激活JAK1和STAT3信号通路抑制树突细胞的功能,并协同其他抗炎因子,使树突细胞处于非成熟免疫耐受状态[35]。除了大量蛋白因子参与免疫调节,外泌体还包含具有免疫调节功能的miRNA。Phinney等[36]发现MSC源性外泌体中的miRNA可通过抑制Toll样受体通路抑制巨噬细胞的激活,发挥抗炎效应。
3.3 促进髓鞘形成及轴突生长神经损伤会导致髓鞘及轴突的破坏,影响神经冲动的传导。在中枢神经系统中,髓鞘是由少突胶质细胞包绕轴突而形成,成熟的少突胶质细胞能产生髓鞘蛋白,其与髓鞘的正常形态和功能密切相关。因此,脑损伤后少突胶质细胞的分化与成熟以及轴突的生长对神经功能的修复起着重要作用。Otero-Ortega等[37]研究表明外泌体可促进轴突的再生以及少突胶质细胞的增殖、分化及迁移,并促进了新生轴突的髓鞘化,改善了脑损伤后的神经功能。Zhang等[7]发现神经元和远端轴突可摄取外泌体,外泌体中特定的miRNA可促进轴突生长:他们转染miRNA-17-92至MSC后发现,外泌体中高表达的miRNA-17-92可进一步促进轴突生长。Xin等[38]报道了miRNA-17-92靶向作用于信号通路蛋白AKT、mTOR、GSK-3β,促进其磷酸化,激活相应的信号通路,促进了轴突重建。另外,他们还发现外泌体中的miRNA-133b在转运到受损神经元后,可能通过调节酪氨酸羟化酶和多巴胺转运蛋白的产生,诱导轴突生长,并增强神经的可塑性,促进脑损伤修复[17]。
3.4 抑制细胞凋亡组织损伤使细胞受损、细胞凋亡增加。在兔脑缺血模型中,MSC的移植可显著增加缺血区神经元的密度并抑制神经元的凋亡[39]。研究表明,MSC的抗凋亡效应部分由外泌体介导。外泌体可调节抗凋亡基因BCL-2和促凋亡基因BAX的表达,使BCL-2/BAX的比率增加,抑制细胞凋亡[40]。
Zhang等[41]发现在氧化应激的情况下,外泌体中的某些细胞因子如IL-8、肿瘤坏死因子-α等可通过激活ERK1/2通路,促进细胞存活并刺激细胞增殖,同时对抗氧化应激所引起的线粒体膜电位增加,从而抑制细胞凋亡。Yu等[15]发现外泌体可释放多种具有抗凋亡作用的miRNA,特别是miRNA-19a,其通过激活AKT和ERK信号通路发挥抗凋亡作用。另外,Wang等[42]报道外泌体中的miR-21、miR-210通过降低caspase-3的表达,抑制细胞的凋亡。Feng等[16]报道了经过缺血预处理后,外泌体中miR-22含量增加,其被转运到靶细胞后,与细胞甲基化CpG结合蛋白相互作用,抑制细胞凋亡。
4 外泌体应用的前景与挑战新生儿脑损伤的治疗一直是棘手的问题,虽然目前的亚低温和药物治疗已取得了良好的疗效,但由于亚低温治疗的治疗窗窄且只限于胎龄≥36周的中至重度脑损伤的新生儿,仍有一些患儿不能从中受益[1]。因此着力于探索新型有效的治疗策略尤为重要。既往大量研究报道了MSC移植具有显著的神经功能修复疗效,但由于其潜在的致瘤和栓塞风险以及低存活率等缺点限制了其临床应用。近年来,有研究表明外泌体相比MSC能发挥更好的治疗作用。在胎羊缺血缺氧模型中报道了通过胎羊静脉内注射EVs,可以改善神经功能及结构的损伤,并可避免应用活细胞治疗的部分风险[3]。
相比MSC,外泌体大致具有以下几个优点:(1)外泌体的膜结合蛋白较少,因此它们的免疫原性低于MSC,从而降低了免疫细胞的识别及吞噬。(2)外泌体移植为无细胞治疗,降低了MSC移植所引起的致瘤及栓塞的风险。(3)外泌体是脂质结合的纳米级囊泡,可自由穿过血管壁,通过血脑屏障[9, 11]。(4)外泌体可以在-20℃的冷冻保存剂中储存6个月,而不会损失其生物活性,其良好的稳定性有利于储存及运输[43]。(5)外泌体的双层脂膜可包封和保护其内容物,防止了细胞因子及RNA等的迅速降解,并可携带si-RNA及治疗药物作用于靶部位。(6)外泌体缺乏自身代谢,其活性基本不受机体内环境的影响,可更好地发挥其功能特性[4, 11, 44]。
虽然外泌体有望成为理想的新兴治疗药物,协助脑损伤的治疗,但对于其临床应用,还面临着一些挑战:外泌体治疗的准确机制尚不清楚,还需进一步鉴定其中的活性物质并揭示其生物功能;外泌体中的某些分子如肿瘤坏死因子-α、IL-6是有害的,需鉴别并去除这些有害内容物以降低其毒副作用[9];改进现有的技术以进行大规模的外泌体分离与提纯;比较外泌体的细胞来源和给药途径,以及根据其半衰期制定合适的给药频次,以求发挥最好的治疗效果[6]。此外,最近研究报道应用生长因子和细胞因子及缺氧处理等方法对MSC进行预处理,或进行基因重编码与改造,可提升外泌体的疗效并提高其靶向性与安全性[6, 9]。
综上所述,虽然对于外泌体的内容物组成及生物学功能还有许多未解之谜,但随着研究的深入和技术的改进,将进一步揭示外泌体的作用机制,从而为新生儿脑损伤的治疗带来新方法。
| [1] |
Donega V, Nijboer CH, van Velthoven CT, et al. Assessment of long-term safety and efficacy of intranasal mesenchymal stem cell treatment for neonatal brain injury in the mouse[J]. Pediatr Res, 2015, 78(5): 520-526. DOI:10.1038/pr.2015.145 (  0) 0) |
| [2] |
Chang YS, Ahn SY, Sung S, et al. Stem cell therapy for neonatal disorders:prospects and challenges[J]. Yonsei Med J, 2017, 58(2): 266-271. DOI:10.3349/ymj.2017.58.2.266 (  0) 0) |
| [3] |
Ophelders DR, Wolfs TG, Jellema RK, et al. Mesenchymal stromal cell-derived extracellular vesicles protect the fetal brain after hypoxia-ischemia[J]. Stem Cells Transl Med, 2016, 5(6): 754-763. DOI:10.5966/sctm.2015-0197 (  0) 0) |
| [4] |
Yang Y, Ye Y, Su X, et al. MSC-derived exosomes and neuroinflammation, neurogenesis and therapy of traumatic brain injury[J]. Front Cell Neurosci, 2017, 11: 55. (  0) 0) |
| [5] |
Zhang G, Yang P. A novel cell-cell communication mechanism in the nervous system:exosomes[J]. J Neurosci Res, 2017 Jul 18. doi:10.1002/jnr.24113.[Epubaheadofprint]. https://www.ncbi.nlm.nih.gov/pubmed/28718905?dopt=Abstract
(  0) 0) |
| [6] |
Tran C, Damaser MS. Stem cells as drug delivery methods:application of stem cell secretome for regeneration[J]. Adv Drug Deliv Rev, 2015, 82-83: 1-11. DOI:10.1016/j.addr.2014.10.007 (  0) 0) |
| [7] |
Zhang Y, Chopp M, Liu XS, et al. Exosomes derived from mesenchymal stromal cells promote axonal growth of cortical neurons[J]. Mol Neurobiol, 2017, 54(4): 2659-2673. DOI:10.1007/s12035-016-9851-0 (  0) 0) |
| [8] |
Drommelschmidt K, Serdar M, Bendix I, et al. Mesenchymal stem cell-derived extracellular vesicles ameliorate inflammation-induced preterm brain injury[J]. Brain Behav Immun, 2017, 60: 220-232. DOI:10.1016/j.bbi.2016.11.011 (  0) 0) |
| [9] |
Konala VB, Mamidi MK, Bhonde R, et al. The current landscape of the mesenchymal stromal cell secretome:A new paradigm for cell-free regeneration[J]. Cytotherapy, 2016, 18(1): 13-24. DOI:10.1016/j.jcyt.2015.10.008 (  0) 0) |
| [10] |
Chen W, Huang Y, Han J, et al. Immunomodulatory effects of mesenchymal stromal cells-derived exosome[J]. Immunol Res, 2016, 64(4): 831-840. DOI:10.1007/s12026-016-8798-6 (  0) 0) |
| [11] |
黄静兰, 康冰瑶, 屈艺, 等. 外泌体对缺血再灌注器官损伤的保护作用[J]. 中国修复重建外科杂志, 2017, 31(6): 751-754. (  0) 0) |
| [12] |
Baglio SR, Rooijers K, Koppers-Lalic D, et al. Human bone marrow-and adipose-mesenchymal stem cells secrete exosomes enriched in distinctive miRNA and tRNA species[J]. Stem Cell Res Ther, 2015, 6: 127. DOI:10.1186/s13287-015-0116-z (  0) 0) |
| [13] |
Thakur BK, Zhang H, Becker A, et al. Double-stranded DNA in exosomes:a novel biomarker in cancer detection[J]. Cell Res, 2014, 24(6): 766-769. DOI:10.1038/cr.2014.44 (  0) 0) |
| [14] |
Liang X, Zhang L, Wang S, et al. Exosomes secreted by mesenchymal stem cells promote endothelial cell angiogenesis by transferring miR-125a[J]. J Cell Sci, 2016, 129(11): 2182-2189. DOI:10.1242/jcs.170373 (  0) 0) |
| [15] |
Yu B, Kim HW, Gong M, et al. Exosomes secreted from GATA-4 overexpressing mesenchymal stem cells serve as a reservoir of anti-apoptotic microRNAs for cardioprotection[J]. Int J Cardiol, 2015, 182: 349-360. DOI:10.1016/j.ijcard.2014.12.043 (  0) 0) |
| [16] |
Feng Y, Huang W, Wani M, et al. Ischemic preconditioning potentiates the protective effect of stem cells through secretion of exosomes by targeting Mecp2 via miR-22[J]. PLoS One, 2014, 9(2): e88685. DOI:10.1371/journal.pone.0088685 (  0) 0) |
| [17] |
Xin H, Li Y, Liu Z, et al. MiR-133b promotes neural plasticity and functional recovery after treatment of stroke with multipotent mesenchymal stromal cells in rats via transfer of exosome-enriched extracellular particles[J]. Stem Cells, 2013, 31(12): 2737-2746. DOI:10.1002/stem.1409 (  0) 0) |
| [18] |
Li P, Kaslan M, Lee SH, et al. Progress in exosome isolation techniques[J]. Theranostics, 2017, 7(3): 789-804. DOI:10.7150/thno.18133 (  0) 0) |
| [19] |
Zeringer E, Barta T, Li M, et al. Strategies for isolation of exosomes[J]. Cold Spring Harb Protoc, 2015, 2015(4): 319-323. (  0) 0) |
| [20] |
Lobb RJ, Becker M, Wen SW, et al. Optimized exosome isolation protocol for cell culture supernatant and human plasma[J]. J Extracell Vesicles, 2015, 4: 27031. DOI:10.3402/jev.v4.27031 (  0) 0) |
| [21] |
Tauro BJ, Greening DW, Mathias RA, et al. Comparison of ultracentrifugation, density gradient separation, and immunoaffinity capture methods for isolating human colon cancer cell line LIM1863-derived exosomes[J]. Methods, 2012, 56(2): 293-304. DOI:10.1016/j.ymeth.2012.01.002 (  0) 0) |
| [22] |
Kanwar SS, Dunlay CJ, Simeone DM, et al. Microfluidic device (ExoChip) for on-chip isolation, quantification and characterization of circulating exosomes[J]. Lab Chip, 2014, 14(11): 1891-1900. DOI:10.1039/C4LC00136B (  0) 0) |
| [23] |
Yu B, Zhang X, Li X. Exosomes derived from mesenchymal stem cells[J]. Int J Mol Sci, 2014, 15(3): 4142-4157. DOI:10.3390/ijms15034142 (  0) 0) |
| [24] |
Kim J, Tan Z, Lubman DM. Exosome enrichment of human serum using multiple cycles of centrifugation[J]. Electrophoresis, 2015, 36(17): 2017-2026. DOI:10.1002/elps.201500131 (  0) 0) |
| [25] |
Li S, Wang X, Li J, et al. Advances in the treatment of ischemic diseases by mesenchymal stem cells[J]. Stem Cells Int, 2016, 2016: 5896061. (  0) 0) |
| [26] |
Kitagawa M, Hojo M, Imayoshi I, et al. Hes1 and Hes5 regulate vascular remodeling and arterial specification of endothelial cells in brain vascular development[J]. Mech Dev, 2013, 130(9-10): 458-466. DOI:10.1016/j.mod.2013.07.001 (  0) 0) |
| [27] |
Gonzalez-King H, Garcia NA, Ontoria-Oviedo I, et al. Hypoxia inducible factor-1α potentiates jagged 1-mediated angiogenesis by mesenchymal stem cell-derived exosomes[J]. Stem Cells, 2017, 35(7): 1747-1759. DOI:10.1002/stem.v35.7 (  0) 0) |
| [28] |
Zhang B, Wu X, Zhang X, et al. Human umbilical cord mesenchymal stem cell exosomes enhance angiogenesis through the Wnt4/beta-catenin pathway[J]. Stem Cells Transl Med, 2015, 4(5): 513-522. DOI:10.5966/sctm.2014-0267 (  0) 0) |
| [29] |
Ma J, Zhao Y, Sun L, et al. Exosomes derived from AKT-modified human umbilical cord mesenchymal stem cells improve cardiac regeneration and promote angiogenesis via activating platelet-derived growth factor D[J]. Stem Cells Transl Med, 2017, 6(1): 51-59. DOI:10.5966/sctm.2016-0038 (  0) 0) |
| [30] |
Vrijsen KR, Maring JA, Chamuleau SA, et al. Exosomes from cardiomyocyte progenitor cells and mesenchymal stem cells stimulate angiogenesis via EMMPRIN[J]. Adv Healthc Mater, 2016, 5(19): 2555-2565. DOI:10.1002/adhm.v5.19 (  0) 0) |
| [31] |
Gong M, Yu B, Wang J, et al. Mesenchymal stem cells release exosomes that transfer miRNAs to endothelial cells and promote angiogenesis[J]. Oncotarget, 2017, 8(28): 45200-45212. (  0) 0) |
| [32] |
Ge XT, Lei P, Wang HC, et al. miR-21 improves the neurological outcome after traumatic brain injury in rats[J]. Sci Rep, 2014, 4: 6718. (  0) 0) |
| [33] |
Zhang B, Yin Y, Lai RC, et al. Mesenchymal stem cells secrete immunologically active exosomes[J]. Stem Cells Dev, 2014, 23(11): 1233-1244. DOI:10.1089/scd.2013.0479 (  0) 0) |
| [34] |
Huang P, Gebhart N, Richelson E, et al. Mechanism of mesenchymal stem cell-induced neuron recovery and anti-inflammation[J]. Cytotherapy, 2014, 16(10): 1336-1344. DOI:10.1016/j.jcyt.2014.05.007 (  0) 0) |
| [35] |
Kyurkchiev D, Bochev I, Ivanova-Todorova E, et al. Secretion of immunoregulatory cytokines by mesenchymal stem cells[J]. World J Stem Cells, 2014, 6(5): 552-570. DOI:10.4252/wjsc.v6.i5.552 (  0) 0) |
| [36] |
Phinney DG, Di Giuseppe M, Njah J, et al. Mesenchymal stem cells use extracellular vesicles to outsource mitophagy and shuttle microRNAs[J]. Nat Commun, 2015, 6: 8472. DOI:10.1038/ncomms9472 (  0) 0) |
| [37] |
Otero-Ortega L, Laso-García F, Gómez-de Frutos MD, et al. White matter repair after extracellular vesicles administration in an experimental animal model of subcortical stroke[J]. Sci Rep, 2017, 7: 44433. DOI:10.1038/srep44433 (  0) 0) |
| [38] |
Xin H, Katakowski M, Wang F, et al. MicroRNA cluster miR-17-92 cluster in exosomes enhance neuroplasticity and functional recovery after stroke in rats[J]. Stroke, 2017, 48(3): 747-753. DOI:10.1161/STROKEAHA.116.015204 (  0) 0) |
| [39] |
Zhu Y, Guan YM, Huang HL, et al. Human umbilical cord blood mesenchymal stem cell transplantation suppresses inflammatory responses and neuronal apoptosis during early stage of focal cerebral ischemia in rabbits[J]. Acta Pharmacol Sin, 2014, 35(5): 585-591. DOI:10.1038/aps.2014.9 (  0) 0) |
| [40] |
Zhao Y, Sun X, Cao W, et al. Exosomes derived from human umbilical cord mesenchymal stem cells relieve acute myocardial ischemic injury[J]. Stem Cells Int, 2015, 2015: 761643. (  0) 0) |
| [41] |
Zhang B, Shen L, Shi H, et al. Exosomes from human umbilical cord mesenchymal stem cells:identification, purification, and biological characteristics[J]. Stem Cells Int, 2016, 2016: 1929536. (  0) 0) |
| [42] |
Wang Y, Zhang L, Li Y, et al. Exosomes/microvesicles from induced pluripotent stem cells deliver cardioprotective miRNAs and prevent cardiomyocyte apoptosis in the ischemic myocardium[J]. Int J Cardiol, 2015, 192: 61-69. DOI:10.1016/j.ijcard.2015.05.020 (  0) 0) |
| [43] |
Braccioli L, van Velthoven C, Heijnen CJ. Exosomes:a new weapon to treat the central nervous system[J]. Mol Neurobiol, 2014, 49(1): 113-119. DOI:10.1007/s12035-013-8504-9 (  0) 0) |
| [44] |
Lai RC, Yeo RW, Tan KH, et al. Exosomes for drug delivery-a novel application for the mesenchymal stem cell[J]. Biotechnol Adv, 2013, 31(5): 543-551. DOI:10.1016/j.biotechadv.2012.08.008 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19

