2. 石河子大学医学院第一附属医院儿科, 新疆 石河子 832002
支气管哮喘(哮喘)是儿童时期最常见的慢性呼吸系统疾病,其发病率呈不断增长趋势[1]。儿童哮喘诊治不及时,随病程延长可产生气道高反应、气道不可逆性狭窄及气道重塑,严重影响儿童的身心健康。迄今为止,哮喘的发病机制尚未完全明确。近年来,以神经营养因子为重要介质介导的气道神经源性炎症反应在哮喘发病机制中的作用日益受到关注[2]。脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)是重要的神经营养因子,由多种免疫炎性细胞产生、贮存、释放,并作用于免疫炎性细胞,影响突触的可塑性及调节神经递质释放,并介导炎症反应发生[3]。研究表明[4-5],BDNF可能参与哮喘气道炎症、气道重塑及气道高反应性过程,但具体机制尚不明确,有关BDNF与哮喘病情严重程度的研究也甚少。本研究拟检测哮喘患儿外周血BDNF水平,探讨BDNF在儿童哮喘发病机制中的作用及其与哮喘病情严重程度的关系,为儿童哮喘防治提供理论依据。
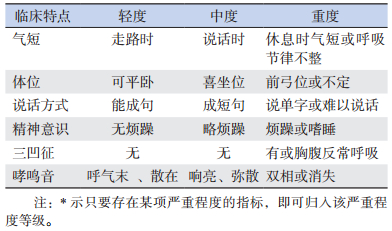
1 资料与方法 1.1 一般资料哮喘组选取2015年7月至2016年6月于石河子大学医学院第一附属医院儿科诊治的60例哮喘急性期患儿,其中男性39例、女性21例,年龄1.3~14.0岁,平均8±3岁;按病情严重程度分为轻度组(18例)、中度组(25例)和重度组(17例)。哮喘诊断及病情分度(见表 1)参照《2014年全球哮喘防治创议委员会儿童支气管哮喘最新修订指南》[6]。排除标准:合并癫癎、认知功能障碍、急性脑梗死、急性脊髓炎、抑郁症等神经精神疾病;合并慢性上气道咳嗽综合征、气管异物、支气管肺发育不良、胃食管反流、肺结核、先天性心脏病等。对照组选取同期本院体检的无支气管哮喘及家族史,无变态反应性疾病史(如湿疹、过敏性鼻炎、变应性皮炎等)及近期感染史,无神经精神疾病史,且近一个月无呼吸道感染的健康儿童60例,其中男性38例、女性22例,年龄1.1~14.4岁,平均7±3岁。本研究获得医院伦理委员会批准和监护人知情同意。
| 表 1 哮喘患儿急性发作期病情严重程度分级* |
1.2 ELISA测定血清BDNF
哮喘组儿童分别于哮喘发作期治疗前和症状缓解期(无喘息症状,肺部未闻及哮鸣音,予规范化糖皮质激素吸入控制治疗)抽取空腹静脉血各2 mL,对照组于就诊当天取空腹静脉血2 mL,室温(20~25℃)60 min后3 000 r/min离心10 min,取血清分装于EP管,-70℃冰箱冻存备检。采用酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)测定血清BDNF水平,试剂盒购自上海蓝基生物科技有限公司,操作按说明书进行。
1.3 统计学分析数据采用SPSS 17.0统计软件进行统计学处理。计量资料以均数±标准差(x±s)表示,正态分布且方差齐者采用t检验或方差分析,方差不齐者采用非参数检验;计数资料以率表示,采用卡方检验进行比较。P < 0.05为差异有统计学意义。
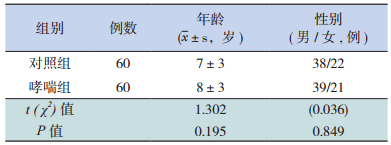
2 结果 2.1 一般资料比较哮喘组和对照组之间年龄、性别构成比的差异无统计学意义(P > 0.05),见表 2。
| 表 2 两组儿童一般资料比较 |
2.2 哮喘组、对照组BDNF水平比较
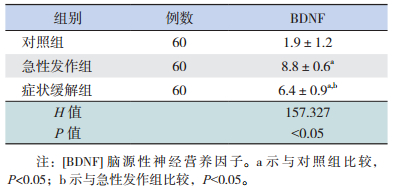
哮喘急性发作组及症状缓解组的BDNF水平均高于对照组,以急性发作组最高(P < 0.05);缓解期的BDNF水平低于发作期(P < 0.05)。见表 3。
| 表 3 哮喘组与对照组血清BDNF水平比较(x±s,ng/mL) |
2.3 不同严重程度哮喘的BDNF水平比较
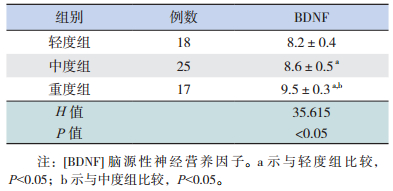
哮喘患儿病情严重程度不同,其血清BDNF水平不同:轻度组最低、重度组最高,差异有统计学意义(P < 0.05)。见表 4。
| 表 4 不同严重程度哮喘的BDNF水平比较(x±s,ng/mL) |
3 讨论
哮喘是由多种细胞(如嗜酸性粒细胞、肥大细胞、淋巴细胞、中性粒细胞、气道上皮细胞等)及神经递质共同参与的气道慢性炎症性疾病。其病因复杂,诱发及参与的因素很多,研究其发病机制,寻求哮喘治疗的新方法和途径,意义深远。
气道炎症、气道高反应、气道重塑为哮喘的特征,且均涉及神经机制的参与。神经与免疫机制相互作用可引起气道神经源性炎症反应,其中神经营养因子被认为是连接两者的桥梁。致敏原、感染等的刺激引起气道神经营养因子及其受体的高表达及过度分泌,导致神经可塑性改变和异常分化及参与气道高反应性[7]。作为联系气道免疫与神经机制的中介物质,神经营养因子在哮喘的发病过程中起着非常重要的作用。
BDNF是重要的神经营养因子。越来越多的研究显示[8-10],BDNF在炎症性疾病、过敏性疾病中呈现高表达,参与疾病的发生及发展。国外研究[11]发现,BDNF水平在变应性皮炎患者血浆中显著升高,嗜酸性粒细胞表面的受体p75NTR、TrkB也表达增高;BDNF可促使嗜酸性粒细胞趋化指数增加而阻止其凋亡,可能通过增加BDNF受体的表达而发挥作用。既往研究[12]表明BDNF在变异性哮喘小鼠模型中的含量显著升高,并且与气道阻塞和局部神经元反应性增高相关,参与过敏性气道功能失常过程。张艳等[13]发现BDNF在哮喘大鼠肺内表达明显高于对照组,且与哮喘大鼠气道壁厚度呈正相关,应用免疫组织化学染色发现BDNF主要表达于大鼠肺组织的气道上皮、平滑肌细胞及肺间质细胞内。且研究[14-15]发现,BDNF可以促进气道平滑肌细胞的增生,推测BDNF可能通过促进气道壁结构细胞的增生、参与哮喘气道重塑过程。李秋根等[2]在支气管哮喘神经源性炎症的基础上采用抗BDNF抗体干预哮喘大鼠,发现哮喘症状有所减轻,大鼠的气道高反应性也明显降低,同时随着肺组织中BDNF水平升高气道感觉神经元SYN mRNA及NF mRNA也明显升高,表明BDNF参与了调节气道神经可塑性及气道高反应性的发生过程,且提示抗BDNF抗体可能对哮喘的治疗有一定的作用。
本研究结果显示哮喘急性发作组及症状缓解组的BDNF水平均明显高于对照组,与倪萍等[16]的研究结果一致,表明BDNF可能在儿童哮喘的发病机制中起着一定的作用;经规范化吸入糖皮质激素控制治疗后处于缓解期时,血清BDNF水平较发作期明显降低,提示糖皮质激素可能通过降低BDNF的水平治疗哮喘。Jeanneteau等[17]研究显示糖皮质激素可能通过调节脑源性神经营养因子受体TrkB来调节BDNF的表达,但具体机制仍有待研究。此外,本研究将发作期哮喘患儿按病情严重程度分级后发现,哮喘发作期患儿血清BDNF水平随病情加重而增高,与其病情严重程度呈正相关,提示血清BDNF水平与哮喘的严重程度相关。
综上所述,BDNF可能在儿童哮喘的发病机制中起着一定的作用且与哮喘病情严重程度相关,检测血清BDNF水平将有助于评估哮喘患儿的病情,对判断儿童哮喘的发展及预后可能有一定的作用。目前抗BDNF抗体应用于动物模型已取得较好的效果,但若真正应用于临床以达到治疗疾病的目的,其安全性及治疗效果仍有待进一步的探究。
| [1] | 刘传合, 洪建国, 尚云晓, 等. 中国16城市儿童哮喘患病率20年对比研究[J]. 中国实用儿科杂志, 2015, 30 (8): 596–600. |
| [2] | 李秋根, 王爱平, 夏莺, 等. 支气管哮喘大鼠肺内神经营养因子对气道高反应性影响的研究[J]. 中华神经医学杂志, 2012, 11 (1): 31–36. |
| [3] | 吴莎, 华清泉, 杨琨, 等. 脑源性神经营养因子研究进展[J]. 中华临床医师杂志(电子版), 2013, 7 (9): 3988–3990. |
| [4] | Prakash YS, Martin RJ. Brain-derived neurotrophic factor in the airways[J]. Pharmacol Ther, 2014, 143 (1): 74–86. DOI:10.1016/j.pharmthera.2014.02.006 |
| [5] | Yinli C, Jie H, Li Z, et al. Association between brain-derived neurotrophic factor variants and asthma in Chinese Han children[J]. Acta Paediatr, 2013, 102 (6): e247–250. DOI:10.1111/apa.12224 |
| [6] | Global initiative for asthma.Global strategy for asthma management and prevention[EB/OL].(2014-5)[2016-7].http://ginasthma.org/. |
| [7] | Sathish V, Vanoosten SK, Miller BS, et al. Brain-derived neurotrophic factor in cigarette smoke-induced airway hyperreactivity[J]. Am J Respir Cell Mol Biol, 2013, 48 (4): 431–438. DOI:10.1165/rcmb.2012-0129OC |
| [8] | Stoll P, Wuertemberger U, Bratke K, et al. Stage-dependent association of BDNF and TGF-β1 with lung function in stable COPD[J]. Respir Res, 2012, 13 : 116. DOI:10.1186/1465-9921-13-116 |
| [9] | 冯爽, 史瑞明. 支气管哮喘相关基因的研究进展[J]. 国际儿科学杂志, 2015, 42 (2): 121–124. |
| [10] | 陈大伟, 刘燕青, 张朝. 脑源性神经营养因子的研究进展[J]. 北方药学, 2015, 12 (3): 110–112. |
| [11] | Ma L, Gao XH, Zhao LP, et al. Brain-derived neurotrophic factor gene polymorphisms and serum levels in Chinese atopic dermatitis patients[J]. J Eur Acad Dermatol Venereol, 2009, 23 (11): 1277–1281. DOI:10.1111/jdv.2009.23.issue-11 |
| [12] | Lommatzsch M, Braun A, Renz H. Neurotrophins in allergic airway dysfunction:what the mouse model is teaching US[J]. Ann N Y Acad Sci, 2003, 992 : 241–249. DOI:10.1111/nyas.2003.992.issue-1 |
| [13] | 张艳, 许秀娟, 王伟. 支气管哮喘大鼠肺内脑源性神经营养因子和降钙素基因相关肽的表达及布地奈德的干预作用[J]. 国际呼吸杂志, 2015, 35 (17): 1281–1284. |
| [14] | Aravamudan B, Thompson M, Pabelick C, et al. Brain-derived neurotrophic factor induces proliferation of human airway smooth muscle cells[J]. J Cell Mol Med, 2012, 16 (4): 812–823. DOI:10.1111/j.1582-4934.2011.01356.x |
| [15] | Vohra PK, Thompson MA, Sathish V, et al. TRPC3 regulates release of brain-derived neurotrophic factor from human airway smooth muscle[J]. Biochim Biophys Acta, 2013, 1833 (12): 2953–2960. DOI:10.1016/j.bbamcr.2013.07.019 |
| [16] | 倪萍, 张春玲. 支气管哮喘患者血清脑源性神经营养因子含量的变化及其临床意义[J]. 临床肺科杂志, 2008, 13 (9): 1130–1131. |
| [17] | Jeanneteau F, Chao MV. Are BDNF and glucocorticoid activities calibrated[J]. Neuroscience, 2013, 239 (23): 173–195. |
 2017, Vol. 19
2017, Vol. 19