先天性纯红细胞再生障碍性贫血又称Diamond-Blackfan贫血(Diamond-Blackfan anemia, DBA)是一种少见的先天性骨髓衰竭性疾病,其血液学特点为巨幼红细胞性贫血,网织红细胞计数减少,骨髓粒系、巨核系细胞增生正常、红系细胞明显缺乏,因Diamond和Blackfan于1938年首先报道而得名[1-2]。欧美国家DBA的发病率为5~7/100万,国内暂没有DBA发病率的统计[3]。首先被证实与DBA发生有关的基因为编码核糖体小亚基蛋白19的RPS19基因,随后发现编码其他核糖体蛋白的基因,如RPL5、RPS17、RPS24、RPS7基因突变也可导致DBA发生[4-5]。本文结合2例DBA患者并进行相关文献复习,总结该病的临床及基因特点,以提高临床医师的认识。
1 资料与方法 1.1 研究对象病例1,男,3个月。因面色苍黄近一个月入院,无皮肤黏膜出血,无发热、呕吐、抽搐,大小便正常。查体:T37.2℃,P132次/min,R36次/min,头颅五官无畸形,面色苍黄,全身皮肤无黄染、未见皮疹、无水肿。双肺未闻及罗音;心律齐,心音有力,心脏各听诊区均未闻及杂音;腹软,肝脾肋下未触及;脊柱四肢无畸形。实验室检查:白细胞及血小板数正常,Hb 37 g/L,RBC降至1.08×1012/L,红细胞压积(HCT)降至9.2%,网织红细胞计数4.1×109/L(参考值:24~84×109/L),红细胞平均体积、平均血红蛋白、平均血红蛋白浓度正常;血清铁42.1 mmol/L(参考值:14.3~26.9 mmol/L)、血清铁蛋白484.2 ng/mL(参考值:12~290 ng/mL)。红细胞脆性实验未见异常。骨髓细胞学显示:红系比例约2%、明显降低,幼红细胞罕见(早幼红细胞缺如,中幼红细胞约1.5%,晚幼红细胞约0.5%),粒系比例约为62%,淋巴细胞系比例约为26%,单核细胞比例约为4%,提示纯红细胞再生障碍贫血(pure red cell anemia, PRCA)可能性大。患儿既往无特殊,父母非近亲结婚,家族中均无类似病史。
病例2,女,2个月。面色苍黄20 d。不伴皮肤黏膜出血及发热、抽搐,偶有咳嗽和间断吐奶,大小便正常。查体:T36.9℃,P130次/min,R35次/min,贫血面容,神志清楚,全身皮肤未见皮疹,头颅五官无畸形,双侧呼吸运动对称,双肺未闻及罗音,心律齐,心音有力,各听诊区未闻及杂音,腹平软,肝脾未及。脊柱四肢无畸形。实验室检查:白细胞及血小板数目正常,Hb 41 g/L,RBC 1.35×1012/L,红细胞压积降至13.4%,网织红细胞计数4.3×109/L(参考值:24~84×109/L);红细胞平均血红蛋白为38.4 pg(正常值:25~35 pg),红细胞平均体积、平均血红蛋白浓度正常;血清铁44.1 mmol/L(参考值:14.3~26.9 mmol/L),血清铁蛋白467.6 ng/mL(参考值:12~290 ng/mL);骨髓细胞学:有核红细胞难以见到(红系缺如或比例极低),粒系细胞比例约为63%,淋巴细胞系比例约为29%,单核细胞比例约为5%。腹部彩超未见异常。患儿既往无特殊,父母非近亲结婚,家族中均无类似病史。
根据DBA诊断标准[6]:(1)发生在出生后12个月以内的大细胞正色素性贫血,白细胞数正常或稍降低,血小板数正常或稍增加;(2)网织红细胞明显减少;(3)骨髓增生活跃,选择性红系前体细胞明显减少;(4)血清促红细胞生成素水平增高;(5)排除继发性单纯红细胞再生障碍性贫血。本研究2例患儿均符合第2、3条诊断标准,且无细小病毒B19感染依据,无苯妥英钠、氯霉素等用药史,DBA可能性大。
1.2 致病基因检测采集患者及家属的外周静脉血2 mL,提取基因组DNA。DBA致病基因RPS19及RPL5的引物由上海生工合成,引物序列见表 1。PCR反应体系及扩增程序:基因组DNA 50~100 ng,dNTP 200 μmol/L,MgCl2 1.5 mmol/L,上下游引物各0.5 μmol/L,Taq DNA聚合酶0.5 U(大连TAKARA公司),加水至终体积25 μL。94℃预变性3 min,94℃变性30 s,55~60℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测合格后送上海生工生物公司进行Sanger测序分析。
| 表 1 RPS19基因以及RPL5基因的引物序列 |
本研究获得医院医学伦理学委员会批准及患者家属知情同意。
1.3 生物信息学分析利用Polyphen2(http://genetics.bwh.harvard.edu/pph2/)、及SIFT(http://sift.jcvi.org/)软件对致病基因检测发现的新突变进行功能预测分析。并利用NCBI数据库进行不同物种间的保守序列分析。
2 结果 2.1 致病基因测序分析利用RPS19基因及RPL5基因特异性引物扩增该基因全部外显子,并对PCR产物进行测序分析,发现:病例1的RPS19基因存在c.212G > A(p. G71Q)杂合突变(图 1),患儿父母在该位点均未见突变。病例2的RPL5基因存在c.740T > C(p.I247L)突变(图 1),其父母在该位点未见异常。
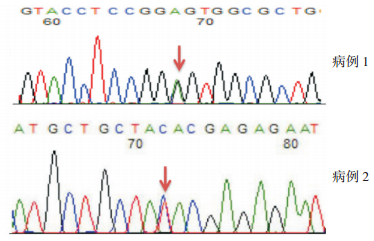
|
图 1 2例患儿的RPS19基因及RPL5基因测序 病例1的RPS19基因存在c.212G > A(p. G71Q)杂合突变,病例2的RPL5基因存在c.740T > C(p. I247L)突变。突变位点如箭头所示。 |
2.2 生物信息学分析
利用生物信息学的方法预测病例2 RPL5基因的c.740T > C(p. I247L)突变是否为致病性突变。Polyphen2软件预测分数为1.00(得分越接近1.00者,致病的可能性越大),SIFT软件预测的结果为0.00(得分 < 0.05可能影响蛋白质功能)。并在NCBI数据库中应用不同物种之间的保守序列分析发现,RPL5蛋白247位的异亮氨酸(c.740T > C突变导致编码的RPL5蛋白在247位由异亮氨酸变为亮氨酸)十分保守,见图 2,说明该位点突变对蛋白发挥正常功能具有重要影响。
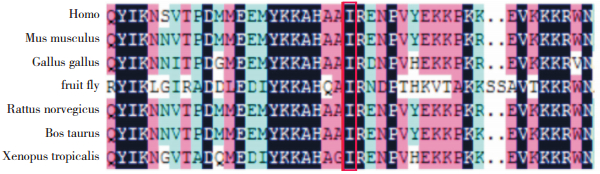
|
图 2 RPL5蛋白247位氨基酸保守性分析 红色框内为该位点,在不同的物种间(家鼠、原鸡、果蝇、褐鼠、牛以及非洲爪蟾)均高度保守。 |
2.3 治疗与随访
两例患儿入院后均予以红细胞输注,出院时患者1的Hb为93 g/L,患者2为88 g/L;出院后均口服甲泼尼龙片(每日一次,每次7.5 mg),并定期随访,目前已随访5个月。患者1出院1个月时Hb降至54 g/L,再次输注红细胞,之后Hb维持在82~92 g/L;患者2出院以后Hb维持在83~91 g/L。
3 讨论DBA是一种少见的遗传性骨髓衰竭性疾病,但在儿童先天性骨髓衰竭性疾病中所占比例较高,仅次于范可尼贫血[7]。一般在生后数月起病,男女发病比例大致相同,大部分为散发,约10%~25%的患者有家族史[8]。
DBA的发病机制可能与红系祖细胞内在异常、红系造血调控异常以及核糖体相关蛋白的功能异常有关。DBA与核糖体蛋白的关系是DBA发病机制研究的热点,目前已将该疾病归类于核糖体病[9-10]。有研究发现约25%的DBA患者有RPS19基因突变,2%的DBA存在RPS24基因突变,编码核糖体蛋白的RPS17基因、RPL5基因、RPL11基因以及RPL35a基因突变也可导致DBA发生[5, 11]。
RPS19基因定位于19q13.2区域,全长11 kb,包括6个外显子,其编码的RPS19蛋白是首先被发现的与DBA发病相关的核糖体蛋白[13]。RPS19蛋白非常保守,含有144个氨基酸,可能参与40S核糖体前体的组装和成熟,从而实现细胞内翻译、转运调控功能[12]。RPL5基因位于1p22.1区域,其编码的蛋白是属于核糖体60S的一个亚单位,且该蛋白可结合5S rRNA形成RNP,维持核糖体的正常功能[13]。
本研究中的2例患者均呈重度贫血,骨髓细胞学检测提示幼红细胞罕见,进行DBA相关致病基因检测,发现1例患儿的RPS19基因存在c.212G > A(p. G71Q)杂合突变,该突变为错义突变,导致编码的RPS19蛋白在71位由甘氨酸突变为谷氨酸。有报道该位点突变为致病性突变[14],但患儿父母的RPS19基因该位点未见异常,因此患儿可能为新发突变。另1例患儿的RPL5基因存在c.740T > C(p. I247L)突变,此突变可导致编码的RPL5蛋白在247位由异亮氨酸转变为亮氨酸,检索NCBI数据库及千人基因数据库(1 000 genomes)发现该位点不是多态性位点,且DBA在该位点的突变未见报道;但根据生物信息学分析预测、不同物种间保守性分析以及患者的临床表现,推测该位点可能为致病性位点,但仍需要进一步细胞水平及动物实验的验证。
约1/3的DBA患者合并先天畸形,如发育迟缓、尿道畸形、先天性心脏病以及拇指三指节畸形等,且该类患儿易并患急性非淋巴细胞白血病及非造血系统肿瘤[9]。有研究发现RPL5基因与RPL11基因的突变与DBA合并畸形相关,编码核糖体蛋白基因突变的DBA患儿畸形发生率大于40%,明显高于无突变患儿[15],但本文两例患者暂未发现明显畸形,不排除与患儿年龄尚小有关,应注意这方面的随访。
DBA主要采用糖皮质激素进行治疗。郑杰等[8]研究显示,约60%~75%的DBA患者对糖皮质激素有反应,部分患儿能获得持续性缓解(29例接受激素治疗的DBA患儿中3例完全缓解)。其次为红细胞输注对症治疗,但长期输血有并发血色病的可能。有条件可行造血干细胞移植进行DBA根治性治疗,但干细胞来源以及移植相关并发症在一定程度限制了其临床应用[8]。
综上,DBA多在半岁以内起病,表现为巨幼红细胞性贫血、红系明显减少,编码核糖体亚基蛋白的基因突变,因此应尽早进行相关致病基因检测以明确诊断。
| [1] | Ear J, Huang H, Wilson T, et al. RAP-011 improves erythropoiesis in zebrafish model of Diamond-Blackfan anemia through antagonizing lefty1[J]. Blood, 2015, 126 (7): 880–890. DOI:10.1182/blood-2015-01-622522 |
| [2] | Jaako P, Debnath S, Olsson K, et al. Gene therapy cures the anemia and lethal bone marrow failure in a mouse model of RPS19-deficient Diamond-Blackfan anemia[J]. Haematologica, 2014, 99 (12): 1792–1798. DOI:10.3324/haematol.2014.111195 |
| [3] | Sakaguchi H, Nakanishi K, Kojima S, et al. Inherited bone marrow failure syndrome in 2012[J]. Int J Hematol, 2013, 97 (1): 20–29. DOI:10.1007/s12185-012-1249-9 |
| [4] | Draptchinskaia N, Gustavsson P, Andersson B, et al. The gene encoding ribosomal protein S19 is mutated in Diamond-Blackfan anaemia[J]. Nat Genet, 1999, 21 (2): 169–175. DOI:10.1038/5951 |
| [5] | Wang R, Yoshida K, Toki T, et al. Loss of function mutations in RPL27 and RPS27 identified by whole-exome sequencing in Diamond-Blackfan anaemia[J]. Br J Haematol, 2015, 168 (6): 854–864. DOI:10.1111/bjh.2015.168.issue-6 |
| [6] | Valchos A, Ball S, Dahl N, et al. Diagnosing and treating Diamond-Blackfan Anaemia:results of an international clinical consensus conference[J]. Br J Hematol, 2008, 142 (6): 859–876. DOI:10.1111/bjh.2008.142.issue-6 |
| [7] | Kuramitsu M, Sato-Otsubo A, Morio T, et al. Extensive gene deletions in Japanese patients with Diamond-Blackfan anemia[J]. Blood, 2012, 119 (10): 2376–2384. DOI:10.1182/blood-2011-07-368662 |
| [8] | 郑杰, 吴润晖. Diamond-Blackfan贫血临床和分子生物学研究进展[J]. 中国实用儿科杂志, 2009, 24 (2): 148–150. |
| [9] | Quarello P, Garelli E, Carando A, et al. Ribosomal RNA analysis in the diagnosis of Diamond-Blackfan Anaemia[J]. Br J Haematol, 2016, 172 (5): 782–785. DOI:10.1111/bjh.2016.172.issue-5 |
| [10] | Aspesi A, Pavesi E, Robotti E, et al. Dissecting the transcriptional phenotype of ribosomal protein deficiency:implications for Diamond-Blackfan anemia[J]. Gene, 2014, 545 (2): 282–289. DOI:10.1016/j.gene.2014.04.077 |
| [11] | Delaporta P, Sofocleous C, Stiakaki E, et al. Clinical phenotype and genetic analysis of RPS19, RPL5, and RPL11 genes in Greek patients with Diamond-Blackfan anemia[J]. Pediatr Blood Cancer, 2014, 61 (12): 2249–2255. DOI:10.1002/pbc.v61.12 |
| [12] | Morimoto K, Lin S, Sakamoto K. The functions of RPS19 and their relationship to Diamond-Blackfan anemia:a review[J]. Mol Genet Metab, 2007, 90 (4): 358–362. DOI:10.1016/j.ymgme.2006.11.004 |
| [13] | Quarello P, Garelli E, Carando A, et al. Diamond-Blackfan anemia:genotype-phenotype correlations in Italian patients with RPL5 and RPL11 mutations[J]. Haematologica, 2010, 95 (2): 206–213. DOI:10.3324/haematol.2009.011783 |
| [14] | Boria I, Garelli E, Gazda HT, et al. The ribosomal basis of Diamond-Blackfan Anemia:mutation and database update[J]. Hum Mutat, 2010, 31 (12): 1269–1279. DOI:10.1002/humu.21383 |
| [15] | 刘天峰, 万杨, 陈玉梅, 等. Diamond-Blackfan贫血患儿的临床分析[J]. 国际输血及血液学杂志, 2014, 37 (5): 406–411. |
 2017, Vol. 19
2017, Vol. 19



