急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)是儿童时期最常见的淋巴造血系统恶性肿瘤,随着诊疗水平的进步,长期无病生存率明显提高。严重感染是ALL患儿诱导缓解期最常见威胁生命的严重并发症,即使在有效的抗感染治疗下,通常也需要进行数周至数月的抗感染治疗,而较长时间的抗感染治疗往往导致化疗延迟进而增加白血病复发的风险[1-2]。因此,了解儿童ALL诱导缓解期感染的发生情况及严重感染发生的相关因素,分析病原菌的构成和药物敏感性,是治疗成功的关键。本研究回顾性分析130例初治儿童ALL诱导缓解期的感染及其致病菌、药敏情况,现报道如下。
1 资料与方法 1.1 研究对象回顾性分析福建医科大学附属协和医院小儿血液科2013年1月至2014年7月收治的130例初治ALL儿童的临床资料,不包括成熟B-ALL。所有患儿均根据骨髓细胞形态学、免疫学、细胞遗传学及融合基因确诊。130例患儿中,男74例、女56例,年龄1~10岁(平均年龄5.0±2.1岁)。根据儿童急性淋巴细胞白血病诊疗建议(第四次修订)[3],130例患儿分为标、中、高危组(分别为70、31、29例),并予以相应危险度的化疗方案。化疗前均经外周静脉置入中心静脉置管(peripherally inserted central catheter, PICC)。
1.2 中性粒细胞缺乏和发热的定义中性粒细胞缺乏[4]:ANC < 0.5×109/L。发热[5]:单次腋温≥38.5℃或腋温≥38.0℃持续 > 1 h。
1.3 感染定义感染包括临床感染(clinically documented infection, CDI)即有特殊的症状体征或影像学阳性;微生物学证据的感染(microbiologically documented infection, MDI)即血培养阳性或其他送检标本培养阳性伴有相应的临床感染证据[6]。严重感染定义为影像学出现新的肺部浸润性病灶和/或血培养阳性的菌血症[6]。
1.4 抗感染措施根据感染部位、临床特点以及实验室检查给予经验性抗感染治疗。一线治疗给予头孢三代或碳青霉烯类,至少7 d或热退后3~5 d停药,并根据血培养及药敏试验、结合临床表现调整抗生素;抗感染治疗48 h后发热不退或合并严重黏膜炎、肺部感染、皮肤软组织感染,则加用万古霉素;对持续发热5 d以上或临床怀疑真菌感染者,予伏立康唑或棘白霉素抗真菌治疗[7]。
1.5 统计学分析所有统计学处理均采用SPSS 18.0软件完成。正态分布的计量资料用均数±标准差(x±s)表示,组间比较采用t检验;非正态分布的计量资料用中位数(四分位间距)[P50(P25,P75)]描述,组间比较用Mann-Whitney U检验。计数资料用百分率(%)表示,组间比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 诱导缓解期感染情况130例患儿中,临床感染和/或微生物学证据感染(CDI/MDI)99例(76.2%),其中肺部感染60例(46.2%),溃疡性口腔炎54例(41.5%),肠道感染23例(17.7%),鹅口疮22例(16.9%),败血症21例(16.2%),皮肤感染11例(8.5%);不明原因发热7例(5.4%);无CDI/MDI的24例(18.5%)。
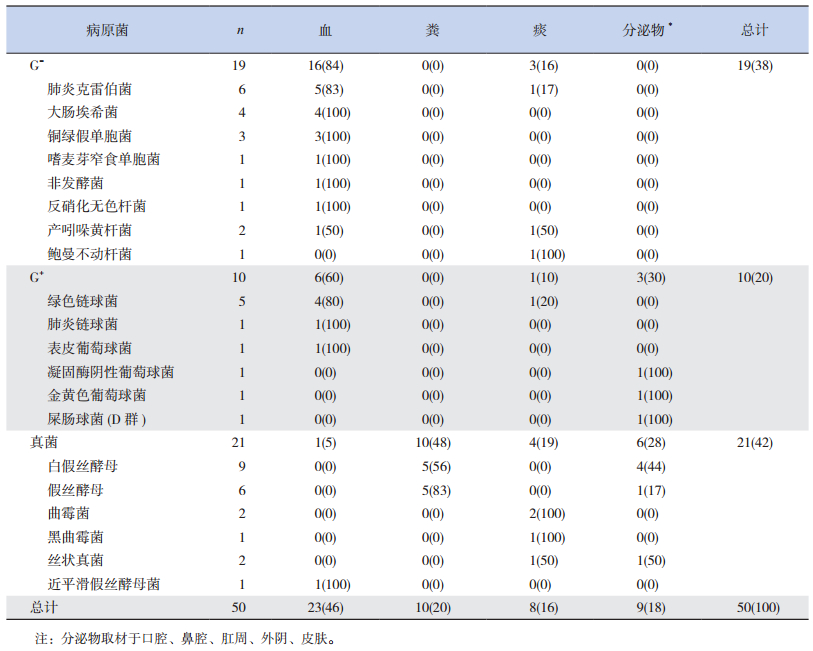
2.2 诱导缓解期感染的微生物检出情况130例患儿共检出50株微生物,其中G-菌19株(38%),G+菌10株(20%),真菌21株(42%)。37例(28.5%)存在至少1种微生物感染;10例(7.7%)至少有两种以上的微生物感染。2例患儿同时于血液及分泌物(肛周、外阴)中检出大肠埃希菌或铜绿假单胞菌。29株细菌中,G-菌19株(65.5%),G+菌10株(34.5%)。细菌培养阳性率较高的标本为血液(22/29,76%)、痰(4/29,14%)和分泌物(3/29,10%)。最常见的G-菌为肺炎克雷伯菌(6/19,32%)、大肠埃希菌(4/19,21%)和铜绿假单胞菌(3/19,16%);10例肺炎克雷伯菌和大肠埃希菌检测了超广谱β内酰胺酶(ESBL),阳性率为50%(5/10)。最常见的G+菌为绿色链球菌(5/10,50%)。见表 1。
| 表 1 各标本的菌株检出情况[n (%)] |
在粪便、分泌物以及痰标本中真菌检出率分别为48%(10/21)、29%(6/21)、19%(4/21),而血培养仅检测到1株真菌(1/21,5%)。最常见的真菌感染为白色假丝酵母菌(9/21,42.9%)感染。
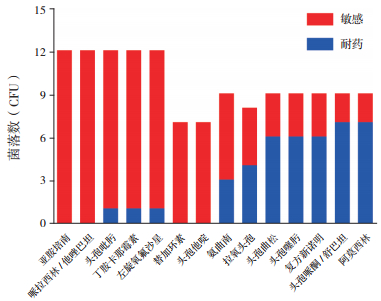
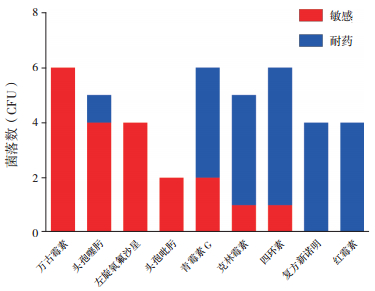
2.3 菌血症(败血症)患儿的细菌药敏情况G-菌对亚胺培南、哌拉西林/他唑巴坦、头孢吡肟、丁胺卡那、左旋氧服沙星、替加环素、头孢他啶敏感,对阿莫西林、头孢哌酮/舒巴坦、复方新诺明、头孢噻肟、头孢曲松耐药,见图 1。G+菌对红霉素、复方新诺明、四环素、克林霉素、青霉素耐药,而对万古霉素、左旋氧氟沙星、头孢吡肟敏感,见图 2。
|
图 1 G-菌耐药菌谱分布 |
|
图 2 G+菌耐药菌谱分布 |
2.4 诱导缓解期严重感染与非严重感染患儿的临床因素比较
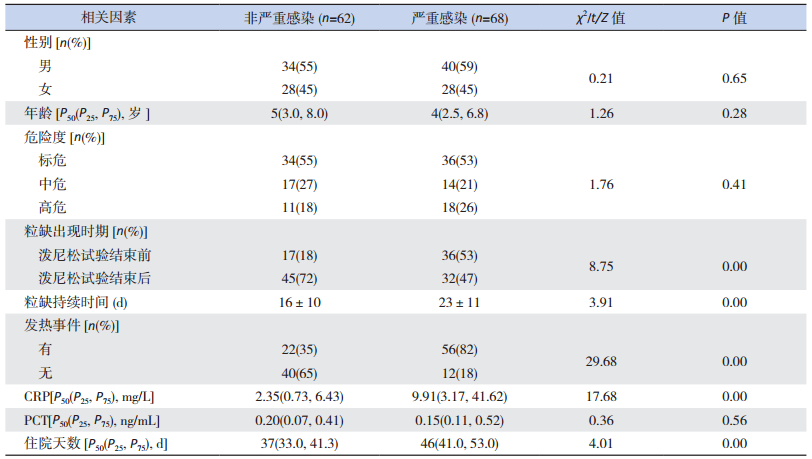
与非严重感染患儿相比,严重感染患儿粒细胞缺乏出现更早、持续时间更长,发热事件的比例和CRP更高,住院天数也更长,差异具有统计学意义(P < 0.05);而两组患儿在性别构成比、年龄、危险度和PCT水平的差异无统计学意义(P > 0.05)。见表 2。
| 表 2 诱导缓解期严重感染与非严重感染患儿的临床因素比较 |
2.5 抗感染治疗
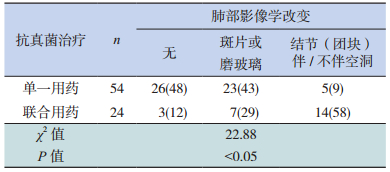
初始抗感染治疗应用头孢哌酮/舒巴坦的52例,碳青霉烯类抗生素的60例;由头孢哌酮/舒巴坦更换为碳青霉烯类抗生素的36例(36/52,69.2%);加用万古霉素的78例。接受抗真菌治疗的78例,其中经验性治疗22例(28%),诊断驱动治疗36例(46%),目标治疗20例(26%)。78例接受抗真菌治疗的患儿中,肺部影像学无异常或表现为斑片或磨玻璃病变的以单一用药的较多,表现为结节(团块)伴/不伴空洞者联合用药较多,见表 3。本组病例中严重感染68例,包括单独肺部感染47例,单独败血症8例,以及肺部感染合并败血症13例,其中1例出现血流动力学不稳、4例气胸、8例呼吸急促需要重症监护。130例患儿中1例因重症感染未控制要求出院、1例因真菌败血症死亡。
| 表 3 抗真菌治疗选择与肺部影像学的关系[n (%)] |
3 讨论
感染是儿童ALL最常见并发症,可发生于治疗的任何阶段,但更常见于诱导缓解期。感染常常与严重的粒细胞缺乏、黏膜炎、中心导管的应用,以及化疗所致的免疫抑制相关,不同个体并发严重感染的风险并不相同,但与危险度分层、治疗反应无明显相关[1-2, 8]。严重感染导致化疗患儿住院时间延长,经济负担、心理负担进一步加重,同时也可能影响化疗疗效甚至增加患儿死亡风险。探讨ALL患儿诱导缓解期严重感染的发生规律、病原分布特点,以及影响因素对于感染控制以及改善预后至关重要。
ALL诱导缓解期常出现中性粒细胞缺乏,而中性粒细胞缺乏被认为是导致白血病患儿重症感染的危险因素[9]。重症感染以肺部感染、菌血症最常见。肺部感染可致低氧血症、呼吸急促、呼吸衰竭;菌血症可快速发展为感染性休克,被称为不良事件[10-11]。本研究将肺部感染(60/130,46.2%)和/或菌血症(21/130,16.2%)作为重症感染,分析与之相关的因素,探讨预测诱导缓解期严重感染的可能性。结果发现,泼尼松试验结束前出现粒缺的,以及粒缺持续时间越长的,越容易发生严重感染。Li等[8]报道,儿童急性淋巴细胞白血病83.1%的感染发生于诱导缓解期间中性粒细胞缺乏阶段,化疗第8、15天最易于出现中性粒细胞缺乏和感染。
血清学标记物如TNF-α、IL-1β、IL-8、sTNFRII可用于感染的早期快速诊断,而最常应用于临床的为CRP和PCT[12]。CRP在感染早期( < 24 h)即升高,但特异性不强[12]。本研究重症感染患儿的CRP水平高于非重症感染。健康人PCT很低( < 0.5 ng/mL),而严重细菌感染者PCT可升高至1 000 ng/mL,被认为是判断严重细菌感染的最好指标[12]。PCT来源于中性粒细胞和肝细胞,但由于化疗导致中性粒细胞缺乏和药物性肝损害,粒缺并感染时的PCT升高可能受到影响[12-13]。本研究显示重症感染与非重症感染的PCT均处于较低水平,可能与上述原因相关。但史柳红等[14]报道肿瘤患儿脓毒症组的CRP和PCT水平高于非脓毒症组,认为CRP和PCT仍可作为肿瘤患儿重症感染早期识别的可靠指标。
粒细胞缺乏期感染最常见的病原仍然是细菌,西方国家以G+菌为主[1],亚洲国家仍以G-菌最常见[9]。有研究者认为导管的使用可能增加革兰阳性菌感染比例[9, 15]。本研究所有患儿均使用PICC,G-菌占检出细菌的65.5%,与Li等[8]的报道相似,这种差异可能与遗传因素和环境因素有关。本研究检出的G-菌以肺炎克雷伯菌和大肠埃希菌多见,而这两种细菌的50%菌株ESBL阳性,导致β类酰胺抗生素耐药,因此ALL患儿诱导缓解期初始抗感染治疗推荐单一广谱的碳青霉烯类,与Li等[8]研究基本一致。
儿童急性白血病化疗后真菌感染逐年增多,与中心静脉置管、严重的粒细胞缺乏,广谱抗生素及糖皮质激素的应用等危险因素有关。侵袭性真菌感染以假丝酵母菌、曲霉菌最常见。假丝酵母菌通常定植于胃肠道或口腔,易侵入血流,而曲霉菌通常是吸入的[16]。本组资料显示,假丝酵母菌多数从粪便以及口腔、外阴的分泌物中检出,曲霉菌多数于痰标本检出;而血培养很难培养到真菌,血培养仅检出1株近平滑假丝酵母菌,虽药敏提示抗真菌药均敏感,但最终感染未能控制、死亡。文献报道真菌性脓毒症的死亡率 > 50%[17],需引起高度重视。由于侵袭性真菌感染常常表现不典型,并常呈混合感染,血培养阳性率低、缺乏特异性的早期诊断指标,因此合理的抗真菌治疗对降低感染相关死亡率至关重要。本组资料显示,对于肺部影像学无异常或表现为非特异的斑片影、磨玻璃影时可选择单一抗真菌药治疗,而表现为结节团块伴或不伴空洞形成者常常需要抗真菌药联合应用。白燕等[18]也认为对于重症、危及生命的IFI感染,当一种抗真菌药物不能有效控制病情应更换高一层次的抗真菌药或联合用药。
综上所述,儿童急性淋巴细胞白血病诱导缓解期常见的感染是肺部感染和/或败血症,最常见的病原菌是G-菌。初始抗感染治疗推荐碳青霉烯类抗生素并适时联合万古霉素或抗真菌药能有效控制严重感染。
| [1] | Fisher BT, Sammons JS, Li Y, et al. Variation in risk of hospital-onset clostridium difficile infection across beta-lactam antibiotics in children with new-onset acute lymphoblastic leukemia[J]. J Pediatric Infect Dis Soc, 2014, 3 (4): 329–335. DOI:10.1093/jpids/piu008 |
| [2] | Badiei Z, Khalesi M, Alami MH, et al. Risk factors associated with life-threatening infections in children with febrile neutropenia:a data mining approach[J]. J Pediatr Hematol Oncol, 2011, 33 (1): e9–e12. DOI:10.1097/MPH.0b013e3181f6921a |
| [3] | 中华医学会儿科学分会血液学组, 《中华儿科杂志》编辑委员会. 儿童急性淋巴细胞白血病诊疗建议(第四次修订)[J]. 中华儿科杂志, 2014, 52 (9): 645–644. |
| [4] | Metkar SS, Froelich CJ. Human neutrophils lack granzyme A, granzyme B, and perforin[J]. Blood, 2004, 104 (3): 905–906. DOI:10.1182/blood-2004-03-0888 |
| [5] | Khurana M, Lee B, Feusner JH. Fever at diagnosis of pediatric acute lymphoblastic leukemia:are antibiotics really necessary[J]. J Pediatr Hematol Oncol, 2015, 37 (7): 498–501. DOI:10.1097/MPH.0000000000000417 |
| [6] | O'Connor D, Bate J, Wade R, et al. Infection-related mortality in children with acute lymphoblastic leukemia:an analysis of infectious deaths on UKALL2003[J]. Blood, 2014, 124 (7): 1056–1061. DOI:10.1182/blood-2014-03-560847 |
| [7] | Ma X, Urayama K, Chang J, et al. Infection and pediatric acute lymphoblastic leukemia[J]. Blood Cells Mol Dis, 2009, 42 (2): 117–120. DOI:10.1016/j.bcmd.2008.10.006 |
| [8] | Li SD, Chen YB, Li ZG, et al. Infections during induction therapy of protocol CCLG-2008 in childhood acute lymphoblastic leukemia:a single-center experience with 256 cases in China[J]. Chin Med J (Engl), 2015, 128 (4): 472–476. DOI:10.4103/0366-6999.151085 |
| [9] | Afzal S, Ethier MC, Dupuis LL, et al. Risk factors for infectionrelated outcomes during induction therapy for childhood acute lymphoblastic leukemia[J]. Pediatr Infect Dis J, 2009, 28 (12): 1064–1068. DOI:10.1097/INF.0b013e3181aa6eae |
| [10] | Ammann RA, Bodmer N, Hirt A, et al. Predicting adverse events in children with fever and chemotherapy-induced neutropenia:the prospective multicenter SPOG 2003 FN Study[J]. J Clin Oncol, 2010, 28 (12): 2008–2014. DOI:10.1200/JCO.2009.25.8988 |
| [11] | 陈晓娟, 邹尧, 杨文钰, 等. CCLG-ALL2008方案治疗儿童急性淋巴细胞白血病复发患儿的特征分析[J]. 中国当代儿科杂志, 2015, 17 (4): 321–326. |
| [12] | Hatzistilianou M, Rekliti A, Athanassiadou F, et al. Procalcitonin as an early marker of bacterial infection in neutropenic febrile children with acute lymphoblastic leukemia[J]. Inflamm Res, 2010, 59 (5): 339–347. DOI:10.1007/s00011-009-0100-0 |
| [13] | Christ-Crain M, Jaccard-Stolz D, Bingisser R, et al. Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections:cluster-randomised, singleblinded intervention trial[J]. Lancet, 2004, 363 (9409): 600–607. DOI:10.1016/S0140-6736(04)15591-8 |
| [14] | 史柳红, 杨燕文, 钱娟, 等. 血液系统恶性肿瘤合并脓毒症患儿的临床特点及死亡因素分析[J]. 临床儿科杂志, 2012, 30 (1): 10–14. |
| [15] | Bothra M, Seth R, Kapil A, et al. Evaluation of predictors of adverse outcome in febrile neutropenic episodes in pediatric oncology patients[J]. Indian J Pediatr, 2013, 80 (4): 297–302. DOI:10.1007/s12098-012-0925-3 |
| [16] | Pokala HR, Leonard D, Cox J, et al. Association of hospital construction with the development of healthcare associated environmental mold infections (HAEMI) in pediatric patients with leukemia[J]. Pediatr Blood Cancer, 2014, 61 (2): 276–280. DOI:10.1002/pbc.24685 |
| [17] | 金玲, 张永红. 粒细胞减少伴发热患者的抗感染治疗[J]. 临床药物治疗杂志, 2011, 9 (1): 12–15. |
| [18] | 白燕, 金润铭, 张志泉, 等. 恶性血液病患儿肺部真菌感染的诊疗体会[J]. 中国小儿血液与肿瘤杂志, 2007, 12 (05): 220–222. |
 2017, Vol. 19
2017, Vol. 19