2. 浙江大学医学院附属儿童医院 呼吸科, 浙江 杭州 310003
巨噬细胞活化综合症(macrophage activation syndrome, MAS)是一种继发于风湿性疾病的具有潜在致命风险的并发症[1],死亡率可高达20%~60%[2-3]。最常并发于全身型幼年特发性关节炎(systemic juvenile idiopathic arthritis, SJIA)或成人Still病[4],其次见于川崎病(Kawasaki disease, KD)和系统性红斑狼疮(systemic lupus erythematosus, SLE)[5-6]。SJIA-MAS发生率约10%,SJIA合并亚临床MAS的发生率为30%~40%[7-8]。MAS的主要临床特征包括发热、全血细胞减少、肝脾淋巴结肿大、肝功能损害、凝血功能障碍和中枢神经系统损害,以及骨髓噬血现象等[9-12]。
MAS进展迅速,死亡率高。但近期研究也表明,如果MAS能及时诊断并给予恰当的治疗,死亡率可降至8%左右[13-14]。因此,MAS的早期诊断非常重要。但是,MAS临床异质性较大,缺乏特异性的临床和实验室指标,至今尚无敏感和特异性的诊断标准,早期诊断非常困难。
本研究回顾性分析21例MAS患儿诊断初期的临床和实验室特征,探索能够早期识别MAS的临床和实验室特征;并总结MAS患儿的治疗和转归,以寻找MAS有效的诊治手段。
1 资料与方法 1.1 研究对象将2010年1月至2016年6月浙江大学医学院附属儿童医院诊断的21例4个月至14岁(中位年龄7.05岁)的MAS患儿纳入研究,其中SJIA-MAS 14例,KD-MAS 5例,结缔组织病(connective tissue diseases, CTD)合并MAS 2例。SJI-MAS和KD-MAS的诊断参照2005年Ravelli版SJIA-MAS诊断标准[15],CTD-MAS的诊断参照2009年Parodi版SLE-MAS诊断标准[6]。MAS治疗参照《儿童风湿病诊断及治疗专家共识(一)》[16]和2004年噬血细胞综合征治疗方案[17]。
1.2 资料收集收集21例MAS患儿的临床资料,总结其临床、实验室特征,以及治疗和转归。
1.3 统计学分析采用SPSS l3.0软件进行数据处理。非正态分布的计量资料以中位数(范围)表示,计数资料以百分率表示。统计学比较采用二项式检验以及Kruskal-Wallis检验。P < 0.05为差异有统计学意义。
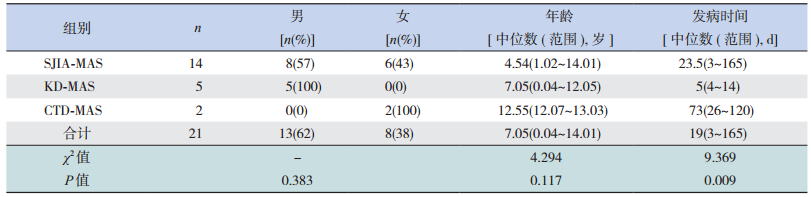
2 结果 2.1 MAS患儿的一般资料2010年1月至2016年6月期间,诊断为MAS的21例,其中SJIA-MAS 14例,KD-MAS 5例,CTD-MAS 2例(包括混合性结缔组织病合并MAS 1例,未分化结缔组织病合并MAS 1例);男13例、女8例,男女所占比例的差异无统计学意义(P=0.383)。SJIA-MAS 14例,男8例、女6例,男女所占比例的差异无统计学意义(P=0.791);5例KD-MAS均为男性;2例CTD-MAS均为女性。21例MAS患儿的中位年龄7.05岁,最小4个月、最大14岁;SJIA-MAS、KD-MAS、CTD-MAS 3组间的年龄差异无统计学意义(χ2=4.294, P=0.117)。21例MAS发生的时间为病程的3~165 d,中位时间19 d,3组间以KD-MAS发生最快、CTD-MAS发生最晚(χ2=9.369, P=0.009)。见表 1。
| 表 1 MAS患儿的一般资料 |
2.2 MAS患儿的临床特征
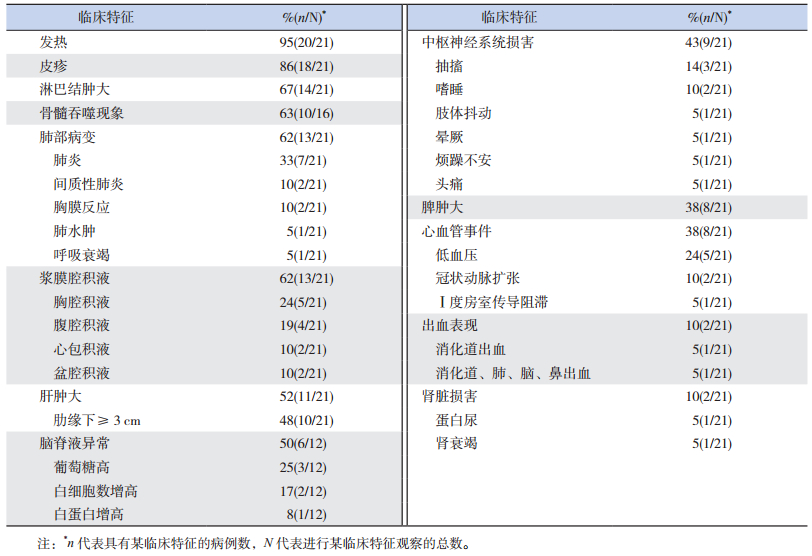
21例MAS患儿临床特征见表 2。以发热的发生率最高(95%),仅1例SJIA-MAS无发热;其次是皮疹(86%),常伴随发热发生;淋巴结肿大见于67%的MAS患儿。21例中有16例行骨髓细胞学检查,其中10例(63%)可见吞噬现象。肺部病变发生率为62%(13/21),其中7例为肺炎、2例间质性肺炎、2例胸膜反应,肺水肿和呼吸衰竭各1例。浆膜腔积液在MAS中也较常见,发生率为62%(13/21),胸腔、腹腔、心包和盆腔积液分别有5例、4例、2例和2例。肝肿大见于11例(52%)MAS病人,其中10例肝脏在肋缘下≥3 cm。21例MAS病人,12例行脑脊液检查,6例(50%)异常,其中葡萄糖升高者3例、白细胞数升高者2例、微量白蛋白升高者1例。9例(43%)MAS患儿出现中枢神经系统损害,表现为抽搐者3例,嗜睡2例,肢体抖动、晕厥、烦躁不安、头痛各1例。脾肿大见于8例MAS病人,发生率38%。发生心血管事件的8例(38%)患儿表现为低血压(5例),冠状动脉扩张(2例),Ⅰ度房室传导阻滞(1例)。有出血表现者2例(10%),其中1例仅有消化道出血,另外1例表现为消化道、肺、脑、鼻腔多脏器出血。肾脏损害2例(10%),1例表现为蛋白尿、1例发生了肾功能衰竭。
| 表 2 21例MAS患儿的临床特征分析 |
2.3 MAS患儿的实验室特征
21例MAS患儿的白细胞中位数7.04×109/L(1.93~39.56×109/L),降低者仅4例(19%);血红蛋白中位数为103 g/L(79~121 g/L),15例(71%)低于110 g/L;血小板中位数为136×109/L(24~361×109/L),降低者8例(38%)。血钠中位数为136 mmol/L(127~142 mmol/L),8例(38%)低于正常值。CRP中位数为37 mg/L(5~180 mg/L),其中17例(81%)增高。血沉中位数为33 mm/h(2~121 mm/h),14例(67%)增高。95%的MAS患儿谷丙转氨酶、谷草转氨酶增高,100%的MAS患儿乳酸脱氢酶明显升高,中位数分别为150 U/L(26~1 057 U/L)、182 U/L(46~1 092 U/L)和930 U/L(373~7 843 U/L)。总蛋白、白蛋白和球蛋白中位数分别为60.5 g/L(37.9~80.2 g/L)、32.3 g/L(16.2~36.4 g/L)和28.2 g/L(14.2~47 g/L),降低者分别为7例(33%)、8例(38%)和1例(5%)。总胆红素、直接胆红素和间接胆红素中位数分别为10.9 μmol/L(2~63 μmol/L)、4.8 μmol/L(0.3~37.3 μmol/L)和5.4 μmol/L(0.2~26 μmol/L),升高者分别为4例(19%)、9例(43%)和1例(5%)。甘油三酯中位数为2.65 mmol/L(0.85~13.97 mmol/L),14例(67%)升高。血清铁蛋白中位数为1 500 ng/mL(256~1 650 ng/mL),95%的明显升高。
21例MAS患儿的IL-6中位数为47.2 pg/mL(5.7~1 039.2 pg/mL),其中15例(71%)增高;IL-10和IFN-γ中位数分别为19.8 pg/mL(3.5~352.0 pg/mL)和40.9 pg/mL(4.3~1 110.1 pg/mL),18例(86%)患儿的IL-10、16例(76%)的IFN-γ明显升高;IL-4中位数为3.0 pg/mL(0.7~12.8 pg/mL),10例(48%)升高;仅2例(10%)TNF-α升高。
21例MAS患儿的纤维蛋白原中位数为1.71 g/L(0.76~4.47 g/L),其中11例(52%)降低;D-二聚体中位数为2.32 mg/L(0.06~20.52 mg/L),其中15例(71%)明显升高。
2.4 治疗和转归21例中除2例治疗方案不详(外院治疗),其余采用如下治疗:地塞米松(每日10 mg/kg)或大剂量甲基强的松龙(每日10~30 mg/kg)静脉滴注+丙种球蛋白冲击治疗(2 g/kg)+环孢霉素A。其中1例SJIA-MAS患儿存在心、肺、肾、中枢神经系统和凝血功能等多脏器损害,同时给予依托泊苷和血液净化治疗;2例SJIA-MAS病人分别给予生物制剂英夫利昔单抗和托珠单抗治疗。19例患儿中1例SJIA-MAS合并EB病毒感染,家长放弃治疗出院、失访;余18例患儿均体温、血常规恢复正常,肝功能、凝血功能好转出院。2例外院治疗的MAS患儿电话随访,均好转出院。
3 讨论儿童MAS最常并发于SJIA,也常见于KD,而CTD-MAS鲜有报道[1, 5]。本研究结果与之相符:21例MAS患儿中14例为SJIA-MAS,5例为KD-MAS,2例CTD-MAS。本研究还发现,SJIA和CTD合并MAS距原发病起病的时间较长,分别为23.5 d和19 d;而KD合并MAS多于起病5 d左右,提示KD起病早期即可合并MAS,甚至可直接以MAS起病。
SJIA、KD和CTD均为多系统损害的发热性疾病,合并MAS的临床表现往往与原发病活动难以区分。发热、皮疹,以及肝、脾、淋巴结肿大和肺部病变、浆膜腔积液均为MAS常见临床特征,以发热最常见[9-12, 18]。本研究发热的发生率为95%,皮疹发生率达86%,肝、脾、淋巴结肿大的发生率分别为67%、52%和38%,肺部病变和浆膜腔积液的发生率均为62%,与文献报道相符。根据MAS诊断标准,要求肝脏肋缘下≥3 cm,本研究有10例病人(48%)符合此标准。有研究表明[19],MAS早期骨髓吞噬现象常常阴性,而本研究骨髓吞噬现象阳性率达到63%,可能与对于这类疾病合并MAS的警惕性较高,及早予以骨髓细胞学检查有关。本研究中枢神经系统损害发生率为43%,其中12例行脑脊液检查,异常者6例(50%),主要表现为葡萄糖、白细胞数和白蛋白的升高,需进一步扩大样本以总结具有中枢神经系统损害的MAS患儿脑脊液特点。
血三系减少是MAS的主要实验室特征[20]。SJIA-MAS的诊断标准中白细胞计数 < 4.0×109/L、血小板 < 262×109/L,而本研究19例MAS患儿白细胞计数符合诊断标准的只有3例,血小板计数符合标准的17例,说明白细胞计数可能并非诊断MAS的敏感指标。
血清铁蛋白升高、肝功能损害和凝血功能异常均为MAS的特征性实验室表现[19-20]。本研究95%的病人存在血清铁蛋白升高和肝功能损害,所有患儿的乳酸脱氢酶显著升高,67%的甘油三酯升高,52%存在低纤维蛋白血症。
MAS的病理生理机制为T细胞和巨噬细胞活化导致大量前炎症因子风暴,其中IFN-γ、IL-1β、IL-18和IL-6等细胞因子起主要作用[21-23]。本研究也证实了这一点,IL-6、IL-10和IFN-γ升高的概率分别为71%、86%和76%。本研究团队既往研究表明[24],SJIA患儿的IL-6水平升高,而IL-10和IFN-γ无升高。提示,如果SJIA患儿在IL-6持续升高的基础上出现IL-10和IFN-γ明显升高,需要警惕MAS发生。
MAS的治疗多采用大剂量甲基强的松龙、丙种球蛋白冲击并联合环孢素A的方案[16]。因为MAS与噬血细胞综合征的相似性,也可采用类似治疗方案[17]。关于生物制剂在MAS的治疗作用既有研究认为有效,也有研究认为它可诱发MAS[21, 25]。
综上所述,风湿性疾病患儿如在积极治疗过程中出现持续发热,肝功能损害,凝血功能异常,甚至多脏器损害,以及IL-10和IFN-γ明显升高,血清铁蛋白持续升高,需要高度警惕MAS发生。
| [1] | Ravelli A, Davì S, Minoia F, et al. Macrophage activation syndrome[J]. Hematol Oncol Clin North Am, 2015, 29 (5): 927–941. DOI:10.1016/j.hoc.2015.06.010 |
| [2] | Stéphan JL, Koné-Paut I, Galambrun C, et al. Reactive haemophagocytic syndrome in children with inflammatory disorders. A retrospective study of 24 patients[J]. Rheumatology (Oxford), 2001, 40 (11): 1285–1292. DOI:10.1093/rheumatology/40.11.1285 |
| [3] | SawhneyS, Woo P, Murray KJ. Macrophage activation syndrome:a potentially fatal complication of rheumatic disorders[J]. Arch Dis Child, 2001, 85 (5): 421–426. DOI:10.1136/adc.85.5.421 |
| [4] | 张霞, 姚海红, 贾园, 等. 成人斯蒂尔病继发巨噬细胞活化综合征一例[J]. 中华风湿病学杂志, 2012, 16 (7): 499–500. |
| [5] | Wang W, Gong F, Zhu W, et al. Macrophage activation syndrome in Kawasaki disease:more common than we thought[J]. Semin Arthritis Rheum, 2015, 44 (4): 405–410. DOI:10.1016/j.semarthrit.2014.07.007 |
| [6] | Parodi A, Davì S, Pringe AB, et al. Macrophage activation syndrome in juvenile systemic lupus erythematosus:a multinational multicenter study of thirty-eight patients[J]. Arthritis Rheum, 2009, 60 (11): 3388–3399. DOI:10.1002/art.24883 |
| [7] | Behrens EM, Beukelman T, Paessler M, et al. Occult macrophage activation syndrome in patients with systemic juvenile idiopathic arthritis[J]. J Rheumatol, 2007, 34 (5): 1133–1138. |
| [8] | Bleesing J, Prada A, Siegel DM, et al. The diagnostic significance of soluble CD163 and soluble interleukin-2 receptor α-chain in macrophage activation syndrome and untreated newonset systemic juvenile idiopathic arthritis[J]. Arthritis Rheum, 2007, 56 (3): 965–971. DOI:10.1002/(ISSN)1529-0131 |
| [9] | Minoia F, Davì S, Horne A, et al. Clinical features, treatment, and outcome of macrophage activation syndromecomplicating systemic juvenile idiopathic arthritis:a multinational, multicenter study of 362 patients[J]. Arthritis Rheumatol, 2014, 66 (11): 3160–3169. DOI:10.1002/art.38802 |
| [10] | Kostik MM, Dubko MF, Masalova VV, et al. Identification of the best cutoff points and clinical signs specific for early recognition of macrophage activation syndrome in active systemic juvenile idiopathic arthritis[J]. Semin Arthritis Rheum, 2015, 44 (4): 417–422. DOI:10.1016/j.semarthrit.2014.09.004 |
| [11] | 李彩凤, 何晓琥. 风湿性疾病的一种严重并发症-巨噬细胞活化综合征[J]. 中华儿科杂志, 2006, 44 (11): 824–827. |
| [12] | 马慧慧, 钱小青, 俞海国, 等. 儿童巨噬细胞活化综合征23例临床分析[J]. 东南大学学报(医学版), 2012, 31 (6): 736–738. |
| [13] | Minoia F, Davì S, Horne A, et al. Clinical features, treatment, and outcome of macrophage activation syndrome complicating systemic juvenile idiopathic arthritis:a multinational, multicenter study of 362 patients[J]. Arthritis Rheumatol, 2014, 66 (11): 3160–3169. DOI:10.1002/art.38802 |
| [14] | Minoia F, Davì S, Horne A, et al. Dissecting the heterogeneity of macrophage activation syndrome complicating systemic juvenile idiopathic arthritis[J]. J Rheumatol, 2015, 42 (6): 994–1001. DOI:10.3899/jrheum.141261 |
| [15] | Ravelli A, Magni-Manzoni S, Pistorio A, et al. Preliminary diagnostic guidelines for macrophage activation syndrome complicating systemic juvenile idiopathic arthritis[J]. J Pediatr, 2005, 146 (5): 598–604. DOI:10.1016/j.jpeds.2004.12.016 |
| [16] | 全国儿童风湿协作组. 儿童风湿病诊断及治疗专家共识(一)[J]. 临床儿科杂志, 2010, 28 (10): 984–991. |
| [17] | Henter JI, Horne A, Aricó M, et al. HLH-2004:Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2007, 48 (2): 124–131. DOI:10.1002/(ISSN)1545-5017 |
| [18] | Cron RQ, Davi S, Minoia F, et al. Clinical features and correct diagnosis of macrophage activation syndrome[J]. Expert Rev Clin Immunol, 2015, 11 (9): 1043–1053. DOI:10.1586/1744666X.2015.1058159 |
| [19] | Ravelli A, Minoia F, Davì S, et al. 2016 Classification criteria for macrophage activation syndrome complicating systemic juvenile idiopathic arthritis:A European League Against Rheumatism/American College of Rheumatology/Paediatric Rheumatology International Trials Organisation Collaborative Initiative[J]. Ann Rheum Dis, 2016, 75 (3): 481–489. DOI:10.1136/annrheumdis-2015-208982 |
| [20] | Assari R, Ziaee V, Mirmohammadsadeghi A, et al. Dynamic changes, cut-off points, sensitivity, and specificity of laboratory data to differentiate macrophage activation syndrome from active disease[J]. Dis Markers, 2015, 2015 : 424381. |
| [21] | Schulert GS, Grom AA. Pathogenesis of macrophage activation syndrome and potential for cytokine-directed therapies[J]. Annu Rev Med, 2015, 66 : 145–159. DOI:10.1146/annurev-med-061813-012806 |
| [22] | Ravelli A, Grom AA, Behrens EM, et al. Macrophage activation syndrome as part of systemic juvenile idiopathic arthritis: diagnosis, genetics, pathophysiology and treatment[J]. Genes Immun, 2012, 13 (4): 289–298. DOI:10.1038/gene.2012.3 |
| [23] | Grom AA, Mellins ED. Macrophage activation syndrome: advances towards understanding pathogenesis[J]. Curr Opin Rheumatol, 2010, 22 (5): 561–566. DOI:10.1097/01.bor.0000381996.69261.71 |
| [24] | 郭莉, 卢美萍, 汤永民, 等. 新发活动期全身型幼年特发性关节炎血清细胞因子水平分析[J]. 中国当代儿科杂志, 2014, 16 (12): 1241–1244. |
| [25] | Yokota S, Itoh Y, Morio T, et al. Macrophage activation syndrome in patients with systemic juvenile idiopathic arthritis under treatment with Tocilizumab[J]. J Rheumatol, 2015, 42 (4): 712–722. DOI:10.3899/jrheum.140288 |
 2017, Vol. 19
2017, Vol. 19