2. 郑州市儿童急危重症疾病实验室, 河南 郑州 450003
患儿,女,6月龄,因尿量减少1 d,发现肾功能异常10 h入院。患儿入院前1 d出现发热,最高体温38.0℃,伴尿量减少,不伴皮疹、抽搐、意识障碍,以及流涕、咳嗽、喘息、呕吐、腹胀、腹泻等。入院前10 h在当地医院查肾功能示血尿素氮30.2 mmol/L,血肌酐225.0 µmol/L。起病以来,精神反应差,饮食、睡眠欠佳,大便每日3~4次。患儿既往无特殊。系第3胎第3产,足月顺产,出生体重3.5 kg。生长发育史正常。患儿父母体健,非近亲结婚,家族中无听觉异常病史。患儿大姐因无尿、肾功能衰竭于6月龄死亡;二姐现2岁,体健,无类似病史。
入院查体:T 38.2℃,P 125次/min,R 42次/min,BP 96/55 mm Hg,体重8.5 kg。发育正常,营养中等,神清,精神反应差,全身皮肤无黄染,未见皮疹及出血点,面部及眼睑轻度浮肿,口唇无苍白及发绀,口腔黏膜光滑,咽充血,颈软,双肺呼吸音粗、可闻及少量痰鸣音,心前区无隆起,心音有力,心率125次/min,律齐,心前区未闻及杂音,腹软,未触及包块,肝右肋下约2.0 cm,质软,脾肋下未触及,移动性浊音阴性,未闻及血管杂音,肠鸣音3次/min,四肢末梢暖,双下肢轻度非凹陷性浮肿。足背动脉搏动有力。双侧巴氏征、克氏征均阴性。辅助检查:血常规WBC、PLT计数正常,中性粒细胞比例增高(67.8%)、淋巴细胞比例降低(28.8%),Hb 104 g/L;粪常规未见异常;尿常规:WBC 14/µL,RBC 81/µL,蛋白(++)、尿微量白蛋白 > 0.15 g/L(正常:阴性),尿胆原(-),酮体(-),尿比重正常、pH值5.5;血气分析:pH 7.095,PaCO2 12.0 mm Hg(正常值35~45 mm Hg),PaO2正常,HCO3- 3.5 mmol/L(正常值21~26 mmol/L),BE -24.8 mmol/L(正常值-3~3 mmol/L),血乳酸正常;肝功能、心肌酶正常;肾功能:尿素氮35.2 mmol/L(正常值1.7~7.1 mmol/L),肌酐898.0 µmol/L(正常值18~84 µmol/L),尿酸600 µmol/L(正常值134~506 µmol/L);24 h尿蛋白定量 < 3.5 g/d;血糖正常;血电解质:钾6.20 mmol/L(正常值3.5~5.5 mmol/L),钠129.0 mmol/L(正常值135~150 mmol/L),余项正常;Coombs实验阴性;血脂三项正常;G实验阴性;ESR、CRP正常;PCT 1.38 ng/mL(正常值 < 0.05 ng/mL);乙肝五项抗体均阴性;甲肝、丙肝、梅毒、HIV抗体均阴性;C3 0.7 g/L(正常值0.8~2.1 g/L)。腹部彩超:肝脏体积增大,实质回声稍细密,肝内管系显示清晰;双肾体积大,实质回声增强,皮髓质分界不清;CDFI:双肾内血流信号未见明显异常。
2 诊断思维本患儿临床特点主要为婴儿期起病,急性病程,以少尿、无尿、急性肾功能衰竭、代谢性酸中毒等为主要表现,发病前无肾毒性药物应用,无血容量不足及尿路结石、尿道畸形等导致肾功能衰竭的肾前性、肾后性因素;无严重感染、创伤等应激因素。患儿急性肾功能衰竭原因不明,结合其胞姐6月龄死于急性肾功能衰竭的家族史,需要考虑家族遗传性肾病或遗传代谢性疾病导致肾功能衰竭的可能,如Alport综合征、Fabry病、薄基底膜肾病、先天性肾病综合征、甲髌综合征等。
Alport综合征是最常见的遗传性肾病,其发病与基底膜Ⅳ型胶原缺陷有关,临床主要表现为血尿、听力障碍、眼部病变和进行性肾功能减退等。遗传方式主要为X连锁显性遗传(约占85%),常伴有血尿等家族史。进一步完善患儿父母泌尿系彩超、尿常规、肾功能等检查有助于了解家族史;如果患儿脑干听觉诱发电位或眼底检查发现感音性耳聋、眼部异常如圆锥形晶状体、眼底黄斑周围点状视网膜病变等,有助于诊断;基因筛查COL4A5突变有助于确诊。Fabry病是一种临床罕见的遗传性代谢缺陷病,主要由溶酶体中α半乳糖苷酶缺乏引起,临床以特征性皮肤改变(血管胶质瘤)、感觉异常及肾功能衰竭为主要表现,通常儿童期起病,逐渐发展为慢性肾衰竭,女性患者的Fabry病临床表现可能变异较大。因此,对于不明原因蛋白尿及进行性肾功能减退者,应考虑Fabry病可能,α-GalA活性测定、GLA基因检测及肾活检有助于诊断。薄基底膜肾病通常有血尿家族史,主要表现为持续性或反复性血尿,预后良好,但本例起病急,短期进展为急性肾衰竭,与该病不符。本例患儿24 h尿蛋白定量 < 3.5 g/d,血白蛋白33.0 g/L,血脂正常,不支持先天性肾病综合征。甲髌综合征常伴有家族史,表现为指甲发育不良、髌骨发育不良或不发育、不同程度肾功能受累等,该患儿指甲及髌骨正常,家族中无指甲及髌骨异常病史,不支持该病。
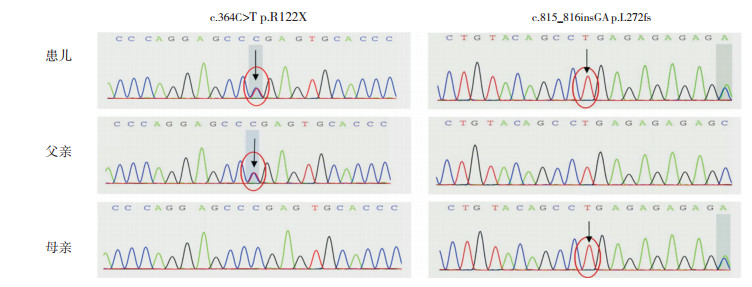
3 进一步检查综合诊断思维,完善患儿父母泌尿系彩超、尿常规、肾功能等检查,均无异常;患儿脑干听觉诱发电位、眼底检查无异常;患儿父母眼底检查也无异常。基因测序提示原发性高草酸尿症(primary hyperoxaluria, PH)相关基因AGXT存在c.364C > T(p.R122X)和c.815_816insGA(p.L272fs)两处杂合突变;家系验证示其父携带c.364C > T(p.R122X)杂合突变,其母携带c.815_816insGA(p.L272fs)杂合突变,见图 1。
|
图 1 患儿及其父母基因测序结果 患儿AGXT基因存在c.364C > T(p.R122X)和c.815_816insGA(p.L272fs)两处杂合突变;其父携带c.364C > T突变,其母携带c.815_816insGA突变。突变部位如箭头所示。 |
4 确诊依据
结合患儿病史及基因测序结果,诊断为原发性高草酸尿症1型(PH1)。(1)婴儿期起急性起病,进展快;(2)表现为少尿、无尿、急性肾功能衰竭、代谢性酸中毒;(3)有急性肾功能衰竭家族史;(4)患儿PH1的相关基因AGXT存在c.364C > T和c.815_816insGA两处致病性突变,分别来源其父母,符合常染色体隐性遗传规律。
5 临床经过入院后予限制液体摄入、纠正酸中毒维持内环境稳定,抗感染对症治疗,以及床旁连续血液净化治疗8 h。入院第2日,尿量 < 20 mL/24 h,尿素氮6.1 mmol/L,肌酐110 µmol/L;入院后连续3 d尿量 < 10 mL/24 h,血肌酐6.1~23.2 mmol/L,血尿素氮110~317 mmol/L,予第2次连续血液净化治疗。患儿尿量仍 < 10 mL/24 h,入院第10天家长放弃治疗,出院1 d后死亡。
6 讨论PH1是一种临床罕见的常染色体隐性遗传病,主要是丙氨酸乙醛酸氨基转移酶(alanine-glyoxylate aminotransferase, AGT)的编码基因AGXT突变,引起肝脏特异性AGT功能缺失,导致体内草酸增加,草酸盐沉积在肾脏,表现为高草酸尿症、不同程度的肾功能损害和反复尿路结石[1-2]。PH主要分为PH1、PH2和PH3三种亚型[1-3]。PH1由AGXT基因突变导致维生素B6依赖的肝脏特异AGT功能缺失或异常,PH2由GRHPR基因突变导致乙醛酸/羟基丙酮酸还原酶(GR/HPR)功能缺失,PH3由HOGAl基因突变导致线粒体4-羟基-2-酮戊二酸醛缩酶(HOGA)功能异常。PH的3种亚型以PH1最为常见,约占PH的80%。
1岁以内起病的PH1患儿,以代谢性酸中毒和急性肾功能衰竭为主要临床特征,起病急,病情凶险,死亡率高。PH1发病率和患病率尚无准确数据。有研究报道,欧洲及北美地区PH1的年发病率为0.1~0.2/100万,患病率为1~3/100万[3, 5]。近亲婚配较多的中东和北非地区,如科威特、阿拉伯、突尼斯等发病率为5.5/100万[3, 6-7]。欧洲、美国、日本资料显示,儿童终末期肾脏病(end stage renal disease, ESRD)的1%~2%是由PH1引起[3, 8]。而中国尚无PH1患病率及发病率的报道。另外,该疾病属于常染色体隐性遗传,母亲每次妊娠其孩子均有25%的患病风险及50%的携带者可能,可以通过产前基因筛查进行诊断预防。
PH1可发生于任何年龄人群,通常在1~25岁之间。PH1临床表现差异很大,有的无任何临床症状,有的表现为血尿、腹痛,有的就诊时已进展为ESRD。PH1主要临床特征为高草酸尿症、反复尿路结石、肾钙质沉积症,多数伴有阳性家族史[1, 6, 10]。李国民等报道1例PH1,3岁女童,表现为肉眼血尿、反复多发结石(单水草酸钙),7年内进展为终末期肾病。部分PH1早期无明显临床症状,仅尿草酸盐排出增加,随着疾病进展,血草酸水平逐渐增高、草酸盐沉积在肾脏形成结石,引起肾功能损害,导致进行性的肾功能恶化,也有10%的PH1患者直接进展为终末期肾病[2, 6]。婴儿期发病的PH1常缺乏典型的临床症状,诊断时往往已进展为ERSD,预后较差。Jellouli等对14例(中位年龄2个月)婴儿期起病的PH1患儿进行回顾性分析,发现婴儿期发病的PH1起病急,迅速进展,短期内进展为ESRD,死亡率高。
PH1临床极为罕见,早期诊断较为困难。反复发作的肾结石,且结石成分为草酸成分;或者肾功能显著异常伴肾结石或钙质沉着等;或者相关家族史均为诊断的重要线索。PH1诊断主要依据[11-16]:(1)尿草酸浓度 > 1 mmol/(L·1.73 m2)[正常值 < 0.45 mmol/(L·1.73 m2)];(2)PH1患者早期血草酸水平可正常,当GFR低于30~45/(min·1.73 m2),血草酸浓度开始增高,血草酸浓度 > 50 μmoL/L的应考虑PH1可能;(3)PH1患者的结石95%为草酸钙,此为PH1的特征性改变,对本病诊断价值较高;(4)AGXT外显子及其剪切区测序是诊断PH1的重要方法,约80%的PH1患者可发现AGXT基因突变,如发现致病性纯合或复合杂合突变就可以确诊PH1;(5)肝活检是PH1诊断的金标准,对诊断困难者或具有典型的PH临床表现而基因检测未发现异常的,可肝活检测定AGT活性及AGXT基因mRNA表达,如AGT活性及AGXT基因mRNA表达较低,可诊断本病。
自1990年AGXT基因的cDNA首次被克隆,不断有PH1的临床研究和病例报道。AGXT基因位于常染色体2q37.3,含有11个外显子,均可发生突变,目前至少已有178个致病性突变被发现,其中c.508G > A、c.731T > C、c.454T > A和c.33_34insC是PH1的4个最常见致病性突变,突变类型主要包括无义突变、错义突变、移码突变和剪切突变[15, 17-18]。本例患儿AGXT基因共有两处突变,其中c.364C > T位点突变为已知的致病突变,可导致AGT的cDNA第122位精氨酸发生编码终止(p.R122X)。另一突变位点AGXT基因8号外显子cDNA第815位的胸腺嘧啶核苷,c.815_816insGA导致AGXT基因第272位亮氨酸发生移码改变(p.L272fs)。有报道显示c.815T > C(p.L272P)为致病突变。本例患儿在此位点发生的基因突变(c.815_816insGA)导致AGXT基因第272位亮氨酸发生移码改变,即框移突变。通常DNA分子的插入或缺失突变导致蛋白质读码框的改变,所造成的DNA损伤较点突变更为严重,故本例患儿AGXT基因c.815位点发生的移码突变(c.815_816insGA)可能为致病性突变。本例患儿发生的两处突变分别为终止突变和移码突变,对AGT的功能影响较为严重,故于婴儿期起病,临床症状以急性肾功能衰竭为主要表现。
PH1的治疗以支持保护性治疗为主,包括减少草酸钙过饱和、减少草酸盐形成两大方面。(1)对于无明显尿量减少、肾功能正常或轻度异常的患者,主张大量饮水,可防止草酸钙过饱和以及结石形成。(2)补充维生素B6。PH1主要是AGT缺乏所致,AGT是磷酸吡哆醛依赖酶,补充维生素B6可以减少尿草酸量。维生素B6对于部分基因敏感型的PH1患者(如C.G170A、C.P152I、C.I244T等)治疗效果较好,可显著减少尿草酸量[5, 12, 20]。(3)补充钙剂。钙摄入不足可能增加肠道对草酸的吸收,PH1患者服用钙剂可结合肠道内草酸,明显降低尿草酸钙。(4)碱化尿液。维持尿pH值在6.2~6.8,有助于增加草酸钙的溶解饱和度,减轻草酸钙沉着,抑制结石形成[5-6]。(5)限制富含草酸食物的摄入,如菠菜、木耳、草莓、咖啡、浓茶、巧克力等。(6)透析疗法。维持性血液透析或腹膜透析对体内过多的草酸清除有一定的帮助[5, 12]。(7)器官移植。肝脏特异性AGT缺陷引起草酸钙沉积在肾脏,导致进行性的肾功能损害,因此血液透析或腹膜透析均不能有效清除体内过高浓度的草酸时,应考虑器官移植。而单独肾移植的PH1患者有较高的复发风险,所以肝肾联合移植是理想选择[12, 21-23]。婴幼儿或年龄较小的PH1患儿,不能耐受肝肾同时移植的手术打击,可行肝肾先后移植(先行肝移植,后行肾移植)的序贯手术方案。
7 结语PH1是一种临床罕见疾病。对反复发作的肾结石,且结石成分为草酸;或肾功能显著异常伴肾结石,或钙质沉着;有家族史等的患者要高度考虑PH1。基因诊断为确诊本病的主要手段。对于确诊病例,早期开始积极的支持对症治疗。如果肾功能显著异常且无多系统草酸沉积者,应该考虑肝肾联合移植治疗。婴幼儿期起病的PH1,尿路结石少见,以少尿、无尿、肾功能异常为主要特征,预后及治疗效果较差。
| [1] | Rumsby G, Cochat P. Primary hyperoxaluria[J]. N Engl J Med, 2013, 369 (22): 2163. DOI:10.1056/NEJMc1311602 |
| [2] | Cochat P, Fargue S, Bacchetta J, et al. Primary hyperoxaluria[J]. Nephrol Ther, 2011, 7 (4): 249–259. |
| [3] | Lieske JC, Monico CG, Holmes WS, et al. International registry for primary hyperoxaluria[J]. Am J Nephrol, 2005, 25 (3): 290–296. DOI:10.1159/000086360 |
| [4] | Jellouli M, Ferjani M, Abidi K, et al. Primary hyperoxaluria in infants[J]. Saudi J Kidney Dis Transpl, 2016, 27 (3): 526–532. DOI:10.4103/1319-2442.182389 |
| [5] | Ben-Shalom E, Frishberg Y. Primary hyperoxalurias:diagnosis and treatment[J]. Pediatr Nephrol, 2015, 30 (10): 1781–1791. DOI:10.1007/s00467-014-3030-1 |
| [6] | Sanjad SA, Al-Abbad A, Al-Sabban E. Primary hyperoxaluria type 1:An underestimated cause of nephrocalcinosis and chronic renal failure in Saudi Arabian children[J]. Ann Saudi Med, 1999, 19 (1): 4–7. |
| [7] | van der Hoeven SM, van Woerden CS, Groothoff JW. Primary hyperoxaluria type 1, a too often missed diagnosis and potentially treatable cause of end-stage renal disease in adults: results of the Dutch cohort[J]. Nephrol Dial Transplant, 2012, 27 (10): 3855–3862. DOI:10.1093/ndt/gfs320 |
| [8] | Chemli J, Abdennabi H, Zorgati M, et al. Primary hyperoxaluria in children in central Tunisia[J]. Tunis Med, 2007, 85 (6): 513–518. |
| [9] | 马志敏, 梁素华.染色体病[M]//梁素华.医学遗传学.北京:人民卫生出版社, 2006:79-91. |
| [10] | 李国民, 沈茜, 徐虹, 等. 儿童原发性1型高草酸尿症1例并文献复习[J]. 中国循证儿科杂志, 2013 (06): 453–457. |
| [11] | Chand AQ, Kaskel FJ. Pediatrics:Timely diagnosis of primary hyperoxaluria type 1[J]. Nat Rev Nephrol, 2009, 5 (12): 670–671. DOI:10.1038/nrneph.2009.186 |
| [12] | Cochat P, Hulton SA, Acquaviva C, et al. Primary hyperoxaluria Type 1:indications for screening and guidance for diagnosis and treatment[J]. Nephrol Dial Transplant, 2012, 27 (5): 1729–1736. DOI:10.1093/ndt/gfs078 |
| [13] | 周建华, 崔雯, 王韵琴. 儿童原发性高草酸尿症致双肾广泛结石、钙化和肾功能衰竭一例[J]. 中华肾脏病杂志, 2004, 20 (1): 46. |
| [14] | Williams EL, Acquaviva C, Amoroso A, et al. Primary hyperoxaluria type 1:update and additional mutation analysis of the AGXT gene[J]. Hum Mutat, 2009, 30 (6): 910–917. DOI:10.1002/humu.v30:6 |
| [15] | Benhaj Mbarek I, Abroug S, Omezzine A, et al. Selected AGXT gene mutations analysis provides a genetic diagnosis in 28% of Tunisian patients with primary hyperoxaluria[J]. BMC Nephrol, 2011, 12 : 25. DOI:10.1186/1471-2369-12-25 |
| [16] | Danpure CJ, Jennings PR, Watts RW. Enzymological diagnosis of primary hyperoxaluria type 1 by measurement of hepatic alanine:glyoxylate aminotransferase activity[J]. Lancet, 1987, 1 (8528): 289–291. |
| [17] | Edvardsson VO, Goldfarb DS, Lieske JC, et al. Hereditary causes of kidney stones and chronic kidney disease[J]. Pediatr Nephrol, 2013, 28 (10): 1923–1942. DOI:10.1007/s00467-012-2329-z |
| [18] | Rumsby G.Primary hyperoxaluria mutation database[DB/OL]. (2016-12-4).https://www.uclh.nhs.uk/OurServices/ServiceA-Z/PATH/PATHBIOMED/CBIO/Pages/Phmdatabase.aspx. |
| [19] | Hopp K, Cogal AG, Bergstralh EJ, et al. Phenotype-genotype correlations and estimated carrier frequencies of primary hyperoxaluria[J]. J Am Soc Nephrol, 2015, 26 (10): 2559–2570. DOI:10.1681/ASN.2014070698 |
| [20] | Hoyer-Kuhn H, Kohbrok S, Volland R, et al. Vitamin B6 in primary hyperoxaluria Ⅰ:first prospective trial after 40 years of practice[J]. Clin J Am Soc Nephrol, 2014, 9 (3): 468–477. DOI:10.2215/CJN.06820613 |
| [21] | Naderi G, Tabassomi F, Latif A, et al. The first experience of sequential liver-kidney transplantation for the treatment of primary hyperoxaluria type-1 in Iran as a developing country[J]. Saudi J Kidney Dis Transpl, 2016, 27 (4): 791–794. DOI:10.4103/1319-2442.185262 |
| [22] | Narasimhan G, Govil S, Rajalingam R, et al. Preserving double equipoise in living donor liver-kidney transplantation for primary hyperoxaluria type 1[J]. Liver Transpl, 2015, 21 (10): 1324–1326. DOI:10.1002/lt.v21.10 |
| [23] | Lorenz EC, Lieske JC, Seide BM, et al. Sustained pyridoxine response in primary hyperoxaluria type 1 recipients of kidney alone transplant[J]. Am J Transplant, 2014, 14 (6): 1433–1438. DOI:10.1111/ajt.12706 |
| [24] | Mor E, Nesher E, Ben-Ari Z, et al. Sequential liver and kidney transplantation from a single living donor in two young adults with primary hyperoxaluria type 1[J]. Liver Transpl, 2013, 19 (6): 646–648. DOI:10.1002/lt.v19.6 |
 2017, Vol. 19
2017, Vol. 19


