2. 石河子大学医学院, 新疆 石河子 832000
新生儿持续性肺动脉高压(persistent pulmonary hypertension of the newborn, PPHN)是新生儿出生后肺血管阻力持续性增高,肺动脉压超过体循环动脉压,使由胎儿型循环过渡至正常“成人”型循环发生障碍而引起的心房和/或动脉导管水平血液的右向左分流,临床上出现严重低氧血症等症状[1]。PPHN是在多种因素作用下的临床综合征,常见于早产儿及过期产儿,与其他类型的肺动脉高压差异很大[2]。虽然PPHN并不多见,但其病死率较高,达4%~33%不等[3]。钙敏感受体(calcium-sensing receptor, CaSR)作为G蛋白偶联的膜受体能够感受细胞外Ca2+浓度变化,并通过多种信号途径包括[Ca2+]i和细胞外调节蛋白激酶将信号传递到细胞内,导致细胞内Ca2+浓度的升高,从而促进细胞增殖,导致血管构型重建。本课题前期研究已证实在新生大鼠持续性肺动脉高压(PPH)模型中CaSR的表达增加[4]。本研究观察CaSR激动剂和抑制剂对PPH的影响,进一步明确CaSR在PPH中的作用,及通过激动剂和抑制剂的干预来促进和纠正PPH发生发展产生的效应,为PPHN的临床治疗提供新思路。
1 材料与方法 1.1 主要试剂与仪器小鼠抗大鼠单克隆CaSR抗体(美国Abcam公司),CaSR激动剂氯化钆(GdCl3,美国Sigma公司),CaSR抑制剂NPS2390(德国R & D公司),兔单克隆α-SMA抗体(美国Abcam公司),兔抗小鼠单克隆CaSR抗体、FITC标记山羊抗兔抗体(北京中杉金桥公司,106103),Propidium Iodide(美国Sigma公司,SLBD2912V),CaSR反转录试剂盒、CaSR荧光定量试剂盒(美国Fermentas公司),TRIzol(美国Invitrogen公司)。引物由上海生工生物工程公司合成。
主要仪器包括低温台式离心机(美国Thermo-scientific公司),荧光定量PCR仪(美国Bio-Rad公司),激光共聚焦显微镜(德国卡尔蔡司公司),微量加样器(上海高鹤公司),病理图像分析处理系统(美国Media Cybernetics公司)等。
1.2 实验动物分组及模型建立采用慢性缺氧的方法建立动物模型[5]。SPF级健康C57BL/6小鼠,体重18~22 g,由新疆医科大学实验动物中心提供。小鼠怀孕产仔后,将新生小鼠随机分为对照组(n=10)、PPH组(n=11)、激动剂组(n=13)和抑制剂组(n=15),对照组新生小鼠暴露在空气中,其余3组新生小鼠暴露在12%氧浓度环境中。激动剂组每日给予GdCl3 16 mg/kg[6]腹腔注射1次;抑制剂组每日给予NPS2390 1 mg/kg[6]腹腔注射1次;PPH组和对照组每日给予同干预组等量的生理盐水腹腔注射;共持续14 d。通过控制氮气的流入继而控制低氧箱氧浓度的设置水平,气体流量氮气约为1 L/min,并通过低氧箱中的测氧仪持续监测氧浓度,维持FiO2在12%左右。保持箱内温度25~27℃,湿度50%~70%。母鼠可在箱内自由饮食、饮水;各处理组新生小鼠每天暴露于空气中的时间小于10 min;定时添加水、饲料及更换垫料。
1.3 各组小鼠体重监测实验期间,每天称量新生小鼠体重(body weight, BW),绘制时间-体重曲线,按公式计算BW增加率(rate of BW increase, RBWI)反映BW变化。RBWI=(终末BW-初始BW)/初始BW×100%。
1.4 组织学处理在完成低氧/常氧曝光后,水合氯醛麻醉各组小鼠,打开胸腔。使用24-G静脉留置针对新生小鼠进行气管插管,并用10%福尔马林灌入肺部以固定。取出肺组织及心脏进行石蜡包埋,然后通过苏木精-伊红(HE)染色以及免疫组化观察肺血管形态。同时将新生小鼠处死后立即取未灌入福尔马林的肺组织并液氮速冻后-80℃保存。
1.5 心脏组织HE染色和免疫组化染色常规固定后的心脏和肺组织进行石蜡包埋,制作心脏组织和肺组织石蜡切片。脱蜡后的心脏组织切片进行苏木精染色3 min,自来水洗3次后1%盐酸乙醇中酸化4~6 s,再次自来水冲洗后并在水中蓝化5 min,伊红染色2 min,脱水透明后中性树胶封片,光学显微镜下观察。脱蜡后的肺组织切片入蒸馏水,3%过氧化氢处理后进行枸橼酸抗原热修复,室温冷却,浸于PBS中震洗3次,每次5 min,擦去多余PBS后加适量α-SMA一抗(抗体浓度为1:500),4℃孵育过夜后加适量辣根过氧化物酶标记二抗,37℃孵育30 min,DAB显色1~2 min,苏木精复染1 min,中性树胶封片后晾干,光学显微镜下观察。
(1)肺小动脉血管壁厚度(WT):每个肺组织样本随机选取4张处理好的免疫组化染色切片,放于400倍显微镜下观察,随机选取5个视野,通过阳性的α-SMA免疫染色测量直径20~50 μm、50~99 μm的肺小动脉。由公式计算血管壁厚度占外径百分比:WT%=100×(2×血管内侧壁厚度)/血管外径。
(2)右心室与左心室壁厚度比(RV/LV):每个心脏组织样本随机选取4张HE染色切片,放于400倍显微镜下观察,每张切片随机选取5个视野,测量心脏RV/LV值。
(3)肺泡密度:每组每个肺组织样本随机选取4张HE染色切片,置于100倍光镜下,每张切片随机选取8~10个视野(避开大血管和支气管)观察,计数每个视野内肺泡数(Na),并计算每个视野的面积(S=0.203 mm2),按公式计算每平方厘米肺泡数以反映肺泡密度:平均肺泡数(MAN)=Na/S×100。
(4)肺泡大小:每组每个肺组织样本随机选取4张HE染色切片,置于100倍光镜下,每张切片随机选取8~10个视野(避开大血管和支气管),在每个视野正中划十字交叉线,计数与十字交叉线相交的肺泡隔数(Ns),同时测出十字线总长(L=913 μm),按公式计算肺泡平均内衬间隔(MLI)以表示肺泡平均内径即肺泡的大小:MLI=L/Ns。
1.6 激光共聚焦方法检测新生小鼠肺组织CaSR的表达取出制作好的肺组织石蜡切片,脱蜡后进行枸橼酸抗原热修复,室温冷却后PBS缓冲液震洗3次×5 min,吸水纸吸去组织周围多余PBS后血清封闭30 min,加入兔抗小鼠CaSR一抗(1:500),4℃孵育过夜,冲洗一抗,PBS缓冲液震洗3次×5 min,吸去多余PBS后加入FITC标记山羊抗兔二抗(1:50),将切片置于暗盒中37℃孵育1 h,用PBS洗去二抗,用吸水纸吸干组织周围多余的PBS,用10 μg/L Propidium Iodide进行核染色,甘油封片后激光共聚焦显微镜下观察,并采用AIM Image Examiner软件对扫描图像进行量化分析。
1.7 实时荧光定量PCR法检测新生小鼠肺组织CaSR mRNA表达水平应用Primer Premier 5.0软件、Oligo 6.0引物评估软件设计并确定引物为CaSR特异性序列。引物由上海生工生物工程公司合成。引物序列为:CaSR上游:5' -AGTGGTGAGACAGATGCGAGT-3' ,下游:5' -AGTGAGAGCGATTCCAAAGG-3' ,片段长度132 bp。MACT(内参)上游:5' -TTCCTTCTTGG-GTATGGAAT-3' ,下游:5' -GAGCAATGATCTTGAT-CTTC-3' ,片段长度203 bp。取100 mg肺组织低温充分匀浆后,用TRIzol法提取总RNA,取总RNA 5 μL进行逆转录操作合成20 μL的cDNA。反应体系:cDNA 3 μL、SYBR Green Ⅰ10 μL、上下游引物各1 μL、无酶水5 μL。反应条件:95℃预变性2 min;95℃变性30 s,55℃退火20 s,共40个循环。以CaSR PCR产物与内参照的荧光密度比作为CaSR mRNA的相对表达含量,表达的相对定量结果以2-△△CT表示。
1.8 Western blot法检测新生小鼠肺组织CaSR蛋白表达水平取100 mg肺组织放入研钵中,液氮研磨后加入蛋白裂解液及PMSF,冰上静置30 min,4℃下12 000 r/min离心20 min后取上清进行蛋白定量;取50 μg蛋白样品,10%SDS-PAGE凝胶电泳,23 V 46 min转移至硝酸纤维素膜,脱脂牛奶封闭膜2 h;加入小鼠抗大鼠CaSR一抗(1:1 000),anti-GAPDH(1:1 000)4℃过夜;TBST充分洗膜,5 min×6次,碱性磷酸酶标记的抗IgG二抗(1:20 000)常温孵育1 h,显色液(Promega)显色,定影处理晾干后扫描,分析光密度值。
1.9 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;若数据方差不齐,则运用Kruskal-Wallis H秩和检验,组间两两比较采用Mann-Whitney U检验,P < 0.05为差异有统计学意义。
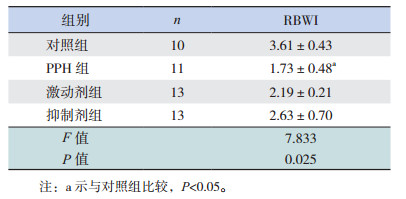
2 结果 2.1 新生小鼠基本情况对照组小鼠反应灵敏,精神良好,被毛时间短,且毛发色泽光亮;与对照组相比,PPH组、激动剂组、抑制剂组小鼠均出现反应迟钝,精神较对照组差,被毛时间长的情况,且抑制剂组小鼠死亡2只。低氧2周后,PPH组RBWI显著低于对照组(P < 0.05);而激动剂组和抑制剂组RBWI与对照组和PPH组比较差异均无统计学意义,且两组间比较差异亦无统计学意义(P > 0.05)。见表 1。
| 表 1 低氧2周后各组小鼠RBWI比较(x±s) |
2.2 各组小鼠肺小动脉血管壁及右心室壁厚度变化
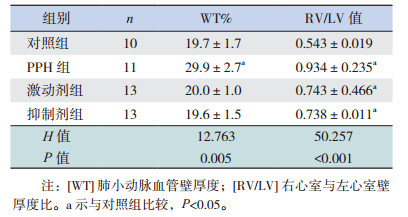
对照组肺小动脉血管壁光滑无增厚,管腔无狭窄,血管内皮细胞分布均匀,连续性完整;与对照组相比,PPH组WT%显著增加(P < 0.05),官腔狭窄,中层平滑肌细胞排列紊乱;激动剂组和抑制剂组WT%与对照组比较差异无统计学意义(P > 0.05)(图 1,表 2)。光学显微镜下观察,对照组RV/LV值无增厚,心肌细胞排列整齐,细胞大小均一。与对照组相比,激动剂组和PPH组RV/LV值均增大,细胞肥大,细胞大小不规则;抑制剂组RV/LV值亦较对照组增大(表 2)。
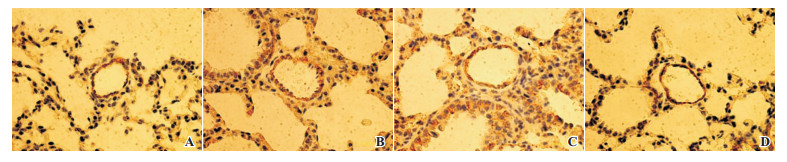
|
图 1 各组新生小鼠肺小动脉血管壁变化(DAB显色,×400) 与对照组(A)相比,PPH组(B)血管壁显著增厚;激动剂组(C)和抑制剂组(D)血管壁厚度与对照组相比无显著差别。 |
| 表 2 各组WT%及RV/LV值比较(x±s) |
2.3 各组小鼠肺泡形态、密度及大小的变化
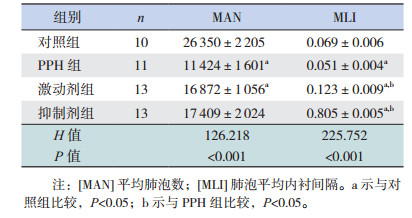
肺组织HE染色显示,对照组新生小鼠肺泡完整,单位面积内肺泡数量多,肺间质无炎性细胞浸润;与对照组相比,PPH组新生小鼠肺泡明显破坏,肺间质增厚并伴有中性粒细胞等炎性细胞浸润,MAN及MLI显著降低(P < 0.05);激动剂组和抑制剂组MAN较PPH组增多,但差异无统计学意义(P > 0.05),MLI显著高于PPH组和对照组(P < 0.05);激动剂组和抑制剂组间比较MAN和MLI差异无统计学意义(P > 0.05)。见图 2,表 3。
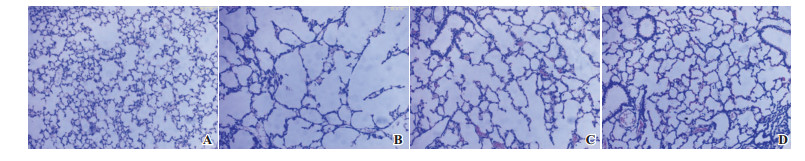
|
图 2 各组新生小鼠肺泡形态及数目变化(苏木精-伊红染色,×100) 与对照组(A)相比,PPH组(B)新生小鼠肺泡明显破坏,肺间质增厚并伴有中性粒细胞等炎性细胞浸润,单位面积内肺泡数减少;激动剂组(C)和抑制剂组(D)单位面积内肺泡数较PPH组增多,但仍少于对照组;激动剂组和抑制剂组相比单位面积内肺泡数无差异。 |
| 表 3 各组肺泡MAN和MLI比较(x±s) |
2.4 新生小鼠肺组织中CaSR的表达
CaSR为绿色荧光,红色荧光为细胞核。激光共聚焦显微镜下显示,CaSR在各组新生小鼠肺组织中广泛表达,主要表达在肺血管上皮细胞。PPH组CaSR表达较对照组明显增高,激动剂组较PPH组进一步增高,而抑制剂组较PPH组有明显降低(图 3)。对照组、PPH组、激动剂组和抑制剂组新生小鼠荧光强度分别为42.6±2.2、91.7±5.6、140.7±3.3、2.9±1.3,差异有统计学意义(F=296.20,P < 0.01);与对照组相比,PPH组CaSR表达较对照组明显增高,激动剂组较PPH组进一步增高,而抑制剂组较PPH组有明显降低(P < 0.05)。
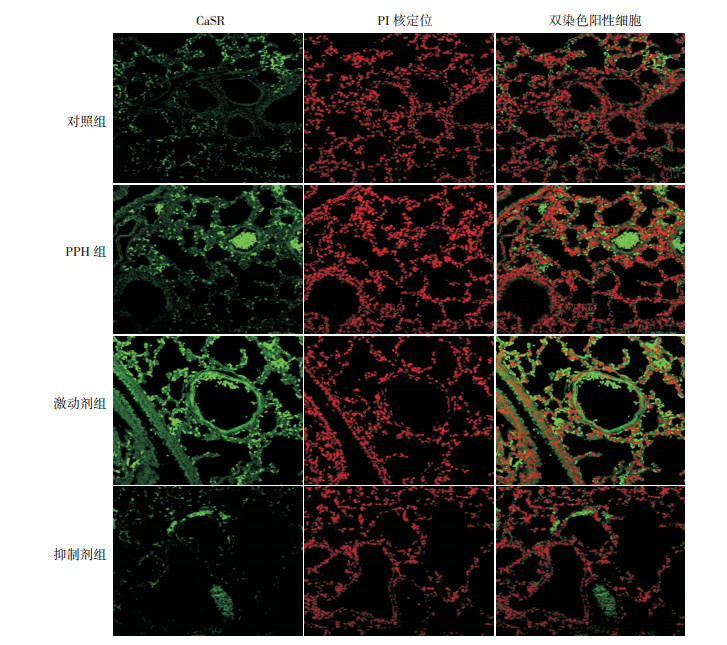
|
图 3 激光共聚焦显微镜定位各组CaSR的表达(×400) 与对照组相比,PPH组CaSR表达较对照组明显增高,激动剂组较PPH组进一步增高,而抑制剂组较PPH组有明显降低。CaSR主要在肺血管上皮细胞表达。 |
2.5 新生小鼠肺组织中CaSR mRNA及其蛋白的表达情况
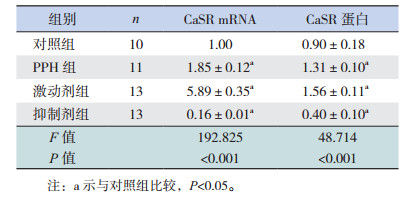
激动剂组、PPH组CaSR mRNA及其蛋白表达量均高于对照组;而抑制剂组CaSR mRNA及其蛋白表达量低于对照组(P < 0.05)。见表 4,图 4。
| 表 4 各组小鼠肺组织CaSR mRNA及其蛋白相对表达量比较(x±s) |
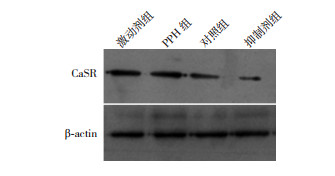
|
图 4 Western blot检测各组新生小鼠肺组织CaSR蛋白表达电泳图 |
3 讨论
本研究通过慢性持续低氧建立新生小鼠PPH模型[5]。在此模型中,PPH组肺小动脉血管壁及右心室游离壁厚度较对照组明显增厚,这表明新生小鼠PPH模型建立成功。有研究证实,胎儿出生后不能建立正常的肺循环是PPHN产生的直接原因[7]。低氧是肺动脉高压形成的始动因素,早期的低氧性肺血管收缩和后期的低氧性肺血管重塑是低氧性肺动脉高压肺血管发生病理生理变化的主要原因[8]。
CaSR是一种典型的G蛋白偶联受体,细胞外钙是第一个被确认的通过激活CaSR而起作用的物质[9]。CaSR除了在调节机体钙稳态中起重要作用,还具有调节细胞增殖、分化、凋亡[10]和激素的分泌等功能[11]。CaSR能够感受细胞外Ca2+浓度变化,并通过多种信号途径,包括[Ca2+]i和细胞外调节蛋白激酶,将信号传递到细胞内,导致细胞内钙离子浓度升高,从而促进细胞增殖[12]。
PPHN的重要病理基础之一是肺血管平滑肌细胞的增殖[13]。有研究表明,慢性低氧引发合成型平滑肌细胞增殖,这有助于血管壁中膜增厚和肺血管重构[14]。本课题组前期研究已证实:在PPH大鼠中,肺动脉CaSR表达增加[4]。在本研究新生小鼠PPH模型中,PPH组CaSR mRNA和蛋白的表达量明显高于对照组,这与人主动脉内皮细胞的研究结果类似[15],说明新生小鼠肺动脉有CaSR蛋白的表达。免疫荧光染色显示,CaSR蛋白定位在平滑肌细胞的胞膜和胞浆,该结果与在其他类型细胞中CaSR定位的报道一致[16]。
为了确定CaSR在低氧诱导的新生小鼠PPH中的作用,本研究中给予低氧环境中的新生小鼠激动剂和抑制剂处理,结果发现:PPH组新生小鼠CaSR的表达量明显高于对照组,GdCl3(CaSR激动剂)能够进一步上调这种增加,而NPS2390(CaSR抑制剂)下调了这种增加。本研究中激光共聚焦、CaSR mRNA及其蛋白的表达都支持上述观点。这与李光伟等[17]在细胞中的研究相一致。
本研究结果显示:对照组新生小鼠肺小动脉壁较薄,PPH组肺小动脉壁厚度较对照组明显增厚;激动剂组肺小动脉壁厚度较对照组厚但较PPH组薄;抑制剂组血管壁厚度略低于对照组;但激动剂组、对照组、抑制剂组3组之间肺小动脉壁厚度比较差异无统计学意义;即激动剂和抑制剂对肺小动脉血管壁厚度均无影响。这可能与GdCl3本身的结构和功能有关。在本模型中,当低氧发生时,新生小鼠肺组织中CaSR的表达量升高,GdCl3是CaSR的激动剂,能进一步促进新生小鼠肺组织中CaSR的含量升高,使细胞内钙离子内流增加,从而加剧细胞增殖和血管构型重建。但同时,GdCl3的晶体半径与Ca2+高度相似,能够替换Ca2+,干扰Ca2+的吸收和Ca2+依赖性的细胞进程,包括吞噬和蛋白质水解激活作用,阻断细胞膜Ca2+通道[18-19]。而抑制剂组WT%与对照组比较差异无统计学意义,可能与低氧时间较短有关[20]。对于右心室游离壁厚度,其他3组均较对照组增厚,这可能与干预时间短,抑制剂未能完全逆转右心室游离壁的厚度有关。由于GdCl3自身结构和功能的关系,并不能完全代表CaSR激动剂的作用,故在进一步的研究中我们可能更换CaSR激动剂为新霉素。
综上所述,新生小鼠肺动脉有CaSR的表达,低氧可以活化CaSR,活化的CaSR可以引起[Ca2+]i的升高和促进肺动脉平滑肌细胞增殖,进而影响肺血管收缩和重建,促进PPH的发展。CaSR抑制剂可在一定程度上逆转PPH中的肺血管构型重建。CaSR表达增加在低氧性肺动脉高压中发挥重要的作用,其具体作用机制和信号转导途径有待于进一步研究。
| [1] | Steinhorn RH. Neonatal pulmonary hypertension[J]. Pediatr Crit Care Med, 2010, 11 (2 Suppl): S79–S84. |
| [2] | 中华医学会儿科学分会心血管学组, 《中华儿科杂志》编辑委员会. 儿童肺高血压诊断与治疗专家共识[J]. 中华儿科杂志, 2015, 53 (1): 6–16. |
| [3] | Alwan S, Bandoli G, Chambers CD. Maternal use of selective serotonin-reuptake inhibitors and risk of persistent pulmonary hypertension of the newborn[J]. Clin Pharmacol Ther, 2016, 100 (1): 34–41. DOI:10.1002/cpt.376 |
| [4] | 张方方, 王彦梅, 田松柏, 等. 钙敏感受体及相关分子在新生大鼠持续肺动脉高压发病中的作用[J]. 中国新生儿科杂志, 2016, 31 (4): 64–68. |
| [5] | Ambalavanan N, Bulger A, Murphy-Ullrich J, et al. Endothelin-A receptor blockade prevents and partially reverses neonatal hypoxic pulmonary vascular remodeling[J]. Pediatr Res, 2005, 57 (5 Pt 1): 631–636. |
| [6] | 甄毅岚.钙敏感受体在小鼠缺血性脑卒中的作用及机制[D].合肥:安徽医科大学, 2014. |
| [7] | Alano MA, Ngougmna E, Ostrea EM Jr, et al. Analysis of nonsteroidal antiinflammatory drugs in meconium and its relation to persistent pulmonary hypertension of the newborn[J]. Pediatrics, 2001, 107 (3): 519–523. DOI:10.1542/peds.107.3.519 |
| [8] | Smith KA, Yuan JX. Hypoxia-Inducible factor-lα in pulmonary arterial smooth muscle cells and hypoxia-induced pulmonary hypertension[J]. Am J Respir Crit Care Med, 2014, 189 (3): 245–246. DOI:10.1164/rccm.201312-2148ED |
| [9] | Li X, Zima AV, Sheikh F, et al. Endothelin-1-induced arrhythmogenic Ca2+ signaling is abolished in atrial myocytes of inositol-1, 4, 5-trisphosphate (IP3)-receptor type 2-deficient mice[J]. Circ Res, 2005, 96 (12): 1274–1281. DOI:10.1161/01.RES.0000172556.05576.4c |
| [10] | Sun YH, Li YQ, Feng SL, et al. Calcium-sensing receptor activation contributed to apoptosis stimulates TRPC6 channel in rat neonatal ventricular myocytes[J]. Biochem Biophys Res Commun, 2010, 394 (4): 955–961. DOI:10.1016/j.bbrc.2010.03.096 |
| [11] | 杨智伟, 赵施皓, 郑煦暘. 钙敏感受体参与低氧性肺动脉高压形成的研究进展[J]. 心脏杂志, 25 (4): 490–493. |
| [12] | Zhang J, Zhou J, Cai L, et al. Extracellular calcium-sensing receptor is critical in hypoxic pulmonary vasoconstriction[J]. Antioxid Redox Signal, 2012, 17 (3): 471–484. DOI:10.1089/ars.2011.4168 |
| [13] | Li GW, Xing WJ, Bai SZ. The calcium-sensing receptor mediates hypoxia-induced proliferation of rat pulmonary artery smooth muscle cells through MEK1/ERK1, 2 and PI3K pathways[J]. Basic Clin Pharmacol Toxicol, 2011, 108 (3): 185–193. DOI:10.1111/pto.2011.108.issue-3 |
| [14] | Aoshima D, Murata T, Hori M, et al. Time-dependent phenotypic and contractile changes of pulmonary artery in chronic hypoxiainduced pulmonary hypertension[J]. J Pharmacol Sci, 2009, 110 (2): 182–190. DOI:10.1254/jphs.09059FP |
| [15] | Ziegelstein RC, Xiong Y, He C, et al. Expresssion of a functional extracellular calcium-sensing receptor in human aortic endothelial cells[J]. Biochem Biophys Res Commun, 2006, 342 (1): 153–163. DOI:10.1016/j.bbrc.2006.01.135 |
| [16] | Tu CL, Chang W, Bikle DD. The role of the calcium sensing receptor in regulating intracellular calcium handling in human epidermal keratinocytes[J]. J Invest Dermatol, 2007, 127 (5): 1074–1083. DOI:10.1038/sj.jid.5700633 |
| [17] | 李光伟, 邢文婧, 郝静辉. 钙敏感受体在缺氧诱导的大鼠肺动脉平滑肌细胞增殖中的作用[J]. 中国病理生理杂志, 2010, 26 (12): 2433–2437. |
| [18] | 廖锐, 龚建平. Kupffer细胞抑制剂氯化钆的研究现状[J]. 中华肝胆外科杂志, 2009, 15 (10): 791–794. |
| [19] | Peralta C, Jiménez-Castro MB, Gracia-Sancho J. Hepatic ischemia and reperfusion injury:effects on the liver sinusoidal milieu[J]. J Hepatol, 2013, 59 (5): 1094–1106. DOI:10.1016/j.jhep.2013.06.017 |
| [20] | Peng X, Li HX, Shao HJ. Involvement of calcium-sensing receptors in hypoxia-induced vascular remodeling and pulmonary hypertension by promoting phenotypic modulation of small pulmonary arteries[J]. Mol Cell Biochem, 2014, 396 (1-2): 87–98. DOI:10.1007/s11010-014-2145-9 |
 2017, Vol. 19
2017, Vol. 19