支气管肺发育不良(bronchopulmonary dysplasia, BPD)是发生于早产儿长期应用高浓度氧气和辅助机械通气后的一种慢性肺疾病(chronic lung disease, CLD),是由生后感染、气压伤和容量伤导致的纤维化以及氧毒性等多因素诱发形成[1],其发病率随胎龄和出生体重的减少而增高[2],其发生机制仍不甚清楚。近些年来,对长链非编码RNA(long noncoding RNA, lncRNA)的研究已成为生命医学多领域研究热点,同时也成为我们探索高氧肺损伤发病机制的新方向。NANCI(NKX2.1-associated long noncoding intergenic RNA)是Herriges等[3]新发现的与肺发育相关的lncRNA,它在胚肺及成熟肺中持续表达,并通过调控下游临近的转录因子NKX2.1/甲状腺转录因子1(TTF-1)的表达,对肺组织分化、维持肺泡稳定性及增强宿主防御力等起重要作用。本课题组前期研究中也发现NANCI的差异性表达[4]。故本实验进一步研究了高氧诱导小鼠肺损伤后,肺组织中lncRNA NANCI的表达变化及对NKX2.1的调控作用,从而探究NANCI→NKX2.1→ target genes信号通路在高氧肺损伤中可能的作用机制,而目前国内外均无该信号通路与高氧诱导肺损伤相关的研究报道。
1 材料与方法 1.1 实验动物与试剂6~8周龄C57BL/6J雌性小鼠10只,雄性小鼠3只,购自南京玄武区森堡生物制品中心,以雌雄比1:3或1:4合笼受孕。
实验中,用于Western blot实验的主要试剂、材料包括:SDS-PAGE凝胶试剂盒、ECL试剂盒(南京凯基生物科技发展有限公司),电泳和转膜缓冲液(含Tris、Gly、SDS)、PVDF膜、兔抗鼠NKX2.1单克隆抗体一抗(美国Proteintech公司),兔抗鼠β-Tubulin多克隆抗体一抗(美国Bioworld公司),山羊抗兔多克隆抗体二抗(徐州微科曼得生物工程公司);用于RT-qPCR实验的主要试剂、材料包括:TRIzol、逆转录试剂盒(徐州微科曼得生物工程公司),SYBR Green试剂盒(北京天根生化科技有限公司);数字式测氧仪购自Farstar医学设备有限公司;氧气由南京医科大学附属淮安第一医院中心实验室提供。
1.2 实验分组与处理选取母鼠产下的新生小鼠48只,于生后24 h内随机分为空气组和高氧组,每组24只,各组再随机分3小组,分别于实验7、14、21 d后处死,每组8只。分组后称体重,空气组(FiO2=21%)置于空气中喂养,高氧组置于60 cm×50 cm×40 cm大小自制氧箱,氧流量6~7 L/min,氧浓度维持在95%以上,由数字式氧浓度仪监测,维持室温22~26℃[4]。实验期间,每日8:00~8:30开箱更换垫料、补充饲料和水,并将空气组与高氧组母鼠互换,防止氧中毒而影响母鼠对仔鼠的哺乳能力。
1.3 标本采集分别于出生后7、14、21 d处死各组小鼠并采集肺组织。处死前称体重,然后以3.5%水合氯醛按照0.01 mL/g进行腹腔注射麻醉,解剖所用器械均无菌处理。开胸腔分离右上肺浸入4%多聚甲醛中,作苏木精-伊红染色制作病理切片,用于观察肺组织形态;其余肺组织用4℃ PBS清洗后置于无酶EP管中经液氮转存-80℃冰箱,用于Western blot和RT-qPCR检测。
1.4 肺组织形态分析肺泡化程度用辐射状肺泡计数(RAC)来评估,即呼吸性细支气管中心至最近纤维隔或胸膜垂直线上的肺泡数目[5],反映终末呼吸单位所含肺泡数目。每个标本随机选取4张切片,100倍光学显微镜下进行观察,每张切片随机选取5个视野测量RAC,取平均值。
1.5 RT-qPCR检测NANCI及NKX2.1 RNA表达取50~100 mg肺组织,TRIzol抽提肺组织总RNA,使用Vic qRT Super Kit试剂盒将总RNA逆转录成cDNA。
用SYBR Green试剂盒,根据两步法反应程序采用RT-qPCR检测NANCI及NKX2.1 mRNA的相对表达量。所有引物由上海生工生物工程公司合成。NANCI的引物序列:上游引物5'-AGGAACGCCTCAATCTGCATCTCA-3',下游引物5'-CCATTGACTGAATTGTCCACGGCA-3';NKX2.1的引物序列:上游引物5'-ACCAAACTGCTGGACG-ACTT-3',下游引物5'-GGAGGAGGAGGAGGAGAA-GA-3';GAPDH的引物序列:上游引物5'-TGCACC-ACCAACTGCTTAGC-3',下游引物5'-GGCATGGACT-GTGGTCATGAG-3'。反应体系(20 μL):2×SuperReal PreMix Plus 10 μL,上下游引物(10 μM)各0.6 μL,cDNA模板1 μL,RNase-free ddH2O 7.8 μL。反应条件:95℃ 15 min;95℃ 10 s,64℃(NANCI)/60℃(NKX2.1)20 s,40个循环。每样本平行设3个样本,取其CT值平均数,以目的基因CT值-GAPDH的CT值记为ΔCT值,计算目的基因mRNA相对表达量,结果以2-ΔCT表示。
1.6 Western blot法检测NKX2.1蛋白表达取50~100 mg肺组织,加入RIPA裂解液和PMSF试剂以100:1手动匀浆裂解肺组织,12 000 r/min 4℃离心15 min取上清,-80℃冻存或留用测蛋白浓度;用BCA法(碧云天试剂盒)测量蛋白浓度;以每孔10 μg总蛋白量上样,加上样缓冲液并于沸水中煮沸5 min后以8% SDS-聚丙烯酰胺凝胶进行电泳分离,然后把胶上的蛋白电转移到PVDF膜上,5%无脂奶粉封闭,与待测蛋白的特异性抗体(稀释度均为1:2 000)孵育杂交,4℃过夜洗膜后,再加辣根过氧化物酶标记的二抗,室温孵育1.5 h,洗膜后进行显色,曝光于X线胶片上,在图像分析系统计算目的蛋白条带灰度值与内参灰度值的比值,即NKX2.1/β-Tubulin灰度比值,代表NKX2.1蛋白的相对表达量。
1.7 统计学分析使用SPSS 20.0统计学软件对数据进行统计学分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验;多组间比较采用单因素方差分析,组间两两比较用LSD-t检验;组间相关分析采用Pearson相关分析。P < 0.05为差异有统计学意义。
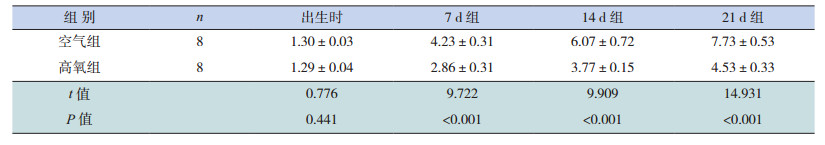
2 结果 2.1 小鼠一般情况空气组小鼠出生时体重与高氧组比较差异无统计学意义(P=0.441),空气组小鼠反应良好,体重增长迅速;高氧组小鼠于生后3 d开始出现反应差、自主活动减少,呼吸困难表现逐渐加重;高氧组小鼠于生后7、14、21 d体重增长缓慢,与空气组比较差异均有统计学意义(P < 0.05)(表 1)。高氧组7 d无死亡,14 d时死亡1只,21 d时死亡2只,后续实验各组补足实验动物例数至8只。
| 表 1 两组小鼠不同时间点体重比较(x±s, g) |
2.2 两组小鼠肺组织病理变化
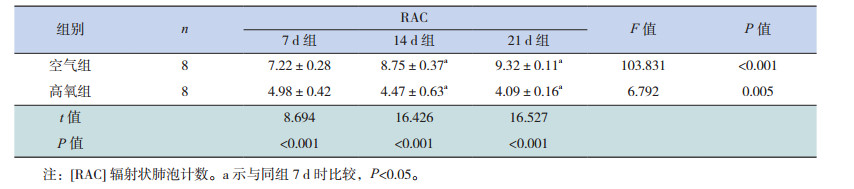
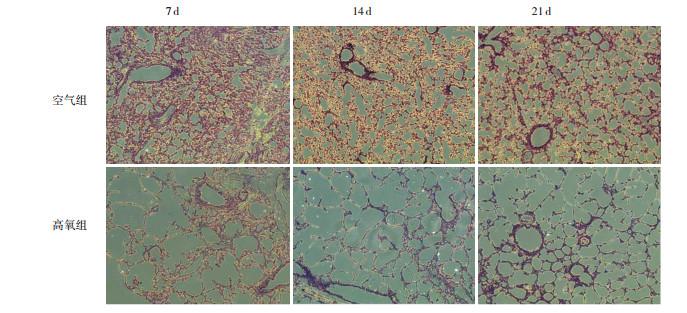
苏木精-伊红结果显示,高氧组较空气组肺泡间隔变薄、肺泡腔增大、肺泡数目减少(图 1);生后各时间点高氧组RAC值显著低于空气组(P < 0.05),且空气组RAC值随生长时间延长逐渐增大,而高氧组RAC值随生长时间延长逐渐减小(P < 0.05),见表 2。
|
图 1 不同时间点两组小鼠肺组织病理变化(苏木精-伊红染色,×100) 与空气组相比,高氧组肺泡腔增大,肺泡间隔断裂、变保 |
| 表 2 不同时间点两组小鼠肺组织RAC值比较(x±s) |
2.3 两组小鼠肺组织NANCI mRNA表达水平变化
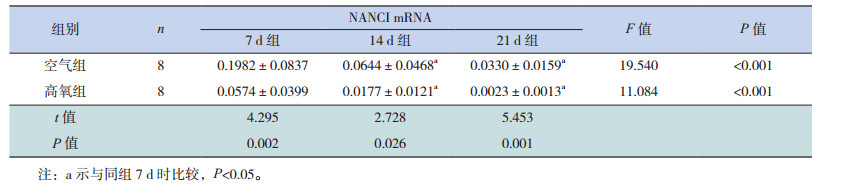
生后各时间点高氧组NANCI mRNA相对表达量显著低于空气组(P < 0.05),且两组NANCI mRNA的相对表达量均随高氧时间延长逐渐降低,但仅7 d组分别与14 d、21 d组比较差异有统计学意义(P < 0.05),14 d组和21 d组比较差异无统计学意义(P > 0.05),见表 3。
| 表 3 不同时间点两组小鼠肺组织NANCI mRNA相对表达量比较(x±s) |
2.4 两组小鼠肺组织NKX2.1 mRNA及其蛋白表达水平变化
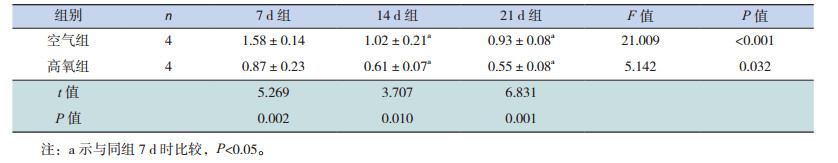
生后各时间点高氧组NKX2.1 mRNA表达水平均低于空气组(P < 0.05),且两组NKX2.1 mRNA相对表达量随高氧处理时间延长逐渐降低(P < 0.05),但仅7 d组分别与14 d、21 d组比较差异有统计学意义(P < 0.05),14 d组和21 d组比较差异无统计学意义(P > 0.05)(表 4)。生后各时间点两组肺组织的NKX2.1蛋白表达变化趋势与NKX2.1 mRNA的表达相似,见图 2,表 5。
| 表 4 不同时间点两组小鼠肺组织NKX2.1 mRNA相对表达量比较(x±s) |
| 表 5 不同时间点两组小鼠肺组织NKX2.1蛋白相对表达量比较(x±s) |

|
图 2 Western blot检测不同时间点两组小鼠肺组织NKX2.1蛋白表达电泳图 |
2.5 相关性分析
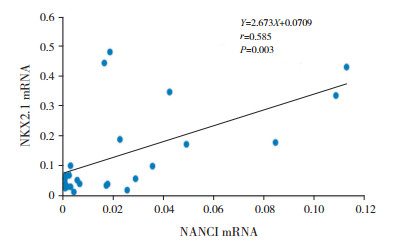
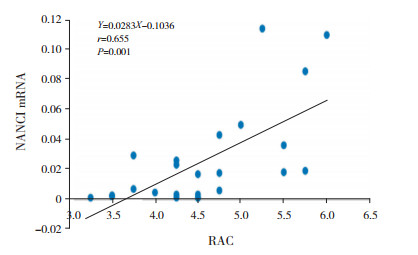
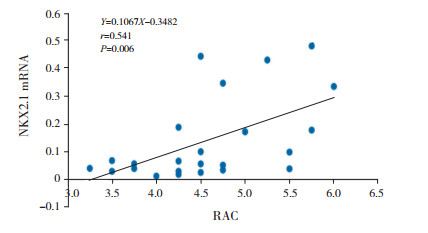
高氧作用下,NKX2.1 mRNA与NANCI mRNA表达呈正相关(r=0.585,P=0.003)(图 3);两者与高氧组RAC水平均呈正相关(分别r=0.655、0.541,P < 0.05)(图 4~5)。
|
图 3 高氧组NANCI mRNA与NKX2.1 mRNA的相关分析图 |
|
图 4 高氧组NANCI mRNA与RAC的相关分析图 |
|
图 5 高氧组NKX2.1 mRNA与RAC的相关分析图 |
3 讨论
随着新一代测序技术与基因芯片技术的广泛应用,许多学者们在人和模型动物中筛选出大量与肺相关基因,其中lncRNA备受关注,已成为近些年生命医学多学科研究的热点,同时也成为我们探索高氧肺损伤发病机制的新方向。
LncRNA是一类转录长度超过200 nt、不具备编码蛋白功能的转录体[6],在哺乳动物基因组普遍被转录,起初被认为是基因组转录的“噪音”。根据其转录位置可分为正义转录体、反义转录体、双向转录体、内含子RNA及基因间的RNA。近些年的研究表明LncRNA的功能涉及到调控一系列的生物学过程,包括剂量补偿作用[7]、基因组印记[8]、转录激活与干扰[9]、染色质修饰[10]、组织发育[3]及疾病形成过程等。例如在本课题组前期研究中筛出了与BPD相关的差异性表达的LncRNA,如1010001N08Rik[11]。LncRNA NANCI是Herriges等[3]首次发现的与肺发育相关的基因间lncRNA,位于Wnt/b-catenin信号通路下游、NKX2.1的上游,调节肺内胚层基因的表达和形态形成。当敲除NANCI时NKX2.1无表达,rescue实验显示NKX2.1的靶基因上调,包括Abca3、Sftpc、Aqp5,尤其是Aqp1上调尤为明显;当过表达NANCI时,NKX2.1及其靶基因表达水平上调,而NANCI的表达却不受NKX2.1的影响。在本研究中发现,新生小鼠空气组NANCI和NKX2.1的mRNA表达水平7 d最高,14 d与21 d呈同水平表达;高氧7 d后作为肺泡发育评价指标的RAC[5]开始降低,继而持续下降,到21 d达最低水平,同时发现NANCI和NKX2.1的mRNA表达变化趋势基本一致,即7 d开始下降,14 d继续减少,21 d降至最低,呈正相关,NKX2.1蛋白表达也有类似的趋势。该现象表明:高氧诱导肺损伤时,肺组织NANCI和NKX2.1基因表达下降,并与肺泡损伤程度呈正相关;另外,正常小鼠出生14 d肺发育成熟[11],NANCI的表达逐渐下降,至21 d稳定在低水平,则进一步阐明了NANCI在小鼠出生后的表达特点。因此,我们认为NANCI可能主要参与未成熟肺组织发育;而高氧肺损伤时NANCI表达明显下调并下调下游NKX2.1及其靶基因的表达,从而影响肺泡成熟,即NANCI→NKX2.1→Target genes信号通路在肺发育和分化过程中起着至关重要的作用,也是参与高氧肺损伤形成的重要分子生物学机制。
NKX2.1是位于染色体14q13区带的一个核转录因子,特异性表达于肺组织、甲状腺上皮细胞并广泛分布于前脑腹侧,是最早发现的肺内胚层祖细胞的标记物[12]。它通过调节分枝化形态形成参与肺正常发育[13],调控其靶基因如肺表面活性蛋白(surfactant associated protein, SP),包括SP-A、B、C、D的表达以维持肺泡稳定性及增强宿主防御力,调控水通道蛋白(aquaporin, AQP)稳定肺泡间隔液体平衡[14]等。既往研究表明,高氧7 d诱导肺损伤时,AQP1, 5表达水平下降,此时是肺水肿高峰期,之后AQP1表达有所上升[15];SP主要生理作用包括:降低肺泡表明张力,保持肺顺应性,预防肺水肿,以及免疫调节和防御作用,在高氧肺损伤中,SP-A、B、C、D均显著下降[16]。
本实验研究NANCI和NKX2.1在空气和高氧中的表达趋势,证实了NANCI→NKX2.1→ Target genes信号通路可能参与高氧肺损伤诱导的肺泡发育障碍。本实验不足在于缺乏数据说明NANCI在0~7 d的表达特点,故下一步本课题组将深入探讨该时间段的表达特点以及该信号通路在肺损伤中的保护作用,并有可能使得NANCI成为临床BPD患儿早期诊断、预防及预后的分子标志物或治疗靶点,为BPD的诊治提供新的思路。
| [1] | Lavoie PM, Dubé MP. Genetics of bronchopulmonary dysplasia in the age of genomics[J]. Curr Opin Pediatr, 2010, 22 (2): 134–138. DOI:10.1097/MOP.0b013e328336eb85 |
| [2] | Jobe AH. The new bronchopulmonary dysplasia[J]. Curr Opin Pediatr, 2011, 23 (2): 167–172. DOI:10.1097/MOP.0b013e3283423e6b |
| [3] | Herriges MJ, Swarr DT, Morley MP, et al. Long noncoding RNAs are spatially correlated with transcription factors and regulate lung development[J]. Genes Dev, 2014, 28 (12): 1363–1379. DOI:10.1101/gad.238782.114 |
| [4] | 包天平, 赵赛, 杨丽娟, 等. 高氧诱导支气管肺发育不良新生小鼠肺组织中lncRNA表达谱的变化[J]. 南京医科大学学报(自然科学版), 2016, 36 (3): 318–322. |
| [5] | Balasubramaniam V, Tang JR, Maxey A, et al. Mild hypoxia impairs alveolarization in the endothelial nitric oxide synthasedeficient mouse[J]. Am J Physiol Lung Cell Mol Physiol, 2003, 284 (6): L964–L971. DOI:10.1152/ajplung.00421.2002 |
| [6] | Ponting CP, Oliver PL, Reik W. Evolution and functions of long noncoding RNAs[J]. Cell, 2009, 136 (4): 629–641. DOI:10.1016/j.cell.2009.02.006 |
| [7] | Zhao J, Sun BK, Erwin JA, et al. Polycomb proteins targeted by a short repeat RNA to the mouse X chromosome[J]. Science, 2008, 322 (5902): 750–756. DOI:10.1126/science.1163045 |
| [8] | Bartolomei MS, Zemel S, Tilghman SM. Parental imprinting of the mouse H19 gene[J]. Nature, 1991, 351 (6322): 153–155. DOI:10.1038/351153a0 |
| [9] | Kwek KY, Murphy S, Furger A, et al. U1 snRNA associates with TFⅡH and regulates transcriptional initiation[J]. Nat Struct Biol, 2002, 9 (11): 800–805. |
| [10] | Plath K, Fang J, Mlynarczyk-Evans SK, et al. Role of histone H3 lysine 27 methylation in Xinactivation[J]. Science, 2003, 300 (5616): 131–135. DOI:10.1126/science.1084274 |
| [11] | Mund SI, Stampanoni M, Schittny JC. Developmental alveolarization of the mouse lung[J]. Dev Dyn, 2008, 237 (8): 2108–2116. DOI:10.1002/dvdy.v237:8 |
| [12] | Kimura S, Hara Y, Pineau T, et al. The T/ebp null mouse: thyroid-specific enhancer-binding protein is essential for the organogenesis of the thyroid, lung, ventral forebrain, and pituitary[J]. Genes Dev, 1996, 10 (1): 60–69. DOI:10.1101/gad.10.1.60 |
| [13] | Minoo P, Hamdan H, Bu D, et al. TTF-1 regulates lung epithelial morphogenesis[J]. Dev Biol, 1995, 172 (2): 694–698. DOI:10.1006/dbio.1995.8080 |
| [14] | Kim JG, Son YJ, Yun CH, et al. Thyroid transcription factor-1 facilitates cerebrospinal fluid formation by regulating aquaporin-1 synthesis in the brain[J]. J Biol Chem, 2007, 282 (20): 14923–14931. DOI:10.1074/jbc.M701411200 |
| [15] | 岳冬梅, 薛辛东. 水通道蛋白1, 5与新生鼠高氧肺损伤肺水肿的关系研究[J]. 中国当代儿科杂志, 2006, 8 (2): 147–150. |
| [16] | Pavlovic J, Papagaroufalis C, Xanthou M, et al. Genetic variants of surfactant proteins A, B, C, and D in bronchopulmonary dysplasia[J]. Dis Markers, 2006, 22 (5-6): 277–291. DOI:10.1155/2006/817805 |
 2017, Vol. 19
2017, Vol. 19