支气管哮喘(简称哮喘)是一种严重危害人类健康的慢性气道炎症性疾病,以嗜酸性粒细胞、气道黏液异常增多及Th1/Th2细胞因子分泌失衡为特征,发病时主要表现为呼吸急促、胸闷和咳嗽,其易感人群中半数在12岁以前发病,常见于儿童和年轻人[1]。哮喘在全球都具有较高的发病率,据估计,2025年将会有4亿人受到哮喘的影响[2]。由于其病程可能长达十几年至几十年,为患者的家庭和社会带来了沉重的经济和精神负担。因此,多方面寻找防治哮喘的方法是有必要的。
热休克反应是指机体在高温、自由基、细菌感染或炎症等因素刺激下以基因表达变化为特征的系统防御适应性反应。热休克因子(heat shock factor 1, HSF1)是最早被发现的热休克转录因子,在热损伤、缺氧及炎症环境下激活,通过促进下游基因的表达发挥作用[3]。研究表明HSF1在哮喘小鼠肺组织中表达升高,其表达量与炎症的严重程度有关[4],且HSF1在多种炎症相关的疾病中具有抗炎作用,但HSF1对哮喘气道高反应及气道炎症的作用尚未见报道。本研究以卵清蛋白(OVA)致敏和激发建立小鼠哮喘模型,并给予HSF1 siRNA,通过测定气道高反应性、计算嗜酸性粒细胞(eosinophilia, EOS)的数目,检测OVA特异性IgE的含量,以及肺组织及支气管肺泡灌洗液(BALF)中IL-4、IL-5、IL-13和IFN-γ的水平,探讨HSF1对哮喘小鼠气道高反应性和气道炎症的作用及可能机制,为呼吸系统相关疾病和哮喘的防治奠定一定的理论基础。
1 材料与方法 1.1 材料SPF级8~10周龄雌性BABL/c小鼠,体重22~25 g,购自北京维通利华公司;OVA、明矾和醋甲胆碱购自美国Sigma公司;HSF1小干扰RNA阴性对照(HSF1 siRNA negative control, siHSF1-NC)和沉默HSF1的质粒HSF1 siRNA(siHSF1)购自上海生工生物公司;小鼠OVA特异性IgE ELISA试剂盒购自日本Shibayagi公司;IL-4、IL-5和IL-13酶联免疫测定试剂盒购自美国R & D公司;IFN-γ酶联免疫试剂盒购自美国eBioscience公司;TRIzol提取RNA试剂盒购自美国Invitrogen公司;逆转录试剂盒购自美国Promega公司;SYBR Premix Ex TaqⅡ购自日本Takara公司;抗HSF1、高迁移率族蛋白1(high mobility group box 1, HMGB1)和磷酸化c-jun氨基末端激酶(p-JNK)抗体购自美国Cell Signaling公司;蛋白印迹中第二抗体购自北京中杉金桥公司。
1.2 哮喘模型的建立将36只小鼠随机分为对照组、哮喘组、siHSF1-NC组和siHSF1组,每组9只。哮喘模型制备参考文献[5]并略作改动,即在第0、7、14天腹腔注射10 μg OVA(含0.3 mg明矾)。对照组注射相应的生理盐水。在第26~28天,siHSF1-NC组和siHSF1组分别气管内给予siHSF1-NC和siHSF1(每50 μL含12.5 μg siRNA),1 h后同哮喘组采用1% OVA雾化吸入30 min,连续3 d,每天1次。对照组以生理盐水雾化吸入。
1.3 气道反应性测定在末次激发24 h后,采用1%戊巴比妥钠按照70 mg/kg剂量腹腔注射麻醉小鼠,固定小鼠,钝性分离组织使气管暴露,在气管上剪一个小口,插入插管并固定,连接小鼠肺功能仪。给予不同浓度的醋甲胆碱,记录各组小鼠气道阻力值。
1.4 BALF收集与EOS计数气道反应性测定结束后,用注射器将0.5 mL预冷的PBS通过气管插管注入肺组织中,然后抽出,重复3次,收集到的BALF经3 000 r/min离心10 min,收集上清用于测定炎症相关因子。细胞沉淀用50 μL PBS重悬,取10 μL用于EOS计数,重复计数5次。
1.5 血清中IgE测定各组小鼠进行眼眶采血,室温放置0.5 h后于37℃温育1 h,3 000 r/min离心10 min,收集上层血清。采用ELISA法检测血清中OVA特异性IgE含量,实验步骤严格按照说明书进行操作,根据吸光度(OD)值计算各组IgE的含量。
1.6 肺组织苏木精-伊红染色取小鼠右肺组织并用甲醛固定24 h,脱水后用石蜡进行包埋、切片、染色。在显微镜下(×200)观察并拍片。
1.7 炎症因子的检测取小鼠左肺组织,裂解肺组织块,采用ELISA法检测肺组织和BALF中IL-4、IL-5、IL-13和IFN-γ的含量,实验步骤严格按照说明书进行操作,根据吸光度(OD)值计算各组炎症因子水平。
1.8 实时荧光定量PCR检测HSF1 mRNA表达采用TRIzol试剂提取各组小鼠BALF和右肺组织总RNA,使用逆转录试剂盒将RNA逆转录为cDNA。引物由上海生工公司设计并合成。HSF1上游引物:5'-AAGTACTTCAAGCACAACAA-3',下游引物:5'-GAGATCAGGAACTGAATGAGC-3',片段长度410 bp;β-actin上游引物:5'-GGCTGTATTCC-CCTCCATCG-3',下游引物:5'-CCAGTTGGTAACA-ATGCCATGT-3',片段长度268 bp。PCR反应体系20 μL:2×SYBR Mix 10 μL,cDNA 0.5 μL,上下游引物各1 μL,灭菌蒸馏水7.5 μL。PCR反应条件:95℃ 45 s,59℃ 45 s,64℃ 50 s,72℃ 45 s,共25个循环;72℃延伸10 min。以β-actin为内参,目的基因的表达通过2-(△△CT)表示。
1.9 Western blot法检测HSF1、HMGB1及p-JNK表达取小鼠左肺舌叶组织,提取肺组织总蛋白,按照60 μg/孔的上样量在SDS-PAGE中分离,采用湿法转染将蛋白转至硝酸纤维素膜上,采用5%的牛奶封闭,4℃孵育HSF1、HMGB1、p-JNK、t-JNK和β-actin抗体过夜,TBST洗膜3次,室温孵育二抗1 h,TBST洗膜3次,用化学发光液孵育2 min左右,显色,扫描胶片,采用Image J软件统计目的条带OD值,以β-actin为内参,结果以目的蛋白OD值/内参蛋白OD值反映目的蛋白的相对表达水平。
1.10 统计学分析采用SPSS 11.0统计软件包对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
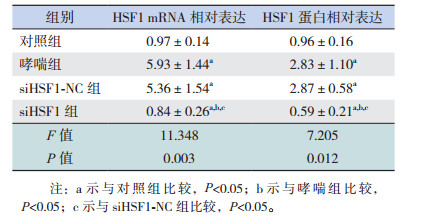
2 结果 2.1 各组小鼠肺组织病理情况与对照组相比,哮喘组小鼠支气管周围存在炎性细胞浸润,气道壁变厚。siHSF1-NC组与哮喘组相比无明显差异,均存在显著的炎性细胞浸润。与哮喘组相比,siHSF1组沉默HSF1后气道壁进一步增厚。见图 1。
|
图 1 各组小鼠肺组织病理染色(苏木精-伊红染色,×200) A为对照组,气道壁较薄;B为哮喘组,气道壁显著增厚;C为siHSF1-NC组,气道壁增厚,与哮喘组相比无明显差异;D为siHSF1组,与哮喘组相比,沉默HSF1后气道壁进一步增厚。 |
2.2 HSF1对小鼠哮喘气道高反应性的影响
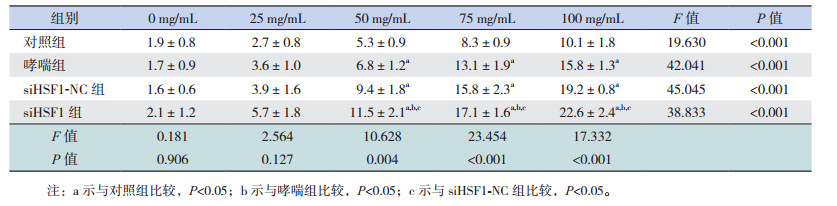
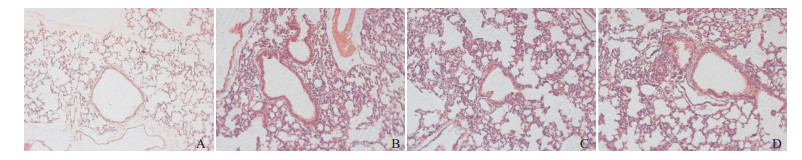
各组小鼠随着醋甲胆碱的浓度增大,小鼠气道反应性均逐步增加(P < 0.05)。醋甲胆碱浓度为50、75、100 mg/mL时,哮喘组和siHSF1-NC组气道反应性均高于对照组(P < 0.05),HSF1缺失导致气道高反应性进一步增强,均高于对照组、哮喘组和siHSF1-NC组(P < 0.05)。见表 1,图 2。
| 表 1 各组小鼠在不同醋甲胆碱浓度下气道阻力值的变化比较(n=9, x±s, cm H2O×s/mL) |
|
图 2 各组小鼠气道阻力值比较(n=9) |
2.3 HSF1对哮喘小鼠EOS计数的影响
各组小鼠EOS计数比较差异有统计学意义(F=37.379,P < 0.001)。与对照组(3.3±1.2)相比,哮喘组(29.3±3.8)和siHSF1-NC组(34.1±2.9)EOS计数增多(P < 0.05),且siHSF1-NC组EOS计数与哮喘组比较差异无统计学意义(P > 0.05)。siHSF1组EOS计数(55.2±5.0)较对照组、哮喘组和siHSF1-NC组均增加(P < 0.05),表明HSF1缺失导致哮喘小鼠EOS计数增多。
2.4 HSF1对哮喘小鼠血清特异性IgE水平的影响各组小鼠血清特异性IgE水平比较差异有统计学意义(F=11.348,P=0.003)。与对照组(20.0±1.3 ng/mL)相比,哮喘组(60.1±3.3 ng/mL)和siHSF1-NC组(65.4±4.6 ng/mL)血清特异性IgE增多(P < 0.05),且siHSF1-NC组血清特异性IgE水平与哮喘组比较差异无统计学意义(P > 0.05)。siHSF1组血清特异性IgE(92.6±2.5 ng/mL)较对照组、哮喘组和siHSF1-NC组均增加(P < 0.05),表明HSF1缺失导致哮喘小鼠血清特异性IgE水平升高。
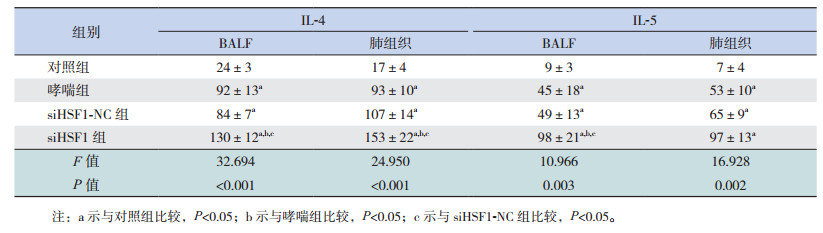
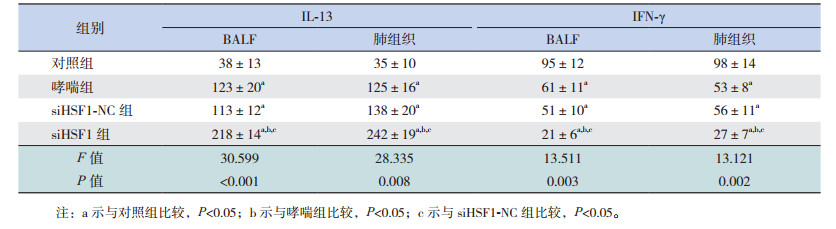
2.5 HSF1对哮喘小鼠肺组织和BALF中细胞因子水平的影响哮喘组和siHSF-NC组BALF中IL-4、IL-5、IL-13水平较对照组显著升高(P < 0.05),IFN-γ水平较对照组显著降低(P < 0.05),且siHSF1-NC组BALF中IL-4、IL-5、IL-13及IFN-γ水平与哮喘组比较差异无统计学意义(P > 0.05)。siHSF1组BALF中IL-4、IL-5、IL-13水平较对照组、哮喘组和siHSF-NC组均增加(P < 0.05),IFN-γ水平较对照组、哮喘组和siHSF1-NC组显著下降(P < 0.05)。表明HSF1缺失促进哮喘小鼠BALF中IL-4、IL-5和IL-13分泌并抑制IFN-γ的分泌。各组小鼠肺组织中IL-4、IL-5、IL-13及IFN-γ水平的表达变化趋势与BALF中基本一致,仅siHSF1组肺组织中IL-5水平虽高于哮喘组和siHSF1-NC组,但差异无统计学意义(P > 0.05)。见表 2~3。
| 表 2 各组小鼠肺组织和BALF中IL-4和IL-5水平比较(n=9, x±s, pg/mL) |
| 表 3 各组小鼠肺组织和BALF中IL-13和IFN-γ水平比较(n=9, x±s, pg/mL) |
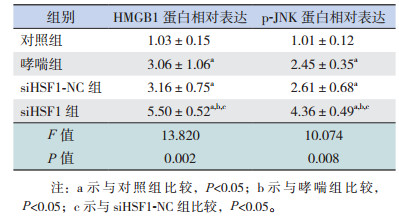
2.6 siHSF1对哮喘小鼠肺组织中HMGB1和JNK表达的影响
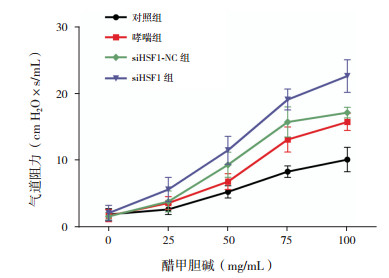
哮喘组和siHSF1-NC组HMGB1、p-JNK蛋白表达水平较对照组显著升高(P < 0.05),siHSF1-NC组与哮喘组比较,差异无统计学意义(P > 0.05),siHSF1组HMGB1和p-JNK蛋白表达水平较对照组、哮喘组和siHSF1-NC组均显著升高(P < 0.05)。结果表明HSF1缺失后HMGB1和p-JNK表达上调,提示HSF1加重哮喘高反应性和气道炎症可能是通过调控HMGB1和JNK实现的。见图 3,表 4。
|
图 3 Western blot检测各组肺组织中HMGB1和JNK的蛋白表达电泳条带图 |
| 表 4 各组小鼠肺组织中HMGB1和JNK水平比较(n=9, x±s) |
2.7 各组小鼠肺组织中HSF1的表达
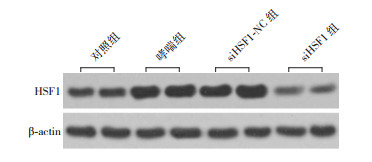
哮喘组和siHSF1-NC组HSF1 mRNA及蛋白表达水平较对照组均升高(P < 0.05),siHSF1-NC组与哮喘组比较差异无统计学意义(P > 0.05),siHSF1组HSF1 mRNA及蛋白表达水平较对照组、哮喘组和siHSF1-NC组均显著降低(P < 0.05)。结果表明,HSF1在哮喘小鼠中其mRNA和蛋白表达水平显著升高,siHSF1下调HSF1表达。见图 4,表 5。
|
图 4 Western blot检测各组肺组织中HSF1蛋白表达电泳条带图 |
| 表 5 各组小鼠肺组织中HSF1 mRNA和蛋白水平比较(n=9,x±s) |
3 讨论
HSF1能够被多种因素激活,在香烟烟雾诱导的慢性阻塞性肺疾病模型中,香烟烟雾处理1个月后模型组气道平滑肌细胞中HSF1表达水平显著升高[6]。本研究发现HSF1在哮喘小鼠肺组织中表达升高,与滕茂蓉等[4]的研究结果一致,提示HSF1在哮喘发生发展过程中发挥重要作用。
HSF1参与多种炎症性疾病发生发展,有报道HSF1基因敲除鼠表现出乳酸脱氢酶活性升高、呼吸参数Penh升高、中性粒细胞和巨噬细胞数目增多[7]。镉诱导肺损伤模型中,敲除HSF1基因小鼠BALF中巨噬细胞和中性粒细胞数目进一步增加[8]。与其结果一致,本研究证实HSF1缺失导致气道高反应性增强。LPS诱导的系统性炎症反应损伤中,敲除HSF1基因显著加重小鼠肺、肝脏和肾脏组织的中性粒细胞浸润[9]。OVA致敏的哮喘小鼠中EOS数目显著增加,而沉默HSF1后EOS数目进一步增多,同时OVA特异性IgE含量增加,表明HSF1缺失加重哮喘小鼠的气道高反应性,且EOS数目和IgE含量也增加。
哮喘的发病机制复杂,Th1/Th2细胞及细胞因子的比例失衡在哮喘发生过程中发挥重要的作用。Th1细胞主要分泌IFN-γ,Th2细胞主要分泌IL-4、IL-5和IL-13。生理状态下,Th1/Th2处于平衡状态,哮喘发生时,Th2细胞异常增加,Th1细胞减少,从而导致相关的炎症因子分泌的变化[10]。大量研究表明,HSF1在多种疾病中具有抗炎的作用。HSF1可通过诱导热休克蛋白表达间接发挥抗炎作用,也可通过直接与炎症因子基因的热休克原件结合或者调控相关的转录因子如NF-κB和AP-1等途径,抑制促炎因子的分泌和表达[11]。本研究发现,哮喘模型中,IL-4、IL-5和IL-13表达增多,沉默HSF1导致IL-4、IL-5和IL-13表达量进一步增加,同时IFN-γ表达量进一步减少。表明HSF1缺失加重哮喘小鼠的气道炎症反应。
HBGB1是存在于细胞核中的非组蛋白,能够主动分泌或者被动释放出胞外,在创伤、慢性炎症疾病、免疫性疾病和癌症中表达[12-13]。HMGB1在哮喘小鼠肺组织和BALF中表达升高[14],加重哮喘小鼠的气道重塑[15]。在甲苯二异氰酸酯诱导的哮喘模型中,丙酮酸乙酯能够通过负调控HMGB1减轻气道中性粒细胞浸润[16]。p-JNK在哮喘中表达上调,且抑制JNK激活降低哮喘小鼠EOS的产生[17]。表明HMGB1和JNK均参与哮喘发生发展,研究证实HMGB1能够持续激活JNK[18],气道上皮细胞中HMGB1通过激活JNK诱导黏蛋白8表达[19]。研究发现HSF1负调控HMGB1和JNK,在心肌细胞中过表达HSF1抑制HMGB1[20]。HSF1负调控JNK减少紫外线诱导的人角质形成细胞凋亡[21]。本研究发现,沉默HSF1,哮喘小鼠肺组织中的HMGB1和p-JNK表达显著升高,说明在哮喘损伤模型中,HSF1可能通过负调控HMGB1和JNK发挥作用。
据报道,HSF1在支原体感染肺炎模型中表达升高,HSF1缺失导致肺组织负荷增加、自免疫防御滞后[22]。在角叉菜诱导的胸膜炎模型中,HSF1表达升高,而抑制HSF1其炎症反应进一步加重[23]。表明HSF1在某些疾病中表达上调是机体的一种自我保护行为。本研究结果与之相近,HSF1在哮喘小鼠肺组织中表达上调,HSF1缺失导致气道高反应性和气道炎症进一步加重,表明HSF1在哮喘中表达升高在某种程度上缓解哮喘的发展。HSF1对哮喘的调控作用可能是通过HMGB1和JNK实现的。综上所述,HSF1可能可以作为一个靶分子,为哮喘的防治提供新的思路。
| [1] | To T, Wang C, Guan J, et al. What is the lifetime risk of physician-diagnosed asthma in Ontario, Canada[J]. Am J Respir Crit Care Med, 2010, 181 (4): 337–343. DOI:10.1164/rccm.200907-1035OC |
| [2] | Pawankar R, Canonica GW, Holgate ST, et al. Allergic diseases and asthma:a major global health concern[J]. Curr Opin Allergy Clin Immunol, 2012, 12 (1): 39–41. DOI:10.1097/ACI.0b013e32834ec13b |
| [3] | 吴畅, 任安经, 袁文俊, 等. 热休克转录因子1的抗炎症作用[J]. 生理科学进展, 2008, 39 (2): 151–154. |
| [4] | 滕茂蓉, 倪松石, 葛海燕. 热休克因子1在支气管哮喘中的表达[J]. 中华哮喘杂志(电子版), 2013, 7 (5): 311–314. |
| [5] | Medoff BD, Sauty A, Tager AM, et al. IFN-gamma-inducible protein 10(CXCL10) contributes to airway hyperreactivity and airway inflammation in a mouse model of asthma[J]. J Immunol, 2002, 168 (10): 5278–5286. DOI:10.4049/jimmunol.168.10.5278 |
| [6] | Xie J, Zhao J, Xiao C, et al. Reduced heat shock protein 70 in airway smooth muscle in patients with chronic obstructive pulmonary disease[J]. Exp Lung Res, 2010, 36 (4): 219–226. DOI:10.3109/01902140903349562 |
| [7] | Wirth D, Christians E, Li X, et al. Use of Hsf1(-/-) mice reveals an essential role for HSF1 to protect lung against cadmiuminduced injury[J]. Toxicol Appl Pharmacol, 2003, 192 (1): 12–20. DOI:10.1016/S0041-008X(03)00256-4 |
| [8] | Wirth D, Bureau F, Melotte D, et al. Evidence for a role of heat shock factor 1 in inhibition of NF-kappaB pathway during heat shock response-mediated lung protection[J]. Am J Physiol Lung Cell Mol Physiol, 2004, 287 (5): L953–L961. DOI:10.1152/ajplung.00184.2003 |
| [9] | Chen S, Zuo X, Yang M, et al. Severe multiple organ injury in HSF1 knockout mice induced by lipopolysaccharide is associated with an increase in neutrophil infiltration and surface expression of adhesion molecules[J]. J Leukoc Biol, 2012, 92 (4): 851–857. DOI:10.1189/jlb.0212060 |
| [10] | Shi YH, Shi GC, Wan HY, et al. Coexistence of Th1/Th2 and Th17/Treg imbalances in patients with allergic asthma[J]. Chin Med J (Engl), 2011, 124 (13): 1951–1956. |
| [11] | Ren WK, Yin J, Zhu XP, et al. Glutamine on intestinal inflammation:a mechanistic perspective[J]. Eur J Inflamm, 2013, 11 (2): 315–326. DOI:10.1177/1721727X1301100201 |
| [12] | Venereau E, De Leo F, Mezzapelle R, et al. HMGB1 as biomarker and drug target[J]. Pharmacol Res, 2016, 111 : 534–544. DOI:10.1016/j.phrs.2016.06.031 |
| [13] | Hou C, Zhao H, Liu L, et al. High mobility group protein B1(HMGB1) in Asthma:comparison of patients with chronic obstructive pulmonary disease and healthy controls[J]. Mol Med, 2011, 17 (7-8): 807–815. |
| [14] | Ma L, Zeng J, Mo B, et al. High mobility group box 1:a novel mediator of Th2-type response-induced airway inflammation of acute allergic asthma[J]. J Thorac Dis, 2015, 7 (10): 1732–1741. |
| [15] | Hou C, Kong J, Liang Y, et al. HMGB 1 contributes to allergeninduced airway remodeling in a murine model of chronic asthma by modulating airway inflammation and activating lung fibroblasts[J]. Cell Mol Immunol, 2015, 12 (4): 409–423. DOI:10.1038/cmi.2014.60 |
| [16] | Tang H, Zhao H, Song J, et al. Ethyl pyruvate decreases airway neutrophil infiltration partly through a high mobility group box 1-dependent mechanism in a chemical-induced murine asthma model[J]. Int Immunopharmacol, 2014, 21 (1): 163–170. DOI:10.1016/j.intimp.2014.04.024 |
| [17] | Kim HR, Lee DM, Lee SH, et al. Chlorogenic acid suppresses pulmonary eosinophilia, IgE production, and Th2-type cytokine production in an ovalbumin-induced allergic asthma:activation of STAT-6 and JNK is inhibited by chlorogenic acid[J]. Int Immunopharmacol, 2010, 10 (10): 1242–1248. DOI:10.1016/j.intimp.2010.07.005 |
| [18] | Zhao M, Yang M, Yang L, et al. HMGB1 regulates autophagy through increasing transcriptional activities of JNK and ERK in human myeloid leukemia cells[J]. BMB Rep, 2011, 44 (9): 601–606. DOI:10.5483/BMBRep.2011.44.9.601 |
| [19] | Kim DE, Min KJ, Kim JS, et al. High-mobility group box-1 protein induces mucin 8 expression through the activation of the JNK and PI3K/Akt signal pathways in human airway epithelial cells[J]. Biochem Biophys Res Commun, 2012, 421 (3): 436–441. DOI:10.1016/j.bbrc.2012.03.131 |
| [20] | Yu Y, Liu M, Zhang L, et al. Heat shock transcription factor 1 inhibits H2O2-induced cardiomyocyte death through suppression of high-mobility group box 1[J]. Mol Cell Biochem, 2012, 364 (1-2): 263–269. DOI:10.1007/s11010-012-1226-x |
| [21] | 王晓雯, 王春波, 李丙华, 等. HSF1/HSP70通路抑制c-Jun氨基末端激酶的活化保护UVA诱导的HaCa T细胞凋亡[J]. 卫生研究, 2012, 41 (1): 40–45. |
| [22] | Gally F, Minor MN, Smith SK, et al. Heat shock factor 1 protects against lung mycoplasma pneumoniae infection in mice[J]. J Innate Immun, 2012, 4 (1): 59–68. DOI:10.1159/000333089 |
| [23] | Ianaro A, Ialenti A, Maffia P, et al. HSF1/hsp72 pathway as an endogenous anti-inflammatory system[J]. FEBS Lett, 2001, 499 (3): 239–244. DOI:10.1016/S0014-5793(01)02569-8 |
 2017, Vol. 19
2017, Vol. 19