新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是新生儿期常见的疾病,可以造成远期神经系统损害,目前尚无特效疗法。神经干细胞是神经系统中一类具有自我更新功能的细胞,在胎儿和新生儿的神经系统中广泛存在。缺氧缺血损伤后,神经元等细胞数量减少,此时主要依赖神经干细胞进行增殖并分化来进行后期修复,因此促进神经干细胞增殖与存活对于神经系统功能修复有着重要的意义。
黄芪甲苷和环黄芪醇(cycloastragenol, CAG)是黄芪的主要有效成分,后者已被证实能够有效激发端粒酶活性[1]。端粒酶是一种RNA依赖的DNA多聚酶,主要由端粒酶逆转录酶(telomerase reverse transcriptase, TERT)和端粒酶RNA组成,前者以后者为模板来合成DNA,从而维持端粒的长度[2]。端粒酶在大多数肿瘤细胞和永生化细胞中都有活性;正常组织细胞则缺乏端粒酶活性。有研究表明,黄芪甲苷可以增加神经元的端粒酶活性,在动物模型上体现出抗凋亡作用;CAG在多种细胞如HEK293,成纤维细胞中体现了促进细胞增殖的作用[3-9],但尚无对神经干细胞功能影响的研究报道。本研究选择大鼠神经干细胞进行氧糖剥夺(oxygen-glucose deprivation, OGD)处理以模拟体内神经干细胞缺氧缺血的状态,探讨CAG对神经干细胞增殖能力的影响及可能的机制,为采用端粒酶激活剂治疗缺氧缺血脑损伤奠定基础。
1 材料与方法 1.1 主要试剂与仪器CAG购于成都锦泰和医药化学技术有限公司;DMEM/F12-GLUMAX、B27、bFGF、青霉素/链霉素双抗(Life公司,美国);肝素钠、葡萄糖(Sigma公司,美国);大鼠TERT抗体(Mililipore公司,美国);大鼠β-actin抗体、山羊抗小鼠二抗、山羊抗兔二抗(CST公司,美国);Annexin V-PI凋亡检测试剂盒、LDH试剂盒(江苏凯基公司);Edu试剂盒(广东锐博公司);端粒酶检测试剂盒(Roche公司,美国)。PCR仪、电泳仪(Bio-Rad公司,美国);倒置显微镜(Olympus公司,日本);多功能酶标仪(Thermofisher公司,美国)。
1.2 神经干细胞的培养以及分组大鼠神经干细胞系L2.3由四川大学华西第二医院李赫东构建并馈赠[10]。取相同代次(2~3代)的L2.3细胞,用含DMEM/F12-GLUMAX、2% B27、100 ng/mL bFGF、1 μg/mL肝素钠、25 mmol/L葡萄糖、2%青霉素/链霉素双抗的培养基,于37℃、20% O2、10% CO2的培养箱中培养,待细胞生长达70%~80%时传代。
为了探究CAG对正常培养的大鼠神经干细胞生物行为学的影响,将细胞密度调节为1×105/mL,分为对照组,高浓度CAG组和低浓度CAG组。高浓度CAG组加入终浓度为25 μM的CAG,低浓度CAG组加入终浓度为10 μM的CAG,CAG溶解于二甲基亚砜(DMSO),对照组只加入等量DMSO,于37℃、20% O2、10% CO2的培养箱中培养后在不同时间点收集各组细胞和培养基进行后续实验。
为了探究CAG对OGD后大鼠神经干细胞生物行为学的影响,将细胞密度调节为1×105/mL,分为对照组、OGD组、OGD+高浓度CAG组和OGD+低浓度CAG组。培养12 h后,高浓度CAG组加入终浓度为25 μM的CAG,低浓度CAG组加入终浓度为10 μM的CAG,CAG溶解于二甲基亚砜(DMSO)。将OGD组、高浓度CAG组、低浓度CAG组细胞重悬于不含糖的培养基中,置于37℃、1% O2、10% CO2的培养箱中培养;对照组只加入等量DMSO不进行OGD处理。OGD后在不同时间点收集细胞和培养基进行后续实验。
1.3 Western blot法检测神经干细胞TERT蛋白的表达正常培养和OGD后24、48、72 h,收集上述各组细胞,每组平行设3个样本。加入250 μL新鲜配制含蛋白酶抑制剂的裂解液。超声处理若干次后,冰上静置30 min后用冰冻离心机以14 000 r/min离心30 min,并收取上清液。使用BCA试剂盒测定并计算蛋白浓度。SDS-PAGE每孔上样量为30 μg。电泳和转膜后使用5%脱脂奶粉室温封闭2.5 h。使用1:5 000稀释的小鼠抗大鼠β-actin和1:1 000稀释的兔抗大鼠TERT一抗孵育条带,4℃过夜。TBST洗膜3次,每次5 min,加入1:3 000稀释的山羊抗小鼠和山羊抗兔的二抗,室温孵育2 h。TBST洗涤2次,曝光后显示条带。用Quantity One分析条带,结果以目的蛋白灰度值与内参蛋白灰度值的比值表示。实验重复3次。
1.4 TRAP法检测端粒酶活性OGD后24、48、72 h,收集上述各组细胞,每组平行设3个样本。按试剂盒说明书操作,提取端粒酶并扩增端粒重复片段TTAGGG,扩增后的产物与地高辛标记的特异性探针杂交,再用抗地高辛的抗体检测杂交产物,最终将过氧化物酶与抗地高辛抗体结合显色,通过检测吸光光度值评价端粒酶活性。实验重复3次。
1.5 细胞计数正常培养和OGD后24、48、72 h收集上述各组细胞,重悬于1 mL PBS中,使用细胞计数板进行计数。实验重复3次。
1.6 倒置显微镜测量神经球直径正常培养和OGD后24、48、72 h收集上述各组细胞,每组平行设3个样本。在显微镜下拍照,每组每个样本按照12点、3点、6点、9点和中心5个位置选取视野拍照,共取50个神经球进行观察,采用Image J软件测量神经球直径。实验重复3次。
1.7 流式细胞术检测细胞增殖正常培养和OGD后24、48、72 h收集上述各组细胞,每组平行设3个样本,检测细胞增殖率。实验步骤按照说明书进行操作,以1:5 000 Edu终浓度孵育过夜,上流式细胞仪检测结果。实验重复3次。
1.8 化学发光法检测培养基中乳酸脱氢酶活性OGD后24、48、72 h收集上述各组细胞培养基,每组平行设3个样本。按照试剂盒说明书要求,将20 μL培养基与乳酸反应后再和2, 4-硝基苯肼反应生成棕红色丙酮酸二硝基苯腙,通过检测吸光度判断乳酸脱氢酶(LDH)活力。实验重复3次。
1.9 流式细胞术检测OGD后细胞凋亡情况OGD后24、48、72 h,使用不含EDTA的胰酶消化后,收集上述各组细胞,每组平行设3个样本。按照试剂盒说明书进行Annexin V-PI双染色,使用流式细胞仪检测细胞凋亡情况。实验重复3次。
1.10 统计学分析采用SPSS 19.0统计软件对数据进行统计学分析。符合正态分布的数据采用均数±标准差(x±s)表示,多组间比较采用方差分析,组间两两比较采用SNK-q检验。不符合正态分布的数据采用中位数(四分位间距)[P50(P25, P75)]表示,多组间比较采用Jonckheere-Terpstra检验,组间两两比较采用Jonckheere-Terpstra test followed by stepwise step-down comparisons方法。P < 0.05为差异有统计学意义。
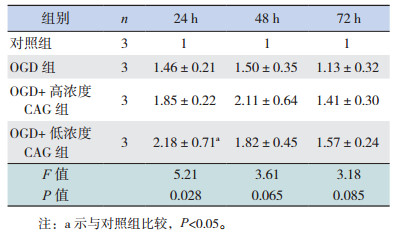
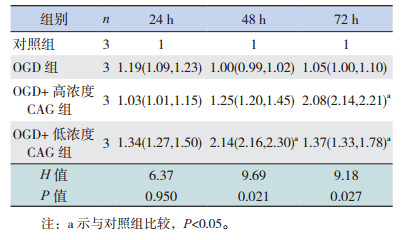
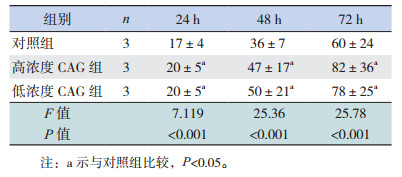
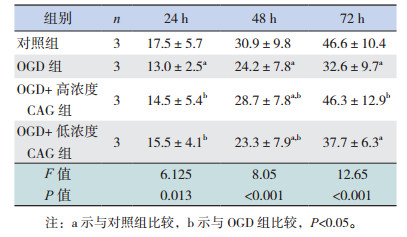
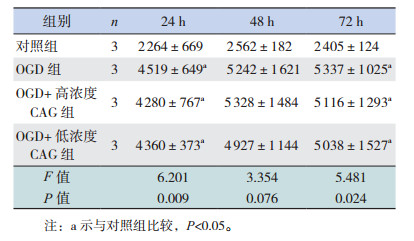
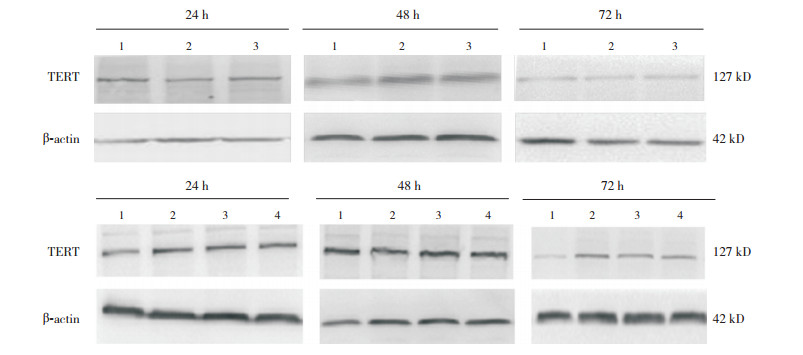
2 结果 2.1 不同浓度CAG对TERT表达的影响不同浓度CAG处理正常培养的细胞24 h时,各组TERT表达差异无统计学意义(P > 0.05);48 h时低浓度组TERT表达水平显著高于对照组和高浓度组(P < 0.05);72 h时高浓度和低浓度CAG组TERT表达水平均高于对照组(P < 0.05),且TERT表达水平在高浓度和低浓度CAG组间比较差异无统计学意义(P > 0.05)(图 1,表 1)。经OGD处理后,不同浓度CAG处理OGD细胞24 h时,低浓度CAG组TERT表达水平高于对照组(P < 0.05);48 h及72 h各组TERT表达水平差异均无统计学意义(P > 0.05)(图 1,表 2)。
|
图 1 Western blot检测CAG对TERT表达的影响 上图为CAG在正常培养条件下对TERT表达的影响;1:对照组,2:高浓度CAG组,3:低浓度CAG组。下图为CAG在OGD处理条件下对TERT表达的影响;1:对照组,2:OGD组,3:OGD+高浓度CAG组,4:OGD+低浓度CAG组。 |
| 表 1 CAG对正常培养神经干细胞TERT相对表达水平的影响(x±s) |
| 表 2 CAG对OGD后神经干细胞TERT相对表达水平的影响(x±s) |
2.2 不同浓度CAG对OGD后神经干细胞端粒酶活性的影响
不同浓度CAG处理OGD细胞,其中低浓度CAG组在48 h,高浓度和低浓度CAG组在72 h端粒酶活性均高于对照组(P < 0.05),见表 3。
| 表 3 CAG对端粒酶相对活性的作用[P50(P25, P75)] |
2.3 不同浓度CAG对神经干细胞数目的影响
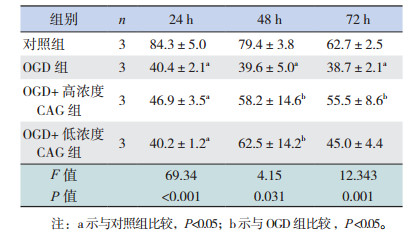
正常培养状态下,与对照组相比,CAG可以促进神经干细胞数目增加,在48 h和72 h效果较为显著(P < 0.05),不同浓度CAG组间比较神经干细胞数目差异无统计学意义(P > 0.05)(表 4)。在OGD处理的细胞中,与OGD组相比,低浓度CAG组细胞在24 h时神经干细胞数目增多(P < 0.05);而48 h和72 h时高浓度和低浓度CAG组细胞数目与OGD组相比差异无统计学意义(P > 0.05),且均低于对照组(P < 0.05)(表 5)。
| 表 4 CAG对正常培养神经干细胞数目的影响(x±s,×105) |
| 表 5 CAG对OGD后神经干细胞数目的影响(x±s,×106) |
2.4 不同浓度CAG对神经球直径的影响
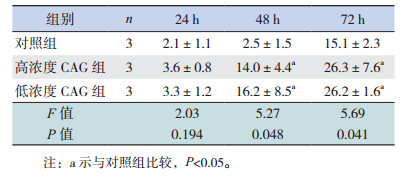
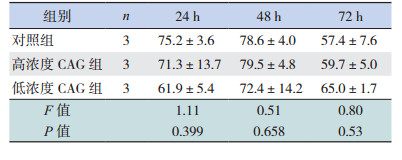
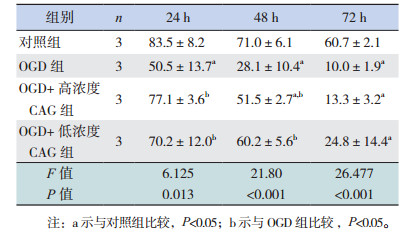
正常培养条件下,CAG处理后不同时间点,与对照组相比,高浓度和低浓度CAG组的神经球直径显著增大(P < 0.05),不同浓度CAG组间比较差异无统计学意义(P > 0.05)(表 6)。在OGD处理的细胞中,CAG处理72 h后,与OGD组相比,高浓度CAG组表现出比较好的促神经球直径增大效果(P < 0.05)(表 7)。
| 表 6 CAG对正常培养神经球直径的影响(x±s,μm) |
| 表 7 CAG对OGD后神经球直径的影响(x±s,μm) |
2.5 不同浓度CAG对神经干细胞增殖率的影响
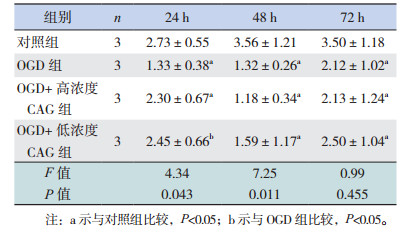
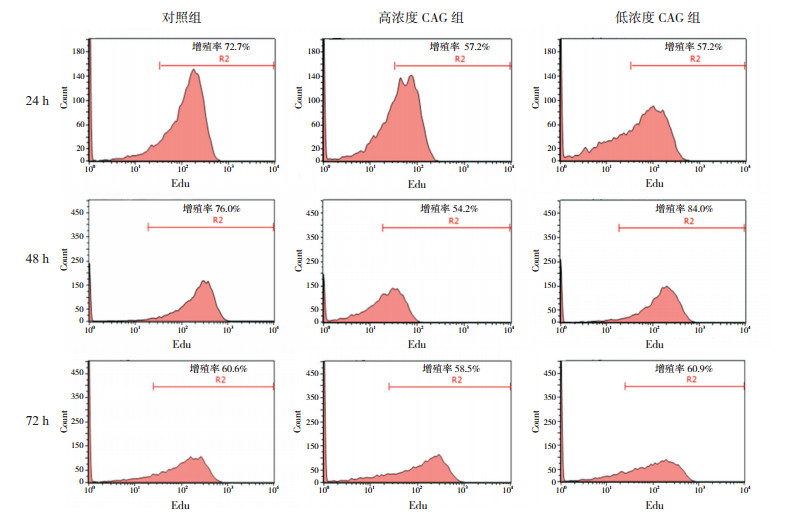
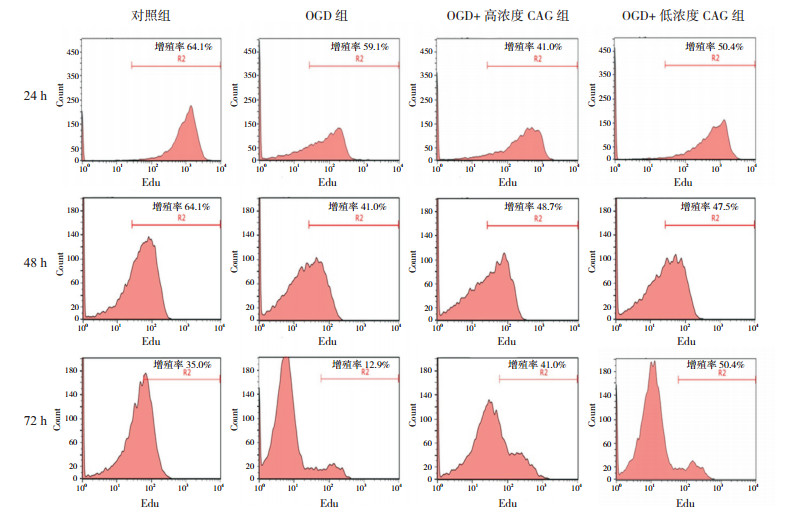
正常培养条件下,不同时间点各组神经干细胞增殖率比较差异均无统计学意义(P > 0.05),即CAG处理后并不能显著促进细胞的增殖率(图 2,表 8)。经OGD处理后,与OGD组相比,不同浓度CAG组在24 h和48 h时细胞增殖率显著增高(P < 0.05)(图 3,表 9)。
| 表 8 CAG对正常培养神经干细胞增殖率的影响(x±s) |
| 表 9 CAG对OGD后神经干细胞增殖率的影响(x±s) |
|
图 2 流式细胞术检测CAG对正常培养细胞增殖率的影响 R2下面积反映处于增殖状态的细胞数量。 |
|
图 3 流式细胞术检测CAG对OGD后细胞增殖率的影响 R2下面积反映处于增殖状态的细胞数量。 |
2.6 不同浓度CAG对OGD后LDH活性的影响
不同时间点,经OGD处理后各组LDH释放量均高于对照组,但仅24 h和72 h时差异有统计学意义(P < 0.05);不同时间点,经OGD处理后各组间LDH释放量比较差异无统计学意义(P > 0.05)(表 10)。
| 表 10 CAG对OGD后细胞释放LDH的影响(x±s,U/L) |
2.7 不同浓度CAG对OGD后细胞存活率的影响
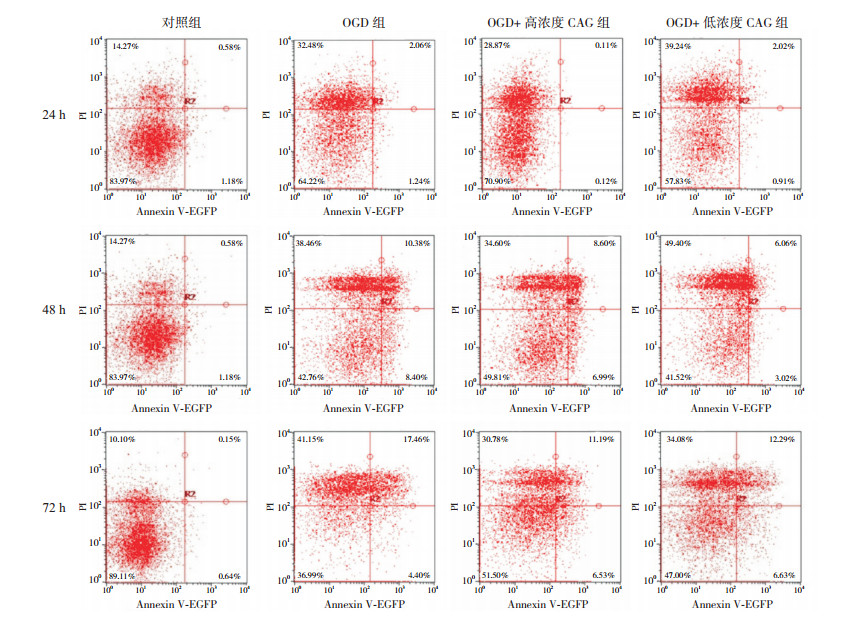
与对照组相比,OGD处理后的细胞存活率显著下降(P < 0.05),细胞主要死亡方式为坏死,少量细胞存在凋亡。CAG处理可以增加细胞的存活率,与OGD组相比,48 h各CAG处理组细胞存活率都显著增加,72 h高浓度CAG组细胞存活率显著增加(P < 0.05)(图 5,表 11)。
|
图 5 流式细胞术检测CAG对OGD后细胞存活率的影响 左下象限反映细胞存活率。 |
| 表 11 CAG对OGD后细胞存活率的影响(x±s) |
3 讨论
HIE是常见的导致新生儿死亡和残疾的原因,中到重度的HIE患儿往往预后不理想。既往研究表明,在动物模型上移植神经干细胞可以有效减轻疾病导致的脑损伤,改善神经系统功能[11-13]。但是干细胞移植存在着来源有限、免疫排斥和致肿瘤风险等缺点。在胚胎和新生儿脑中存在着大量神经干细胞,因此与干细胞移植相比,促进内源性神经干细胞增殖不失为一种理想的治疗手段。
本实验以神经干细胞L2.3细胞为研究对象,检测端粒酶激活剂CAG在缺氧缺血刺激下对其增殖能力和存活情况的影响。长时间OGD处理后,细胞的增殖活性减弱,数目减少,存活率下降。CAG处理可以促进OGD后细胞增殖,减少细胞死亡。对正常培养的细胞,CAG也有促神经球直径和数目增加的效果。值得注意的是,细胞计数和神经球直径测量结果不完全吻合,可能的原因是神经球长到一定程度时,中心的细胞营养不足容易死亡,最终导致神经球直径增长与细胞数目增长不完全一致。
CAG在正常培养和OGD的条件下均可增加TERT的表达。在正常培养下,CAG的促TERT表达、促增殖等作用在不同浓度间没有差异;在OGD条件下,不同浓度CAG处理表现出一定的差异。有报道称TERT的激活具有抗凋亡的效果,TERT能够减少缺氧缺血后神经元中的活化型Caspase 3,调节Bax/Bcl2表达来发挥抗凋亡作用[14-16]。本实验中,Annexin V-PI荧光双染结果提示缺氧缺血诱导的神经干细胞L2.3主要以坏死的方式发生死亡。CAG处理能够增加OGD后细胞存活率,提示端粒酶激活不仅能够对抗凋亡,对坏死等其他细胞死亡方式也有对抗作用。LDH检测提示CAG并不减少细胞裂解数目,但是能够减少细胞裂解的比例。
既往研究发现TERT表达增加可以减少细胞ROS激活,是细胞对抗死亡的主要原因[6, 15, 17]。另有研究发现,有端粒酶活性的细胞可以分泌含有端粒酶TERT mRNA的外泌体。正常组织细胞摄入这种外泌体后呈现端粒酶激活状态,并且表现出抗DNA损伤的作用[18]。这种作用可能是TERT直接与引物酶结合促进核酸修复实现的。在神经干细胞L2.3中,CAG是否也通过ROS途径对抗细胞死亡,能否抗DNA损伤值得进一步研究。
综上所述,CAG能够显著促进神经干细胞增殖,减少缺氧缺血诱导的细胞死亡,提示端粒酶激活剂有望用于缺氧缺血后脑损伤的治疗。其保护作用涉及的分子机制及相关信号通路尚需进一步研究。
| [1] | Ip FC, Ng YP, An HJ, et al. Cycloastragenol is a potent telomerase activator in neuronal cells:implications for depression management[J]. Neurosignals, 2014, 22 (1): 52–63. DOI:10.1159/000365290 |
| [2] | Wesch NL, Burlock LJ, Gooding RJ. Critical telomerase activity for uncontrolled cell growth[J]. Phys Biol, 2016, 13 (4): 046005. DOI:10.1088/1478-3975/13/4/046005 |
| [3] | Zhao Y, Li Q, Zhao W, et al. Astragaloside Ⅳ and cycloastragenol are equally effective in inhibition of endoplasmic reticulum stress-associated TXNIP/NLRP3 inflammasome activation in the endothelium[J]. J Ethnopharmacol, 2015, 169 : 210–218. DOI:10.1016/j.jep.2015.04.030 |
| [4] | Yung LY, Lam WS, Ho MK, et al. Astragaloside Ⅳ and cycloastragenol stimulate the phosphorylation of extracellular signal-regulated protein kinase in multiple cell types[J]. Planta Med, 2012, 78 (2): 115–121. DOI:10.1055/s-0031-1280346 |
| [5] | Xu ME, Xiao SZ, Sun YH, et al. Effects of astragaloside Ⅳ on pathogenesis of metabolic syndrome in vitro[J]. Acta Pharmacol Sin, 2006, 27 (2): 229–236. DOI:10.1111/aphs.2006.27.issue-2 |
| [6] | Luo Y, Qin Z, Hong Z, et al. Astragaloside Ⅳ protects against ischemic brain injury in a murine model of transient focal ischemia[J]. Neurosci Lett, 2004, 363 (3): 218–223. DOI:10.1016/j.neulet.2004.03.036 |
| [7] | Zhang WJ, Hufnagl P, Binder BR, et al. Antiinflammatory activity of astragaloside Ⅳ is mediated by inhibition of NFkappaB activation and adhesion molecule expression[J]. Thromb Haemost, 2003, 90 (5): 904–914. |
| [8] | Sun J, Chen XL, Zheng JY, et al. Astragaloside Ⅳ protects new born rats from anesthesia-induced apoptosis in the developing brain[J]. Exp Ther Med, 2016, 12 (3): 1829–1835. |
| [9] | Fauce SR, Jamieson BD, Chin AC, et al. Telomerase-based pharmacologic enhancement of antiviral function of human CD8+T lymphocytes[J]. J Immunol, 2008, 181 (10): 7400–7406. DOI:10.4049/jimmunol.181.10.7400 |
| [10] | Li H, Babiarz J, Woodbury J, et al. Spatiotemporal heterogeneity of CNS radial glial cells and their transition to restricted precursors[J]. Dev Biol, 2004, 271 (2): 225–238. DOI:10.1016/j.ydbio.2004.02.028 |
| [11] | Castillo-Melendez M, Yawno T, Jenkin G, et al. Stem cell therapy to protect and repair the developing brain:a review of mechanisms of action of cord blood and amnion epithelial derived cells[J]. Front Neurosci, 2013, 7 : 194. |
| [12] | Hsueh YY, Chang YJ, Huang CW, et al. Synergy of endothelial and neural progenitor cells from adipose-derived stem cells to preserve neurovascular structures in rat hypoxic-ischemic brain injury[J]. Sci Rep, 2015, 5 : 14985. DOI:10.1038/srep14985 |
| [13] | Tajiri N, Acosta SA, Shahaduzzaman M, et al. Intravenous transplants of human adipose-derived stem cell protect the brain from traumatic brain injury-induced neurodegeneration and motor and cognitive impairments:cell graft biodistribution and soluble factors in young and aged rats[J]. J Neurosci, 2014, 34 (1): 313–326. DOI:10.1523/JNEUROSCI.2425-13.2014 |
| [14] | 李益清, 尹松梅, 冯思琼, 等. 丙戊酸诱导白血病HL-60细胞凋亡及其对h-tert基因表达的影响[J]. 中国实验血液学杂志, 2010, 18 (6): 1445–1450. |
| [15] | Li J, Qu Y, Chen D, et al. The neuroprotective role and mechanisms of TERT in neurons with oxygen-glucose deprivation[J]. Neuroscience, 2013, 252 : 346–358. DOI:10.1016/j.neuroscience.2013.08.015 |
| [16] | Zhao F, Qu Y, Xiong T, et al. The neuroprotective role of TERT via an antiapoptotic mechanism in neonatal rats after hypoxiaischemia brain injury[J]. Neurosci Lett, 2012, 515 (1): 39–43. DOI:10.1016/j.neulet.2012.03.014 |
| [17] | Liu Q, Sun Y, Lv Y, et al. TERT alleviates irradiation-induced late rectal injury by reducing hypoxia-induced ROS levels through the activation of NF-κB and autophagy[J]. Int J Mol Med, 2016, 38 (3): 785–793. |
| [18] | Gutkin A, Uziel O, Beery E, et al. Tumor cells derived exosomes contain hTERT mRNA and transform nonmalignant fibroblasts into telomerase positive cells[J]. Oncotarget, 2016, 7 (37): 59173–59188. |
 2017, Vol. 19
2017, Vol. 19