脓毒症是国际性的医学难题,具有高发病率、高病死率的特点[1],且目前全球脓毒症的年患病人数仍在增加[2]。脓毒症患者一旦发展为重症脓毒症和脓毒性休克,病死率可分别高达25%~30%和40%~70%。乌司他丁(UTI)是一种临床上用于抗急性组织损伤、减弱炎症损害的尿胰蛋白酶抑制剂,有报道UTI可改善脓毒症患者免疫、心脏及其他各脏器功能[3-5]。
早期诊断及新药物治疗成为改善脓毒症治愈率并降低病死率的新突破点。脓毒症炎症反应过程中,肿瘤坏死因子-α(TNF-α)是经典的炎症因子[6],P-选择素、凝血酶抗凝血酶复合物(TAT)被认为是凝血功能早期改变的指标。随着活性蛋白C的退市,目前尚无明确药物用于预防性治疗脓毒症。而目前对脓毒症幼鼠的研究极少,且无早期使用药物干预脓毒症幼鼠的相关研究。
本研究通过早期使用UTI干预脓毒症幼鼠,分6、12、24 h 3个时间段检测TNF-α、P-选择素和TAT,探讨早期使用药物干预对TNF-α、P-选择素和TAT的影响。
1 材料与方法 1.1 实验动物选用4周龄健康清洁级雄性Sprague-Dawley大鼠120只,体重120±20 g,由南昌大学医学院实验动物部提供,合格证书:SYXK(赣2010-0002)。分笼饲养,饲养环境温度20±2℃、相对湿度为60%~80%、通风良好、12 h:12 h光-暗周期,适应饲养1周,自由活动。术前12 h禁食,自由饮水。
1.2 实验分组及脓毒症模型建立鼠类盲肠结扎穿孔法(CLP)模仿临床阑尾炎穿孔或憩室炎穿孔的特点,并一直被认为是建立脓毒症动物模型的经典方法[7]。将120只雄性大鼠术前12 h禁食、自由饮水,称重并记录,按随机数字表法分为正常对照组、假手术组、脓毒症组、低剂量UTI干预组、高剂量UTI干预组,每组24只。其中正常对照组不予任何处理;假手术组依次行开腹、翻动肠管、牵拉盲肠、关腹;脓毒症组行CLP术建立脓毒症模型,以3.3%水合氯醛(10 mL/kg)腹腔注射麻醉,麻醉后使其仰卧于固定板上,四肢以橡皮筋或图钉予以固定,自剑突至会阴部之间的上1/3处始,向下沿腹正中线作一长1.5 cm左右的纵向切口,逐层分离组织至腹腔,找到盲肠,距末端1/2处用2-0手术丝线结扎盲肠,以18号针贯穿结扎末端2次,还纳盲肠入腹,逐层缝合手术切口。术中注意保持肠壁湿润,分离盲肠及穿孔时避免损伤肠系膜血管。术毕后立即皮下注射生理盐水(30 mL/kg[8])抗休克;低剂量和高剂量UTI干预组行CLP术建立脓毒症模型后立即皮下注射生理盐水抗休克,分别尾静脉注射UTI(广东天普生化医药股份有限公司)50 000 U/kg及200 000 U/kg干预;其他组尾静脉注射等量生理盐水替代。每组24只大鼠随机再分为6、12、24 h亚组,每亚组8只。
1.3 标本采集分别于术后或建模后6、12、24 h心脏取血5~6 mL至促凝管中静置20 min后,1 000 r/min离心20 min,取血清,-20℃冰箱冷冻保存,依次行TNF-α、P-选择素、TAT的ELISA检测(试剂盒购于武汉Elabscience生物科技有限公司)。
1.4 统计学分析采用SPSS 19.0统计软件对数据进行统计学分析,符合正态分布的计量资料以均数±标准差(x±s)表示,多组间样本均数的比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
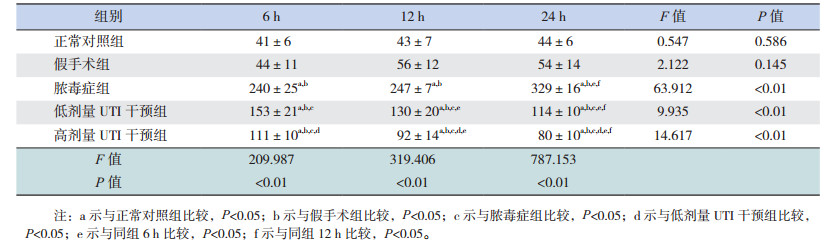
2 结果 2.1 UTI对脓毒症大鼠血清TNF-α水平的影响各时间点正常对照组和假手术组TNF-α水平比较差异均无统计学意义(P > 0.05);脓毒症组与假手术组相比较,TNF-α水平在6 h即出现明显增高(P < 0.05),并且随时间的进展,呈进行性上升趋势(P < 0.01);低剂量UTI干预组TNF-α水平在6 h同样出现明显的增高,但增高程度低于脓毒症组,且在12 h及24 h两个时间点TNF-α水平逐渐降低(P < 0.05);高剂量UTI干预组TNF-α水平变化趋势与低剂量UTI干预组相同,但与低剂量UTI干预组相比较,高剂量UTI干预组TNF-α水平在6、12、24 h均降低(P < 0.05)。见表 1。
| 表 1 不同时间点各组大鼠TNF-α水平比较(x±s, n=8, ng/L) |
2.2 UTI对脓毒症大鼠血清P-选择素水平的影响
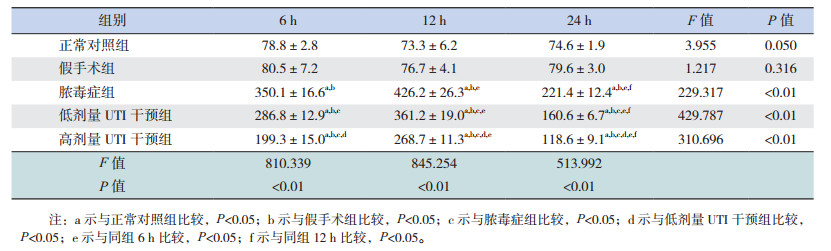
正常对照组、假手术组血清P-选择素水平比较差异无统计学意义(P > 0.05)。脓毒症组P-选择素水平在6 h即出现明显增高(P < 0.05),在12 h达高峰,并于24 h出现回落(P < 0.01);低剂量UTI干预组P-选择素水平在6 h同样出现明显增高,但增高程度低于脓毒症组,且在12 h及24 h两个时间点变化规律与脓毒症组相同,与脓毒症组相较,低剂量UTI干预组各时间点P-选择素水平均明显低于脓毒症组同时间点(P < 0.05);高剂量UTI干预组P-选择素水平变化趋势与低剂量UTI干预组相同,但与低剂量UTI干预组相比较,高剂量UTI干预组P-选择素水平在6、12、24 h均降低(P < 0.05)。见表 2。
| 表 2 不同时间点各组大鼠P-选择素水平比较(x±s, n=8, μg/L) |
2.3 UTI对脓毒症大鼠血清TAT水平的影响
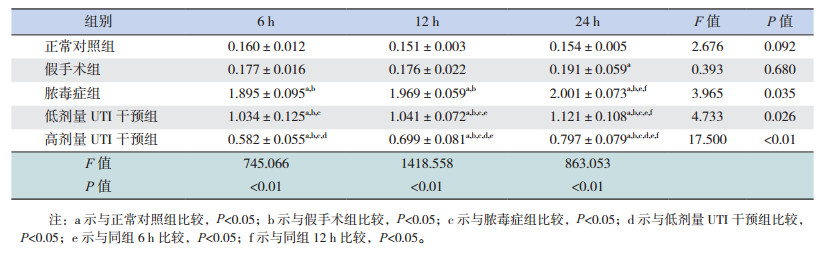
正常对照组、假手术组血清TAT水平比较差异无统计学意义(P > 0.05),脓毒症组TAT水平在6 h出现明显的增高(P < 0.05),随着时间的进展于24 h达最高峰,脓毒症组各时间点比较差异有统计学意义(P < 0.05),低剂量UTI干预组TAT水平在6 h同样出现增高,但增高程度低于脓毒症组,且在12 h及24 h两个时间点变化规律与脓毒症组相同,与脓毒症组相较,低剂量UTI干预组各时间点TAT水平均明显低于脓毒症组同时间点(P < 0.05);高剂量UTI干预组TAT水平变化趋势与低剂量UTI干预组相同,与低剂量UTI干预组相比较,高剂量UTI干预组TAT值在6、12、24 h均降低(P < 0.05)。见表 3。
| 表 3 不同时间点各组大鼠TAT水平比较(x±s, n=8, μg/L) |
3 讨论
脓毒症是指由感染导致、伴发多器官功能不全的炎症反应。该病发病率、病死率高,严重威胁人类健康[9]。脓毒症在疾病的各个阶段都存在着促炎和抗炎功能紊乱导致的免疫失衡[10]。免疫失衡可诱发多脏器功能损害及免疫功能抑制,是脓毒症治疗的首要难题。免疫调节治疗可以调控这种免疫失衡,从而减轻自身炎症反应造成的伤害。在探索过程中,很多拮抗单一位点的免疫调控药物均无效果,因此调控位点更高的药物如UTI成为研究重点。
感染和炎症是脓毒症的主要原因,脓毒症主要表现为感染和全身性炎症反应,过程中常同时发生凝血功能障碍,且出现凝血功能障碍的严重程度常与疾病预后密切相关。脓毒症早期炎症介质刺激凝血系统活化,同时,凝血系统活化可促进炎症的进一步发展,形成正反馈循环,从而加剧脓毒症的恶化。炎症因子TNF-α是引起脓毒症的关键炎症介质之一,是炎症的启动因子,通过炎性反应因子级联反应激活、释放更多炎症介质,形成“瀑布效应”,最终导致多器官障碍综合征的发生,TNF-α通过激活NF-κB使内皮细胞、巨噬细胞等炎性细胞上调组织因子(TF)的表达与释放,从而启动外源凝血系统。
在内皮细胞损伤或其他病理情况下,“静止”的血小板被激活,P-选择素是选择素家族中具有代表性的黏附分子之一,被认为是血小板活化的金标准,目前所知是反映血小板活化最特异的标志物,同时是内皮细胞活化的重要标志物,通过介导血小板、内皮细胞黏附及对白细胞的相互作用,推动了多种病理过程的进展(包括炎症和血栓形成等),也是启动炎症反应并维持炎症状态的重要成分。P-选择素可作为内皮细胞损伤和血小板活化的标志[11],是炎症、血栓的重要介质和靶分子,P-选择素因一系列的炎性因子如终末补体C56-9复合物、活性氧和凝血酶等刺激出现反应性增高,并在急性炎症早期促进内皮细胞其他黏附分子表达上调。
组织因子介导的凝血酶的产生是炎症放大凝血作用的主要途径之一,TAT是凝血酶与抗凝血酶的结合物,被认为是凝血系统激活的敏感标志物,可直接反映凝血酶产生及抗凝物AT-Ⅲ的消耗,在正常情况下,TAT与AT-Ⅲ呈动态平衡,DIC时体内凝血和抗凝血系统均被激活致使血浆TAT水平明显增高;在本次实验中,TAT在脓毒症早期即出现显著改变,在未使用药物的情况下,TAT在建模6 h即出现急剧升高,并在之后的12 h及24 h持续升高,提示凝血功能持续激活,而早期使用药物干预后TAT的上升程度明显降低。
UTI是从健康成年男性新鲜尿液中分离纯化出来的一种糖蛋白,属蛋白酶抑制剂,对胰蛋白酶、α-糜蛋白酶等丝氨酸蛋白酶、粒细胞弹性蛋白酶、纤溶酶等多种酶有抑制作用[12-13]。UTI通过与丝氨酸蛋白酶结合而拮抗这些毒性蛋白酶,从而实现对细胞和组织的保护[14]。在本实验中早期使用UTI治疗脓毒症幼鼠,能降低TNF-α生成,减轻血小板活化及内皮细胞损伤,降低P-选择素和TAT的生成。应用炎症介质拮抗剂或凝血抑制剂治疗脓毒症在动物实验中取得一定效果,但临床试验疗效不佳,有其他学者发现UTI和胸腺肽-α单用或联用时都具有整体性的免疫调理作用,能降低脓毒症患者的病死率[15-16]。近年随着对脓毒症发病机制的研究,早期诊断及干预作为主要手段将成为脓毒症的治疗新趋势,有可能进一步提高该病的治疗效果。
临床脓毒症病例研究表明连续血液净化可以提高严重脓毒症患儿受抑制的免疫功能并改善预后[17]。但该治疗费用高,使用的适应症和禁忌症需严格把握,因此,对脓毒症的预防性治疗显得尤为重要。临床上脓毒症仍是儿童死亡的重要原因之一,本研究创新之处在于首次提出UTI可用于预防性治疗幼鼠脓毒症,以期降低临床上儿童脓毒症的发生率。UTI对CLP脓毒症幼鼠模型治疗的作用机制十分复杂,而对相关作用机制的研究是本课题组后续展开的工作重点。
| [1] | Fleischmann C, Scherag A, Adhikari NK, et al. Assessment of global incidence and mortality of hospital-treated sepsis.Current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193 (3): 259–272. DOI:10.1164/rccm.201504-0781OC |
| [2] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315 (8): 801–810. DOI:10.1001/jama.2016.0287 |
| [3] | Atal SS, Atal S. Ulinastatin-a newer potential therapeutic option for multiple organ dysfunction syndrome[J]. J Basic Clin Physiol Pharmacol, 2016, 27 (2): 91–99. |
| [4] | Uchida M, Abe T, Ono K. The effects of ulinastatin in multiple organ failure:a retrospective observational study in a single center ICU[J]. Intensive Care Med Exp, 2015, 3 (Suppl 1): A878. DOI:10.1186/2197-425X-3-S1-A878 |
| [5] | Wang FY, Fang B, Qiang XH, et al. The efficacy and immunomodulatory effects of ulinastatin and thymosin α1 for sepsis:a systematic review and Meta-analysis[J]. Biomed Res Int, 2016, 2016 : 9508493. |
| [6] | Zhang H, Kovacs-Nolan J, Kodera T, et al. γ-Glutamyl cysteine and γ-glutamyl valine inhibit TNF-α signaling in intestinal epithelial cells and reduce inflammation in a mouse model of colitis via allosteric activation of the calcium-sensing receptor[J]. Biochim Biophys Acta, 2015, 1852 (5): 792–804. DOI:10.1016/j.bbadis.2014.12.023 |
| [7] | Newcomb D, Bolgos G, Green L, et al. Antibiotic treatment influences outcome in murine sepsis:mediators of increased morbidity[J]. Shock, 1998, 10 (2): 110–117. DOI:10.1097/00024382-199808000-00005 |
| [8] | Ruiz S, Vardon-Bounes F, Merlet-Dupuy V, et al. Sepsis modeling in mice:ligation length is a major severity factor in cecal ligation and puncture[J]. Intensive Care Med Exp, 2016, 4 (1): 22. DOI:10.1186/s40635-016-0096-z |
| [9] | Vincent JL, Opal SM, Marshall JC, et al. Sepsis definitions:time for change[J]. Lancet, 2013, 381 (9868): 774–775. DOI:10.1016/S0140-6736(12)61815-7 |
| [10] | Shubin NJ, Monaghan SF, Ayala A. Anti-inflammatory mechanisms of sepsis[J]. Contrib Microbiol, 2011, 17 : 108–124. DOI:10.1159/000324024 |
| [11] | Kutlar A, Embury SH. Cellular adhesion and the endothelium: P-selectin[J]. Hematol Oncol Clin North Am, 2014, 28 (2): 323–339. DOI:10.1016/j.hoc.2013.11.007 |
| [12] | Han D, Shang W, Wang G, et al. Ulinastatin-and thymosin α1-based immunomodulatory strategy for sepsis:a meta-analysis[J]. Int Immunopharmacol, 2015, 29 (2): 377–382. DOI:10.1016/j.intimp.2015.10.026 |
| [13] | Karnad DR, Bhadade R, Verma PK, et al. Intravenous administration of ulinastatin (human urinary trypsin inhibitor) in severe sepsis:a multicenter randomized controlled study[J]. Intensive Care Med, 2014, 40 (6): 830–838. DOI:10.1007/s00134-014-3278-8 |
| [14] | Guan L, Liu H, Fu P, et al. The protective effects of trypsin inhibitor on hepatic ischemia-reperfusion injury and liver graft survival[J]. Oxid Med Cell Longev, 2016, 2016 : 1429835. |
| [15] | Hao X, Cai G, Hu C. The effect of ulinastatin on sepsis in the rats of adhesion molecules and endothelial function[J]. Intensive Care Med Exp, 2015, 3 (Suppl 1): A617. DOI:10.1186/2197-425X-3-S1-A617 |
| [16] | Liu G, Li Q. Meta-analysis of xuebijing joint ulinastatin treating sepsis[J]. Value Health, 2014, 17 (7): A807. |
| [17] | 袁远宏, 肖政辉, 张慧, 等. 连续血液净化对严重脓毒症患儿T细胞亚群的影响[J]. 中国当代儿科杂志, 2014, 16 (2): 194–197. |
 2017, Vol. 19
2017, Vol. 19