新生儿缺氧缺血性脑病(hypoxic-ischemic encephalophathy, HIE)是儿科常见的严重疾病,也是引起儿童神经伤残的重要原因之一[1]。因此,研究和阐明缺氧缺血脑损伤(HIBD)的分子基础及其与预后的关系对于探寻特异防治方法具有重要意义。神经元细胞需要合成神经递质,进行轴突运输,有氧代谢,实现信息的整合转导和输出,这些生理活动都需要线粒体进行供能,因此神经元对缺氧十分敏感[2]。当HIBD发生后,由于缺氧,ATP合成被打断,线粒体受损,氧化呼吸链中的电子发生漏出产生大量的活性氧和凋亡因子释放到神经元胞浆,激活细胞死亡通路[3]。此时细胞会做出应激反应,在线粒体释放促凋亡因子之前,通过自噬将受损的线粒体选择性的隔离和降解,预防下一步的损伤。Drp1和Fis1是线粒体分裂有关的蛋白, 二者相互作用可促进线粒体的分裂,从而参与线粒体自噬的调节[4-6]。线粒体外膜蛋白受体Tom20与线粒体内膜蛋白受体Tim23,定位于线粒体上, 当线粒体形态与功能完整时,二者稳定表达,当线粒体受损时,二者表达降低,可致线粒体自噬[7-8]。三甲基腺嘌呤(3-methyladenine, 3MA)是自噬抑制剂,通过抑制ClassⅢ PI3K,从而抑制自噬体的形成[9],3MA既能抑制非选择性自噬,也能抑制选择性自噬。近年来,许多研究表明线粒体自噬调节异常与许多疾病密切相关,尤其是在神经退行性疾病和脑外伤中[10-13]。但是,线粒体自噬在新生儿HIE中的作用鲜有报道。本研究将建立新生大鼠缺氧缺血模型模拟新生儿HIE,探讨发生缺氧缺血时,线粒体自噬的表达情况,了解其在HIBD后的修复作用,以及调控机制,为HIE的治疗提供新的思路。
1 材料与方法 1.1 主要试剂8%氧气和92%氮气混合气(四川大学华西第二医院中央供气站);自噬抑制剂3-MA(Sigma,美国);ECL底物化学发光试剂(Pierce公司,美国);BCA蛋白定量检测试剂盒(北京百泰克生物技术有限公司);聚偏氟乙烯(PVDF)膜(O.Roche公司,瑞士);组织线粒体分离试剂盒、蛋白酶抑制剂PMSF、线粒体膜电位检测试剂盒(上海碧云天生物技术有限公司);兔抗鼠Tom20抗体、兔抗鼠Tim23抗体、兔抗鼠Drp1抗体(Abcam公司,英国);兔抗鼠Fis1抗体、兔抗鼠β-actin抗体、辣根过氧化物酶标记的抗兔IgG抗体(Santa Cruz公司,美国);线粒体示踪剂(mitotracker)、自噬小体示踪剂(lysotracker)(Invitrogen公司,美国);兔抗鼠LC3抗体(Novus公司,美国)。
1.2 动物分组与模型建立出生后7日龄Sprague-Dawley大鼠120只,雌雄不限,由四川大学华西动物实验中心提供。将新生大鼠分为假手术组、HIBD组、自噬抑制剂干预组(3MA组),每组又分为缺氧后2、12、24、48、72 h 5个亚组,每个亚组动物数相同(n=8)。
通过改良Rice-Vannuncci法[14]建立新生大鼠HIBD模型:7日龄新生大鼠吸入乙醚进行麻醉后,固定在操作台上,碘酒消毒颈部皮肤后,于正中偏右行纵向切口后逐层分离,游离右侧颈总动脉后用5-0号丝线进行结扎,缝合皮肤伤口,术后将新生大鼠放入37℃恒温箱中恢复30 min,然后放入缺氧舱中给予含8%氧气和92%氮气混合气,气体流量为1.5 L/min,维持2.5 h。假手术组大鼠行颈总动脉分离后不作结扎,缝合切口,不作缺氧处理。3MA组大鼠于HIBD造模前30 min腹腔注射2 μL溶于PBS的3MA(100 nmol/μL),HIBD组和假手术组腹腔注射2 μL PBS。
1.3 大脑皮层单细胞悬液的制备处死大鼠后,切取右侧大脑皮层100 mg,用PBS洗涤组织1次。将组织置于冰上的培养皿中,用眼科剪剪碎组织,将组织悬液转移到离心管中,加入0.25%胰酶-EDTA复合消化液于37℃消化20 min,消化期间可间断振荡或吹打。用细胞培养液终止消化。用吸管吹打均匀后,放细胞筛(200目)过滤,收集细胞悬液,3 000 r/min离心5 min,吸弃上清,将沉淀冲洗2次后加PBS,制成单个细胞悬液。
1.4 免疫荧光共定位检测线粒体自噬发生情况Mitotracker是一种线粒体的红色荧光探针,用于活细胞线粒体的特异性荧光染色;lysotracker是一种自噬体的蓝色荧光探针,用于细胞内自噬体的荧光染色。两者进行荧光共定位可以检测在线粒体中自噬的发生情况。将分离脑细胞在细胞计数仪下计数,调整细胞数至1×106个/mL。将mitotracker和lysotracker分别溶解于无水二甲基亚砜(DMSO)中,均调整浓度至1 mmol/L储存。取1 mmol/L的lysotracker加到PBS中使最终浓度为150 nmol/L,取1 mmol/L的mitotracker加入到PBS中使最终浓度为200 nmol/L,将单细胞悬液离心后除去上清,用37℃预热PBS洗涤3次,离心后吸弃上清,用37℃预热mitotracker工作液和lysotracker工作液在EP管中悬浮细胞,与细胞避光共孵育30 min。除去染色工作液,加入500 μL预热的PBS漂洗2次,加入含4%多聚甲醛的PBS溶液,在室温下固定20 min,PBS洗涤3次后4℃避光保存。用PBS洗涤2次后加入含0.2% TritionX-100的PBS溶液,室温孵育5 min。PBS洗涤3次后,加入DAPI孵育5 min,PBS洗涤后进行共焦成像。当用LC3标记自噬时,在mitotracker染色固定后,PBS洗涤3次后封闭液封闭1 h,一抗于4℃冰箱中孵育过夜;滴入荧光素标记的二抗,避光孵育1 h,PBS洗涤3次后,加入DAPI孵育5 min,PBS洗涤后,进行共聚焦成像。
1.5 JC-1法检测线粒体膜电位正常细胞线粒体膜电位高,线粒体内JC-1聚集体的浓度高,红色荧光增强;当细胞发生损伤时,线粒体膜电位下降,线粒体内JC-1呈单体形式,发绿色荧光。因此,当观察到绿色荧光增强或红色荧光下降时,表示线粒体膜电位下降,线粒体受损。取50 μL JC-1(200X)加入8 mL超纯水后充分混匀,再加入2 mL JC-1染色缓冲液(5X),混匀后即为JC-1染色工作液。每1 mL JC-1染色缓冲液(5X)加入4 mL蒸馏水配置JC-1染色缓冲液(1X)冰浴。缺氧缺血后24 h取各组大鼠脑组织进行单细胞分离,将分离的脑细胞在细胞计数仪下计数,调整细胞数至1×106个/mL。重悬于500 μL PBS中,加入0.5 mL JC-1染色工作液,37℃孵育20 min后,2 300 r/min 4℃离心3 min,沉淀细胞。弃去上清,用JC-1染色缓冲液(1X)洗涤2次,加入1 mL JC-1染色缓冲液(1X)重悬后上流式细胞仪检测。
1.6 TTC染色检测脑梗死灶大小缺氧缺血后24 h取各组大鼠脑组织,将脑组织置于脑切片模具中-20℃冻10~15 min,由视交叉开始沿冠状位向后切片,切片厚度为2 mm。切片后放置于2%浓度TTC中,37℃温箱孵育30 min。染色结果红色为正常组织,白色为梗死组织,计算梗死体积。
1.7 Western blot法检测线粒体自噬相关蛋白的表达水平取皮质神经元中细胞浆蛋白,用BCA蛋白定量检测试剂盒测定蛋白浓度,调整蛋白浓度至统一浓度。10%十二烷基硫酸钠-聚丙烯酰胺凝胶120 V电泳90 min分离蛋白,电泳结束后300 mA转膜90 min,将蛋白转印到PVDF膜上,5%脱脂奶粉室温封闭1 h后弃去封闭液,分别加入一抗anti-β-actin(1 : 1 000)、anti-β-Tubulin(1 : 500)、anti-Drp1(1 : 1 000)、anti-Fis1(1 : 1 000)、anti-Tom20(1 : 200)、anti-Tim23(1 : 200)置于摇床,4℃过夜。加入TBST置于摇床上清洗3次,每次5 min;加入辣根过氧化物酶标记的二抗,室温孵育1 h,加入TBST洗膜3次,每次5 min。在PVDF膜上均匀滴入ECL超敏发光液,将膜放入凝胶成像仪成像。
1.8 统计学分析采用SAS 9.4统计软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用One-way analysis of cariance(ANOVA),组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
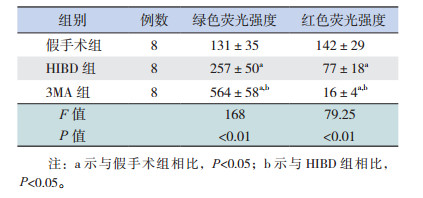
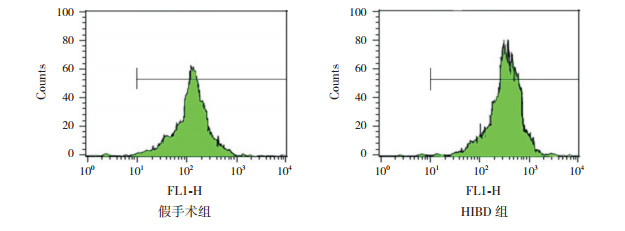
2 结果 2.1 缺氧缺血对HIBD大鼠线粒体膜电位的影响流式细胞结果提示:与假手术组(131±35)相比,HIBD组中绿色平均荧光强度(257±50)增加(t=5.835,P < 0.05),线粒体内JC-1单体的浓度高,表明活线粒体膜电位降低,凋亡细胞增多(图 1)。
|
图 1 JC-1法检测假手术组与HIBD组线粒体膜电位的变化 线粒体膜电位下降时,线粒体内JC-1呈单体形式,发绿色荧光,线粒体膜电位越低,绿色荧光越强;可见与假手术组相比,HIBD组中绿色荧光流式图峰值增高、右移,平均荧光强度增加,线粒体膜电位减低。 |
2.2 缺氧缺血对新生大鼠线粒体相关蛋白表达的影响
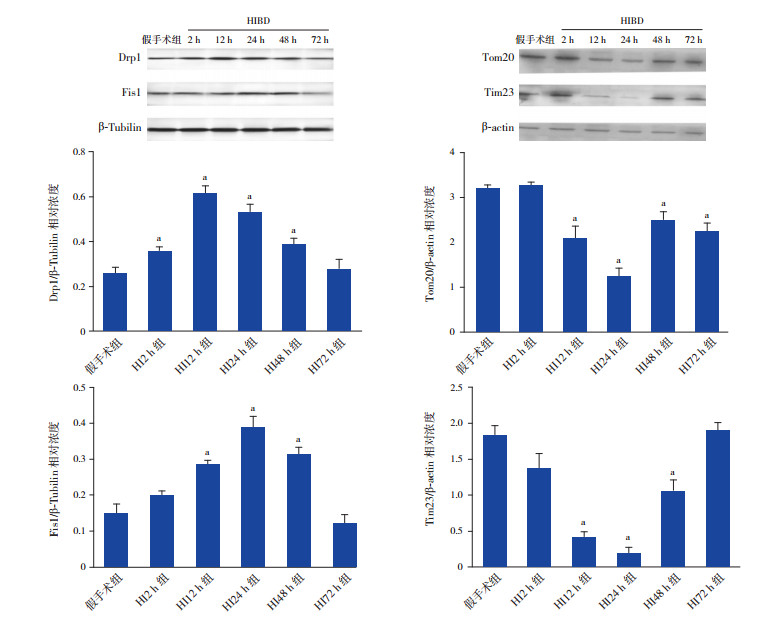
Western bolt检测结果显示:在胞浆中,线粒体分裂相关蛋白Drp1、Fis1的表达均在HIBD后开始增高,分别在HIBD后12 h和24 h达到峰值,与假手术组相比差异有统计学意义(P < 0.05);相反,线粒体外膜蛋白受体Tom20与线粒体内膜蛋白受体Tim23的表达在HIBD后逐渐降低,均在HIBD后24 h达到谷值,与假手术组相比,差异有统计学意义(P < 0.01)。见图 2。
|
图 2 Western blot检测线粒体分裂相关蛋白Drp1、Fis1和线粒体外/内膜蛋白受体Tom20、Tim23表达情况 左侧为Drp1、Fis1蛋白电泳条带图及统计图(n=8);右侧为Tom20、Tim23蛋白电泳条带图及统计图(n=8)。a示与假手术组比较,P < 0.05。 |
2.3 大鼠HIBD后线粒体自噬的表达情况
免疫荧光结果提示:线粒体染色呈红色荧光,自噬小体染色呈蓝色荧光(图 3);两者共定位显示,与假手术组(19.1±2.3)相比,HIBD组红色荧光数减少,分布弥散,密集程度降低,线粒体数量(12.5±2.9)减少(t=5.069,P < 0.05);与假手术组(6.6±1.8)相比,HIBD组中线粒体和自噬小体的共定位阳性细胞计数(9.7±1.3)增多,差异有统计学意义(t=4.03,P < 0.05)。
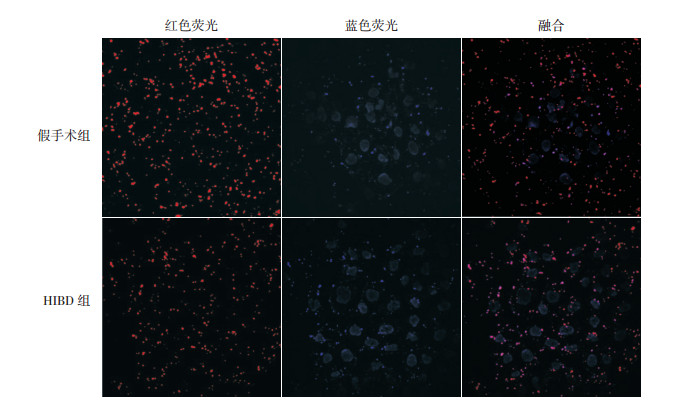
|
图 3 免疫荧光共定位检测HIBD后线粒体以及线粒体自噬的表达(×400) 线粒体染色呈红色荧光,自噬小体染色呈蓝色荧光,胞浆中线粒体红色荧光与自噬小体蓝色荧光重叠合成的紫色荧光小点代表线粒体自噬的表达;与假手术组相比,HIBD组的红色荧光减少,紫色荧光增多,表示线粒体数量减少,线粒体自噬发生增多。 |
2.4 抑制线粒体自噬对HIBD新生大鼠脑组织损伤程度的影响
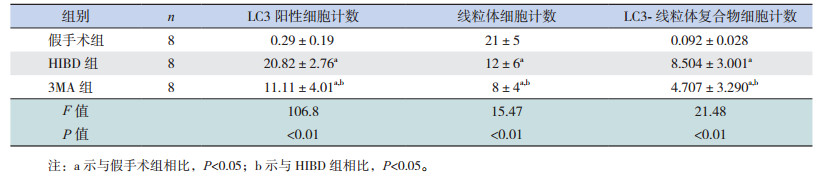
LC3标记自噬染色呈绿色荧光,线粒体染色呈红色荧光,细胞核染色呈蓝色荧光。免疫荧光结果提示,与HIBD组相比,3MA组红色与绿色荧光表达均减少(P < 0.05),共定位阳性细胞计数下降(P < 0.05),荧光分布弥散,密集程度降低;提示3MA抑制后,HIBD新生大鼠线粒体自噬明显减少。见表 1,图 4。
| 表 1 各组免疫荧光结果比较(x±s) |
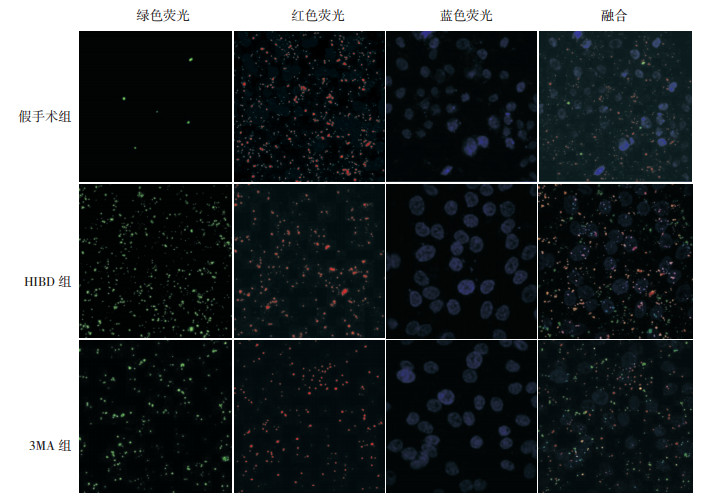
|
图 4 免疫荧光共定位检测假手术组、HIBD组及3MA组线粒体自噬的情况(×400) LC3染色呈绿色荧光,线粒体染色呈红色荧光,细胞核染色呈蓝色荧光,胞浆中线粒体红色荧光与LC3绿色荧光重叠合成的黄色荧光小点代表线粒体自噬的表达;与HIBD组相比,3MA组红色与绿色荧光表达均减少,黄色荧光表达也相应降低,表明3MA注射后,抑制线粒体自噬的表达。 |
流式细胞学结果表明,HIBD 24 h后,与假手术组和HIBD组相比,3MA抑制自噬后,红色荧光强度降低,绿色荧光强度增高(P < 0.05),线粒体膜电位下降,凋亡细胞增多。见图 5,表 2。
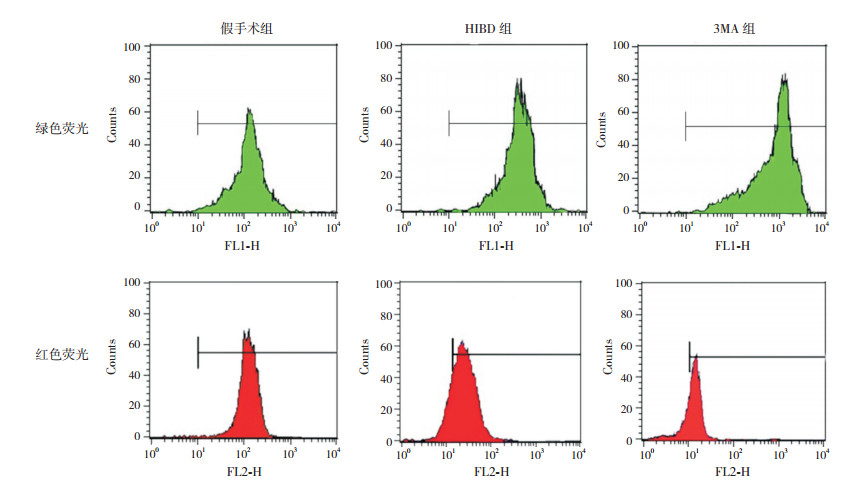
|
图 5 JC-1法检测各组线粒体膜电位的变化 当线粒体膜电位下降时,JC-1染色红色荧光减弱,绿色荧光增强。与假手术组和HIBD组相比,3MA组中绿色荧光流式图峰值增高、右移,平均荧光强度增加;红色荧光流式图峰值降低、左移,平均荧光强度下降;提示线粒体膜电位明显降低。 |
| 表 2 各组流式荧光结果比较 |
脑组织TTC染色结果表明:HIBD 24 h后各组脑梗死体积百分比比较差异有统计学意义(F=242.4,P < 0.05)。与假手术组(0.006±0.004)相比,HIBD组脑梗死体积占脑总体积(0.257±0.039)明显增加(P < 0.05);3MA组脑梗死体积占脑总体积(0.385±0.041)与HIBD组相比,梗死灶更为明显(P < 0.05),提示脑梗死加重。见图 6。
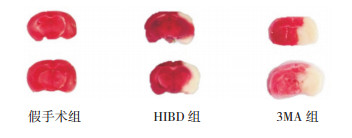
|
图 6 各组脑组织TTC染色结果 白色部分为梗死区。与假手术组相比,HIBD组和3MA组脑梗死面积明显增加;与HIBD组相比,3MA组脑梗死面积更大。 |
3 讨论
线粒体是一个处于不断分裂和融合动态平衡中的细胞器,当这一平衡被打破时会导致线粒体的功能发生障碍,而线粒体功能障碍涉及到许多疾病的发生和进展[15]。通过特异性的自噬清除受损的线粒体这一过程称为线粒体自噬,因此线粒体自噬对于维持线粒体的自稳态以及细胞的存活至关重要[16]。目前Zuo等[17]在成年大鼠大脑中动脉缺血模型中证实了在早期的缺氧缺血应激条件下依赖线粒体分裂蛋白Drp1表达的线粒体自噬清除受损线粒体,可以维持细胞稳态,促进细胞存活。荧光探针JC-1是一种阳离子型的亲脂性染料,能够跨过细胞膜,随着细胞膜电位的变化在膜两侧保持动态平衡。正常细胞线粒体膜电位高,线粒体内JC-1聚集体的浓度高,红色荧光增强,在流式图上表现为FL2阳性率增加,当细胞发生损伤时,线粒体膜电位下降,线粒体内JC-1呈单体形式,发绿色荧光,FL1阳性率增强。本研究发现,在新生大鼠缺氧缺血模型中,与假手术组相比,线粒体内JC-1单体的浓度高,FL1通道绿色荧光强度增加,线粒体膜裂解增加,膜电位明显降低。免疫荧光结果显示线粒体和自噬小体的共定位阳性率增多,提示线粒体自噬程度明显增加。Western bolt结果提示线粒体分裂相关蛋白Drp1及Fis1表达增加,线粒体外/内膜蛋白受体表达下降。我们推测新生大鼠缺氧缺血后,线粒体膜裂解增加,从而导致受损线粒体自噬增加。Cavallucci等[18]通过切除大鼠小脑半球构建急性局灶性脑损伤模型中,依靠电镜检测线粒体形态,发现在脑损伤中存在线粒体自噬,而增强线粒体自噬可以推迟局灶性脑损伤的远期退化。本研究发现,自噬抑制剂3MA注射后可以观察到线粒体和自噬小体共定位阳性率减少,线粒体自噬被显著抑制。免疫荧光结果显示3MA抑制线粒体自噬后,红色荧光降低绿色荧光增加,线粒体膜电位下降,凋亡细胞增多。3MA抑制线粒体自噬后梗死灶扩大,提示抑制线粒体自噬会加重HIBD。我们推测抑制线粒体自噬后,线粒体受损加重,氧化呼吸链中的电子发生漏出,产生大量的活性氧和凋亡因子释放到神经元胞浆,激活细胞死亡通路,从而促进了细胞的凋亡。本研究初步揭示新生大鼠缺氧缺血后出现的线粒体自噬对HIBD有一定的保护作用,可能与线粒体分裂相关蛋白的表达有关,值得注意的是线粒体自噬相关蛋白的修饰状态变化也能够影响HIBD的进程,具体分子机制尚需进一步阐明。
| [1] | Yum SK, Moon CJ, Young YA, et al.Changes in lactate dehydrogenase are associated with central gray matter lesions in newborns with hypoxic-ischemic encephalopathy[J].J Matern Fetal Neonatal Med, 2016.[Epub ahead of print] |
| [2] | Tao LX, Huang XT, Chen YT, et al. Acetylcholinesterase-independent protective effects of huperzine A against iron overload-induced oxidative damage and aberrant iron metabolism signaling in rat cortical neurons[J]. Acta Pharmacol Sin, 2016, 37 (11): 1391–1400. DOI:10.1038/aps.2016.78 |
| [3] | Sun MY, Cui KJ, Yu MM, et al. Bax inhibiting peptide reduces apoptosis in neonatal rat hypoxic-ischemic brain damage[J]. Int J Clin Exp Pathol, 2015, 8 (11): 14701–14708. |
| [4] | Kim H, Lee JY, Park KJ, et al. A mitochondrial division inhibitor, Mdivi-1, inhibits mitochondrial fragmentation and attenuates kainic acid-induced hippocampal cell death[J]. BMC Neurosci, 2016, 17 (1): 33. DOI:10.1186/s12868-016-0270-y |
| [5] | Shen Q, Yamano K, Head BP, et al. Mutations in Fis1 disrupt orderly disposal of defective mitochondria[J]. Mol Biol Cell, 2014, 25 (1): 145–159. DOI:10.1091/mbc.E13-09-0525 |
| [6] | 黄阳, 陈洪菊, 朱将虎, 等. PINK1基因对缺氧缺血性脑损伤新生小鼠细胞凋亡及自噬的影响[J]. 中国当代儿科杂志, 2016, 18 (3): 263–269. |
| [7] | Yu S, Zheng S, Leng J, et al. Inhibition of mitochondrial calcium uniporter protects neurocytes from ischemia/reperfusion injury via the inhibition of excessive mitophagy[J]. Neurosci Lett, 2016, 628 : 24–29. DOI:10.1016/j.neulet.2016.06.012 |
| [8] | Goemans CG, Boya P, Skirrow CJ, et al. Intra-mitochondrial degradation of Tim23 curtails the survival of cells rescued from apoptosis by caspase inhibitors[J]. Cell Death Differ, 2008, 15 (3): 545–554. DOI:10.1038/sj.cdd.4402290 |
| [9] | Xie WY, Zhou XD, Yang J, et al. Inhibition of autophagy enhances heat-induced apoptosis in human non-small cell lung cancer cells through ER stress pathways[J]. Arch Biochem Biophys, 2016, 607 : 55–66. DOI:10.1016/j.abb.2016.08.016 |
| [10] | Carvalho C, Santos MS, Oliveira CR, et al. Alzheimer's disease and type 2 diabetes-related alterations in brain mitochondria, autophagy and synaptic markers[J]. Biochim Biophys Acta, 2015, 1852 (8): 1665–1675. DOI:10.1016/j.bbadis.2015.05.001 |
| [11] | Sanders LH, McCoy J. Mitochondrial DNA damage:molecular marker of vulnerable nigral neurons in Parkinson's disease[J]. Neurobiol Dis, 2014, 70 : 214–223. DOI:10.1016/j.nbd.2014.06.014 |
| [12] | Chen H, Chan YL, Nguyen LT, et al. Moderate traumatic brain injury is linked to acute behaviour deficits and long term mitochondrial alterations[J]. Clin Exp Pharmacol Physiol, 2016, 43 (11): 1107–1114. DOI:10.1111/cep.2016.43.issue-11 |
| [13] | 吕娟娟, 陈志江, 项丹, 等. 脂多糖诱导脓毒症大鼠远期脑线粒体损伤的初步研究[J]. 中国当代儿科杂志, 2015, 17 (8): 859–863. |
| [14] | Demarest TG, Waite EL, Kristian T, et al. Sex-dependent mitophagy and neuronal death following rat neonatal hypoxiaischemia[J]. Neuroscience, 2016, 335 : 103–113. DOI:10.1016/j.neuroscience.2016.08.026 |
| [15] | Liu MY, Jin J, Li SL, et al. Mitochondrial fission of smooth muscle cells is involved in artery constriction[J]. Hypertension, 2016, 68 (5): 1245–1254. DOI:10.1161/HYPERTENSIONAHA.116.07974 |
| [16] | Liu K, Zhao Q, Liu P, et al. ATG3-dependent autophagy mediates mitochondrial homeostasis in pluripotency acquirement and maintenance[J]. Autophagy, 2016, 12 (11): 2000–2008. DOI:10.1080/15548627.2016.1212786 |
| [17] | Zuo W, Zhang S, Xia CY, et al. Mitochondria autophagy is induced after hypoxic/ischemic stress in a Drp1 dependent manner:the role of inhibition of Drp1 in ischemic brain damage[J]. Neuropharmacology, 2014, 86 : 103–115. DOI:10.1016/j.neuropharm.2014.07.002 |
| [18] | Cavallucci V, Bisicchia E, Cencioni MT, et al. Acute focal brain damage alters mitochondrial dynamics and autophagy in axotomized neurons[J]. Cell Death Dis, 2014, 5 : e1545. DOI:10.1038/cddis.2014.511 |
 2017, Vol. 19
2017, Vol. 19