脑皮质发育障碍(malformation of cortical development, MCD)是导致儿童药物难治性癫癎的最常见病因之一,它可以涉及一个或多个沟回、一个或多个脑叶甚至半球[1]。当脑皮质发育障碍位于一侧半球颞顶枕叶时,被称为后象限皮质发育不良(posterior quadrant dysplasia, PQD)[2]。PQD患儿早期手术治疗已经取得很好的临床效果,但因为患者年龄小、病灶范围不好界定、手术风险较大等多种原因,国内还缺乏系统的研究。北京大学第一医院儿童癫癎中心自2015年6月至2016年5月接受外科手术治疗的PQD致难治性癫癎患儿14例,现将14例患儿的术前评估、手术经验及短期预后等情况进行分析如下。
1 资料与方法 1.1 研究对象2015年6月至2016年5月期间,本中心接受外科手术治疗的PQD致难治性癫癎患儿14例,均正规应用两种及以上抗癫癎药物不能控制发作,发作形式多样,且都有智力、运动发育落后。其中男9例,女5例;年龄0.7~9岁,平均3.1±2.5岁。癫癎发作起始年龄1~19个月,平均5.4±4.6个月。发作频率3~40次/d,平均5±4次/d。术前服用抗癫癎药物3~5种,平均3.2种。
1.2 术前评估术前所有患儿均进行详细的病史采集、查体,神经发育及心理评估,以及头颅CT、MRI及正电子发射断层扫描(FDG-PET)检查,头颅MRI T1WI序列和FDG-PET融合检查,MRI三维重建和头皮视频脑电(video-EEG)监测等。视频脑电监测采用NIHON KOHDEN 32通道VEEG-1200-C系统,按国际10-20系统放置19导联记录电极,并同步记录双侧三角肌和双侧股四头肌的表面肌电图(EMG)。术前至少记录到3~5次癫癎发作。根据发作期症状特征和各项检查结果,进行术前综合评估。
1.3 手术方法14例患儿均接受了颞顶枕叶离断术,其中2例还同时进行了中央区部分切除术。取侧卧位,选择颞顶叶“T”型切口入路。充分暴露外侧裂、颞上回、中央区及邻近部分顶叶。暴露中央区可提高术中躯体感觉诱发电位(somatosensory evoked potential, SSEP)及复合肌肉动作电位(compound muscle active potential, CMAP)监测的准确性及成功率。SSEP技术用于观察感觉皮层N20电位及传至中央前回P22电位的位相反转情况,以确定中央沟的位置。CMAP是根据直接皮层点刺激在对侧肢体相应肌肉反映出的复合肌肉动作电位,以确定初级运动皮层。CMAP通过持续皮层电刺激,观察波幅改变以达到保护运动功能的目的。在颞顶枕叶离断之前,常规进行皮层脑电图(electrocorticography, ECoG)以监测异常放电范围。中央沟定位主要通过术中解剖位置、术前MRI三维重建(图 1)及术中SSEP(图 2)。根据术前评估及术中监测情况,进一步确定顶叶离断部位。颞顶枕叶离断,先离断颞叶,沿外侧裂或颞上回切开蛛网膜及软脑膜,充分暴露下环岛沟,保护大脑中动脉支配颞叶的大血管及较大的回流静脉。沿下环岛沟、颞干到达脑室,充分打开颞角并暴露海马及海马尾部。海马内侧离断,并吸除杏仁核,离断海马尾部,吸除颞枕内侧回达中线。沿顶叶离断部位切开达侧脑室,并与颞角会合。离断胼胝体后部及压部。最后达到颞顶枕叶完全离断。整个离断过程中行不同部位持续CMAP监测,尽量保护血管,不电凝颞极、颞底、枕底及中线旁软脑膜及蛛网膜。
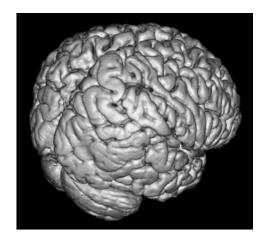
|
图 1 MRI三维重建 清晰看到脑皮层结构。 |
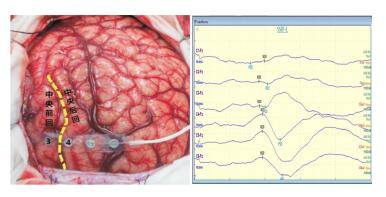
|
图 2 术中SEP监测 4、5、6触点位相倒置,中央沟位于3、4触点之间。 |
1.4 随访与疗效评估
术后给予2~3种抗癫癎药物,随访0.7~1.4年。
2 结果 2.1 脑电图结果14例患儿均进行术前长程视频脑电监测,其中10例发作间期的异常放电位于一侧后象限(图 3),4例发作间期呈多灶性;11例发作期于一侧后象限起始(图 4),3例发作期全导起始,没有侧向性;7例发作间期、发作期都能够定位于一侧后象限,2例发作间期、发作期都不能定位,5例发作间期、发作期不一致或多灶性。14例均行术中ECoG监测,其中2例监测到术中发作。14例患儿中有11例行术中SSEP、CMAP监测,8例SSEP监测效果好,与解剖相符合;3例监测效果不理想。7例CMAP持续监测下行离断手术。4例没有引出CMAP。
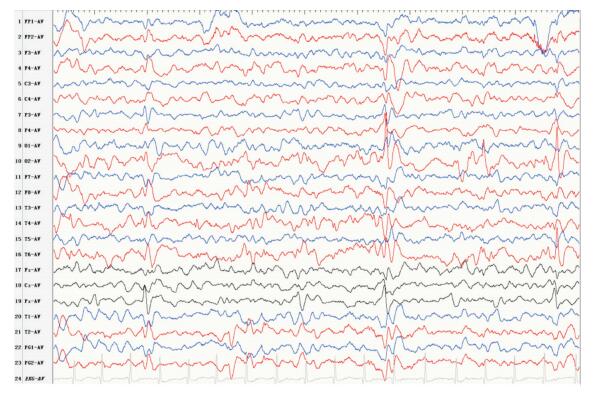
|
图 3 术前发作间期的视频脑电图 右侧后头部、颞区、蝶骨电极大量低-高波幅尖波、尖慢复合波发放。 |
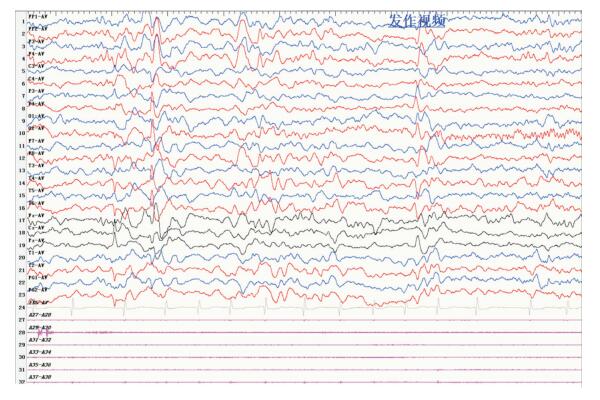
|
图 4 术前发作期的视频脑电图 起始于右侧枕区,呈低波幅快波。 |
2.2 影像学检查结果
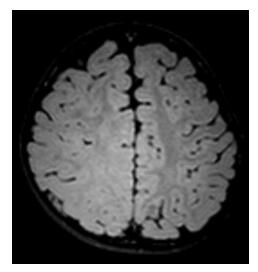
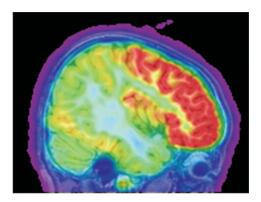
14例患儿术前头颅MRI均发现颞顶枕叶皮质发育异常(图 5)。头颅FDG-PET:12例颞顶枕叶低代谢,2例颞顶枕叶高代谢。发作间期癫癎灶FDG-PET一般为低代谢,发作期癫癎灶如持续放电区FDG-PET常为高代谢。头颅MRI和FDG-PET的融合提示2例皮质发育异常涉及中央区(图 6)。
|
图 5 术前头颅MRI 右侧颞顶枕叶皮质发育异常,涉及中央区。 |
|
图 6 头颅MRI与FDG-PET的融合 右侧颞顶枕叶、中央区代谢减低。 |
2.3 手术结果及随访
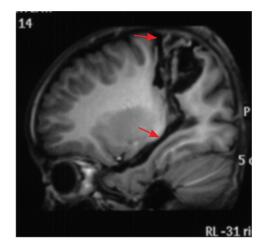
14例均予以颞顶枕叶离断,其中1例切除了颞叶、2例切除了中央后回。术后3个月复查头颅MRI,提示颞顶枕完全离断(图 7)。术后患儿均无肢体功能障碍,并常规服用抗癫癎药物,7例2种药物联合治疗、7例3种药物联合治疗。
|
图 7 术后头颅MRI 右侧颞顶枕叶完全离断、中央区部分切除(如箭头所示)。 |
术后随访0.7~1.4年,13例无癫癎发作;1例发作减少>50%。术后3个月、6个月复查,智力、运动发育评估较术前明显进步。视力、视野因患儿年龄小、智力发育落后不能配合未行检查。无其它并发症及死亡病例。
3 讨论脑皮质发育障碍包括巨脑回,无脑回,带状灰质异位,室管膜下灰质异位,以及局部皮质发育不良、小多脑回、脑裂畸形等局部畸形[3]。脑皮质发育障碍是导致儿童难治性癫癎的最常见病因之一。而PQD约占脑皮质发育障碍的3%~15%,占药物难治性癫癎手术病例的3%~5%[4-5]。
PQD所致癫癎的典型临床特点是起病早,甚至在新生儿期起病,常存在多种发作形式,其中最常见的为痉挛发作[1, 6],大部分伴有精神发育迟滞[5]。本组病例平均起病年龄为1~19个月,其中12例在6月龄以内起病;发作形式有痉挛发作、肌阵挛发作、不典型失神发作及局灶性发作,其中痉挛发作的8例;术前发作都比较频繁,并很快进展为难治性癫癎,神经发育及心理评估提示均存在不同程度神经发育落后。至随访末期,术后13例无发作;1例有发作,但发作明显减少,发作原因可能与病变涉及功能区,未完全切除有关。当然,还需要扩大样本量、延长随访期,进一步评估手术效果。
儿童不同年龄段的脑电图存在差异,尤其低龄儿童。有些儿童PQD所致药物难治性癫癎难以通过脑电图定位癫癎灶,可能与患儿年龄小、脑组织处于发育阶段、脑网络不成熟相关,另外也可能与部分后象限脑皮质发育畸形范围较大、位置较深,发作期脑网络复杂相关[4-5]。本研究10例发作间期异常放电位于一侧后象限,4例发作间期呈多灶性;11例发作期于一侧后象限起始,3例发作期全导起始;7例发作间期、发作期都能定位于一侧后象限,2例发作间期、发作期都不能定位。有些患儿虽然发作期脑电图不能确定癫癎灶起源,但发作间期异常放电位于后象限,对致癎灶有明确定位意义。对于发作间期、发作期脑电图不能确定癫癎灶的,如果影像学提示病灶明确,手术也可取得较好的效果。
头颅MRI、FDG-PET检查及影像学后处理融合技术在儿童PQD所致难治性癫癎术前评估中非常重要[7]。本研究14例头颅MRI均发现颞顶枕叶皮质发育异常。因儿童脑神经细胞迁移、网络重建及髓鞘化等,有可能一次MRI检查不能明确PQD,需要多次重复检查。但并非年龄越大,显示越清晰,往往病程越早期的头颅MRI越有意义。PQD患儿往往脑沟回结构紊乱,MRI三维重建对中央区的定位有重要意义;T1WI序列和FDG-PET融合对癫癎灶范围的确定有意义。
本研究14例均发现颞顶枕叶皮质发育异常,病变广泛,手术切除有很大难度。颞顶枕叶离断术是治疗后象限病变所致难治性癫癎最常用术式,较颞顶枕叶切除术有显著的优点[1]。首先,出血较少,不涉及中线、颞底、枕底等血管,创伤也相对较小,因此特别适合低龄儿童;其次,它保留了脑脊液循环系统的完整性,减少了脑移位的可能,也大大降低了脑积水的发生率;最后,颞顶枕叶离断术比切除术更彻底,尤其是对于枕叶内侧面的处理。手术的关键在于离断是否完全,保护好离断脑叶的供血血管,防止离断脑叶脑梗塞发生。本研究1例行颞叶切除和顶枕叶离断术,13例行颞顶枕叶离断术。无1例因术中出血引起相关并发症。术后头颅MRI均提示颞顶枕完全离断,脑室系统和术前无明显改变。
术中ECoG、SSEP、CMAP对于颞顶枕离断术非常重要。ECoG虽然不能准确定位癫癎灶及其范围,但对癫癎灶范围评估有重要意义。特别是对于癫癎灶涉及中央区的患儿,ECoG监测至关重要[8]。对于中央区及周围的癫癎灶,如果切除中央区,则肢体功能损害,因此癫癎灶不能完全切除。本研究14例术中ECoG均监测到明显的癫癎样发电,其中2例监测到术中发作期脑电图,行中央区部分切除。ECoG监测效果受麻醉药物影响较大,监测时间也要足够。最好监测前半小时停用麻醉药物,并至少监测15 min。除了脑组织三维重建有助于中央沟的辨认,术中SSEP监测能够准确定位中央沟部位[9]。患者年龄越小,SSEP越难以引出;中央沟前后回结构紊乱,SSEP也不易引出。应用6或8触点条状电极进行术中SSEP监测效果最佳,电极摆放应尽量和中央沟垂直。颞顶枕叶离断术涉及对侧肢体功能的保护,PQD患者往往存在功能的转移和可塑,因此术中CMAP的监测十分必要[10]。离断过程中,特别是涉及到顶上小叶的离断时,要分别对支配上、下肢肌肉的皮层持续电刺激,进行CMAP监测,监测效果也与麻醉药物的应用、患儿年龄直接相关。
综上所述,PQD所致药物难治性癫癎广泛的多脑叶脑皮质发育障碍较多出现在后象限,颞顶枕叶离断术效果比较理想,是一个较好的治疗选择。术中ECoG、SSEP及CMAP监测对肢体功能保护、癫癎灶切除范围的指导有意义。
志谢: 感谢上海诺华贸易有限公司在本研究病例资料收集中给予的支持。| [1] | Daniel RT, Meagher-Villemure K, Farmer JP, et al. Posterior quadrantic epilepsy surgery:technical variants, surgical anatomy, and case series[J]. Epilepsia, 2007, 48 (8): 1429–1437. DOI:10.1111/j.1528-1167.2007.01095.x |
| [2] | Dorfer C, Czech T, Mühlebner-Fahrngruber A, et al. Disconnective surgery in posterior quadrantic epilepsy:experience in a consecutive series of 10 patients[J]. Neurosurg Focus, 2013, 34 (6): E10. DOI:10.3171/2013.3.FOCUS1362 |
| [3] | Palmini A, Najm I, Avanzini G, et al. Terminology and classification of the cortical dysplasias[J]. Neurology, 2004, 62 (6 Suppl 3): S2–8. |
| [4] | Mohamed AR, Freeman JL, Maixner W, et al. Temporoparietooccipital disconnection in children with intractable epilepsy[J]. J Neurosurg Pediatr, 2011, 7 (6): 660–670. DOI:10.3171/2011.4.PEDS10454 |
| [5] | Novegno F, Massimi L, Chieffo D, et al. Epilepsy surgery of posterior quadrant dysplasia in the first year of life:experience of a single centre with long term follow-up[J]. Seizure, 2011, 20 (1): 27–33. DOI:10.1016/j.seizure.2010.09.015 |
| [6] | Liang QC, Otsuki T, Takahashi A, et al. Posterior disconnection in early infancy to treat intractable epilepsy with multilobar cortical dysplasia:three case report[J]. Neurol Med Chir (Tokyo), 2013, 53 (1): 47–52. DOI:10.2176/nmc.53.47 |
| [7] | Sarkis RA, Jehi LE, Najm IM, et al. Seizure outcomes following multilobar epilepsy surgery[J]. Epilepsia, 2012, 53 (1): 44–50. DOI:10.1111/epi.2011.53.issue-1 |
| [8] | Yu T, Wang Y, Zhang G, et al. Posterior cortex epilepsy:diagnostic considerations and surgical outcome[J]. Seizure, 2009, 18 (4): 288–292. DOI:10.1016/j.seizure.2008.11.008 |
| [9] | Babu KS, Chandy MJ. Reliability of somatosensory evoked potentials in intraoperative localization of the central sulcus in patients with perirolandic mass lesions[J]. Br J Neurosurg, 1997, 11 (5): 411–417. DOI:10.1080/02688699745907 |
| [10] | Taniguchi M, Cedzich C, Schramm J. Modification of cortical stimulation for motor evoked potentials under general anesthesia:technical description[J]. Neurosurgery, 1993, 32 (2): 219–226. DOI:10.1227/00006123-199302000-00011 |
 2017, Vol. 19
2017, Vol. 19


