过敏性紫癜(Henoch-Schönlein purpura, HSP)是儿童时期最为常见的自身免疫疾病之一,其发病机制尚不清楚[1]。目前认为HSP的病理特征是白细胞碎裂性血管炎累及毛细血管和IgA免过敏性紫癜(Henoch-Schönlein purpura, HSP)是儿童时期最为常见的自身免疫疾病之一,其发病机制尚不清楚[1]。目前认为HSP的病理特征是白细胞碎裂性血管炎累及毛细血管和IgA免所以,如何早期发现HSPN是HSP诊治的重点。近年发现维生素D(VitD)在调节免疫、抑制炎症反应方面起到重要作用,与自身免疫疾病密切相关[5]。关于25-(OH) D3与幼年类风湿性关节炎、系统性红斑狼疮等自身免疫性疾病的相关报道较多,但是有关HSP患儿25-(OH) D3水平改变的研究较为少见。为了解25-(OH) D3是否与HSP以及HSPN的发生有关,本研究检测了HSP患儿25-(OH) D3的水平,现报道如下。
1 资料与方法 1.1 研究对象选择2013年6月至2015年1月于保定市儿童医院诊治并且随访6个月的92例HSP患儿为研究对象,其中男54例、女38例,年龄2~14.9岁,平均年龄6.3±2.8岁。根据患儿住院以及随访期间是否合并紫癜性肾炎,将合并紫癜性肾炎的31例患儿做为HSPN组,男性19例、女性12例,年龄2.1~13.3岁,平均年龄6.2±2.6岁,其中25例肾损伤发生在紫癜出现的2周内,4例发生在紫癜出现的2周至2个月内,2例发生在紫癜出现的2~6个月;将未合并紫癜性肾炎的61例患儿做为HSP组,其中男35例、女26例,年龄2~14.9岁,平均年龄6.3±3.0岁。根据临床症状分组(不考虑患儿是否出现血尿/蛋白尿症状):将仅表现为皮肤紫癜(单纯型)的22例做为单纯组,其中男13例、女9例,年龄2.1~14.9岁,平均年龄6.4±2.8岁;将表现为皮肤紫癜合并关节症状(关节型)的24例做为关节症状组,其中男15例、女9例,年龄2.7~13.3岁,平均年龄6.2±2.7岁;将表现为皮肤紫癜合并消化道症状(腹型)的20例做为消化道症状组,其中男12例、女8例,年龄3.1~13.1岁,平均年龄6.2±2.4岁;将表现为皮肤紫癜合并关节症状及消化道症状(混合型)的26例做为混合症状组,其中男14例、女12例,年龄2~13.5岁,平均年龄6.2±3.4岁。同时选择同期健康体检儿童42例为对照组,其中男24例、女18例,年龄2~14岁,平均年龄6.1±2.4岁。各组在年龄、性别构成上的差异无统计学意义(P>0.05)。所有研究对象入院时均处于病程的2周以内,半年内均未给予补充维生素D以及激素,除外合并其它自身免疫性疾病者,既往无过敏史、佝偻病病史。本研究通过医院医学伦理委员会批准并取得家属的知情同意。
1.2 诊断标准HSP诊断按照2013年中华医学会专家组建议[6]:可触性(必要条件)皮疹伴如下任何1条:(1)弥漫性腹痛;(2)任何部位活检IgA沉积;(3)关节炎/关节痛;(4)肾脏受损表现(血尿和/或蛋白尿)。对于典型皮疹、急性发作的患儿排除相关疾病可以临床诊断HSP,对于皮疹不典型或未见急性期发作性皮疹者,需严格按标准诊断,必要时行皮肤活检。
HSPN诊断采用2009年中华医学会专家组制定的诊断标准[3]:有典型皮肤紫癜病史,不同程度的血尿和/或蛋白尿,排除乙肝病毒相关性肾炎、狼疮性肾炎、ANCA相关性小血管炎等续发性肾损害。
1.3 25-(OH) D3水平检测在HSP患儿入院后、未予激素以及钙剂治疗前采集静脉血2 mL。健康儿童留取清晨空腹静脉血2 mL,离心分离血清后放置于-70℃冰箱保存备用。
25-(OH) D3水平采用酶联免疫法进行检测,操作按试剂盒说明书进行,试剂盒购自北京博晖创新光电技术股份有限公司。
1.4 统计学分析采用SPSS 17.0统计软件进行数据处理。计量资料用均数±标准差(x±s)表示。P < 0.05提示差异有统计学意义。
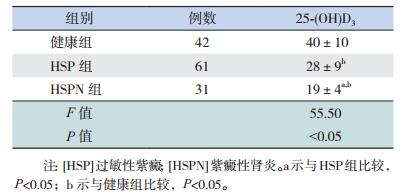
2 结果HSP组、HSPN组的25-(OH) D3水平均低于健康组(P < 0.05),HSPN组的25-(OH) D3水平又低于HSP组(P < 0.05),见表 1。
| 表 1 健康组、HSP组、HSPN组25-(OH) D3水平比较(x±s,μg/L) |
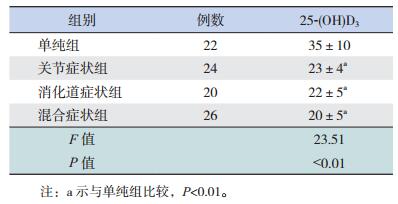
关节组、消化道组、混合组的25-(OH) D3水平均低于单纯组,差异有统计学意义(P < 0.01);但是关节组、消化道组、混合组之间25-(OH) D3水平的差异无统计学意义(P=0.22),见表 2。
| 表 2 不同症状组的HSP患儿25-(OH) D3水平比较(x±s,μg/L) |
3 讨论
维生素D(VitD)是一种多效类固醇激素,具有多种生物学效应。目前认为VitD与人体的免疫功能密切相关,具有调节免疫应答、抑制炎症的作用,可以起到调节TNF-α、IL-6等炎性细胞因子的作用[7-9];VitD还可以抑制活化B细胞的增殖并诱导其凋亡[10]。而HSP患儿存在免疫功能紊乱,可出现TNF-α、IL-6等炎性细胞因子水平的改变,以及B细胞的多克隆活化,并且其水平的改变与HSP疾病活动程度有关[11-13]。那么,VitD在HSP发病机制中的作用如何?本研究检测了HSP患儿25-(OH) D3水平,结果显示,HSP患儿的25-(OH) D3水平低于健康对照组,与郭桂梅等[14]研究相符,推测VitD参与了HSP的血管炎过程,HSP急性期患儿25-(OH) D3水平下降可能与拮抗TNF-α、IL-6等炎性因子的大量产生以及B细胞增殖有关。
有报道VitD对肾脏具有保护作用,可减轻蛋白尿,减轻糖尿病鼠动物模型的足细胞损伤[16-17]。有学者认为,HSP患儿肾脏损伤与1, 25(OH)2D3水平下降有关[14]。本研究显示,HSPN患儿的25-(OH) D3水平低于HSP患儿。一方面可能因为HSPN患儿具有更强烈的炎症反应,刘文东等[12]报道HSPN患儿的TNF-α、IL-6等细胞因子浓度高于单纯HSP患儿,因而25-(OH) D3水平下降更明显;另一方面炎症反应越强的HSP患儿,25-(OH) D3消耗越多,它对肾脏能够起到的保护作用就越小,越容易出现HSPN。因此,25-(OH) D3可能作为HSP是否合并肾脏损伤的预测指标,对于25-(OH) D3水平明显减低而暂时无肾脏损害的HSP患儿,建议密切随诊。
HSP是一种全身性疾病,其主要临床表现是皮肤紫癜、关节症状、消化系统症状以及肾脏损害[18]。本研究结果显示,HSP患儿混合症状组、关节症状组、消化道症状3组间的25-(OH) D3水平差异无统计学意义,但均低于单纯型HSP,提示25-(OH) D3水平可能作为HSP是否合并其它系统损害的预测指标,但是不能区分HSP不同的临床表型。
目前认为补充VitD可以起到改善自身免疫性疾病病情的效果。有报道VitD在治疗系统性红斑狼疮中可以起到较好的疗效[19];对于风湿性疾病患儿也有学者建议补充高剂量VitD[20]。HSP是儿童时期最为常见的一种自身免疫性疾病,本研究证实HSP患儿的25-(OH) D3水平明显下降,尤其是HSPN下降更为显著,因此在治疗HSP尤其是HSPN患儿过程中给予适量的VitD或可以起到良好的疗效,但是具体剂量以及效果尚需大量的临床研究。
综上所述,25-(OH) D3水平下降可能作为HSP是否合并其它系统损害的预测依据,并可能为HSP治疗提供新的思路,但相关研究较少、病例有限,尚需多中心大样前瞻性设计的研究进行验证。
| [1] | Pan YX, Ye Q, Shao WX, et al. Relationship between immune parameters and organ involvement in children with Henoch-Schönlein purpura[J]. PLoS One, 2014, 9 (12): e115261. DOI:10.1371/journal.pone.0115261 |
| [2] | Kawasaki Y, Ono A, Ohara S, et al. Henoch-Schönlein purpura nephritis in childhood:pathogenesis, prognostic factors and treatment[J]. Fukushima J Med Sci, 2013, 59 (1): 15–26. DOI:10.5387/fms.59.15 |
| [3] | 中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治循证指南 (二):紫癜性肾炎的诊治循证指南 (试行)[J]. 中华儿科杂志, 2009, 47 (12): 911–913. |
| [4] | Calvo-Rio V, Loricera J, Mate C, et al. Henoch-Schönlein purpura in northern Spain:clinical spectrum of the disease in 417 patients from a single center[J]. Medicine, 2014, 93 (2): 106–113. DOI:10.1097/MD.0000000000000019 |
| [5] | Jeffery LE, Qureshi OS, Gardner D, et al. Vitamin D antagonises the suppressive effect of inflammatory cytokines on CTLA-4 expression and regulatory function[J]. PLoS One, 2015, 10 (7): e0131539. DOI:10.1371/journal.pone.0131539 |
| [6] | 吴小川. 儿童过敏性紫癜循证诊治建议解读[J]. 中华儿科杂志, 2013, 51 (7): 508–511. |
| [7] | Liefaard MC, Liqthart S, Vitezova A, et al. Vitamin D and C-reactive protein:a mendelian randomization study[J]. PLoS One, 2015, 10 (7): e0131740. DOI:10.1371/journal.pone.0131740 |
| [8] | Calton EK, Keane KN, Newsholme P, et al. The impact of vitamin D levels on inflammatory status:a systematic review of immune cell studies[J]. PLoS One, 2015, 10 (11): e0141770. DOI:10.1371/journal.pone.0141770 |
| [9] | Sommer A, Fabri M. Vitamin D regulates cytokine patterns secreted by dendritic cells to promote differentiation of IL-22-producing T Cells[J]. PLoS One, 2015, 10 (6): e0130395. DOI:10.1371/journal.pone.0130395 |
| [10] | Chen S, Sims GP, Chen XX, et al. Modulatory effects of 1, 25-dihydroxyvitamin D3 on human B cell differentiation[J]. J Immunol, 2007, 179 (3): 1634–1647. DOI:10.4049/jimmunol.179.3.1634 |
| [11] | Cao N, Chen T, Guo ZP, et al. Elevated serum levels of visfatin in patients with Henoch-Schönlein purpura[J]. Ann Dermatol, 2014, 26 (3): 303–307. DOI:10.5021/ad.2014.26.3.303 |
| [12] | 刘文东, 于凌翔, 薛爱红, 等. 过敏性紫癜血清TNF-α、IL-4和IL-6的变化及临床意义[J]. 中国儿童保健杂志, 2011, 19 (1): 77–80. |
| [13] | 穆云, 孙朝, 王亮, 等. 生物学标志物对儿童过敏性紫癜诊断价值的评价[J]. 中国当代儿科杂志, 2015, 17 (9): 918–921. |
| [14] | 郭桂梅, 王娟, 夏敏, 等. 过敏性紫癜患儿血浆1, 25(OH) D3、维生素D受体和24-羟化酶表达的意义[J]. 中华实用儿科临床杂志, 2013, 28 (21): 1640–1642. |
| [15] | 赵培伟, 乐鑫, 丁艳, 等. 白细胞介素-4和白细胞介素-13基因多态性与过敏性紫癜的相关性分析[J]. 中华实用儿科临床杂志, 2015, 30 (21): 1626–1629. |
| [16] | Sonneveld R, FerrèS, Hoenderop JG, et al. Vitamin D down-regulates TRPC6 expression in podocyte injury and proteinuric glomerular disease[J]. Am J Pathol, 2013, 182 (4): 1196–1204. DOI:10.1016/j.ajpath.2012.12.011 |
| [17] | 邹敏书, 余健, 周建华. 活性维生素D及其类似物对足细胞的保护作用[J]. 临床儿科杂志, 2012, 30 (1): 93–96. |
| [18] | Prathiba Raialakshmi P, Srinivasan K. Gastrointestinal manifestations of Henoch-Schönlein in purpura:A report of two cases[J]. World J Radiol, 2015, 7 (3): 66–69. |
| [19] | Terrier B, Derian N, Schoindre Y, et al. Restoration of regulatory and effector T cell balance and B cell homeostasis in systemic lupus erythematosus patients through vitamin D supplementation[J]. Arthritis Res Ther, 2012, 14 (5): R221. DOI:10.1186/ar4060 |
| [20] | Vojinovic J, Cimaz R. Vitamin D-update for the pediatric rheumatologists[J]. Pediatr Rheumatol Online J, 2015, 13 : 18. DOI:10.1186/s12969-015-0017-9 |
 2017, Vol. 19
2017, Vol. 19