2. 西安交通大学第一附属医院儿科, 陕西 西安 710061
过敏性紫癜又称亨-舒综合征(HenochSchönlein purpura, HSP),是儿童时期常见的系统性血管炎性疾病,临床特点为非血小板减少性紫癜、关节炎、胃肠道症状以及肾脏损害,其中最严重的并发症之一为累及肾脏而出现蛋白尿和(或)血尿,称为紫癜性肾炎(Henoch-Schönlein purpura nephritis, HSPN)。迄今为止,HSP的发病机制尚未完全清楚,但普遍研究认为患者体内存在T细胞相关的免疫紊乱[1]。
细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte associated antigen-4, CTLA-4)又名CD152,是免疫球蛋白超家族成员,在激活的T淋巴细胞表面表达,其不仅对T细胞活化起负向调节作用,还可调节T细胞分化[2-3],维持机体T细胞相关的免疫平衡,故可推测CTLA-4功能异常会导致自身免疫性疾病的发生,包括HSP。
人类CTLA-4基因位于2q33,包括4个外显子和3个内含子。CTLA-4基因存在多位点的基因多态性现象,而这种多态性改变可影响其分子的表达及功能,理论上,CTLA-4表达水平或功能异常可导致T细胞功能紊乱,促使自身免疫性疾病的发生。许多研究表明CTLA-4的基因多态性与某些自身免疫性疾病相关,如系统性红斑狼疮(systemic lupus erythematosus, SLE)[4]、自身免疫性甲状腺疾病(autoimmune thyroid diseases, AITDs)[5]、糖尿病(diabetes mellitus, DM)[6]、重症肌无力(myasthenia gravis, MG)[7]、多发性硬化症(multiple sclerosis, MS)[8]、类风湿性关节炎(rheumatoid arthritis, RA)[9]等,而关于CTLA-4基因多态性与HSP的相关性,国内外报道较少,本研究探讨了+49位点及-1722位点的基因多态性与HSP的相关性,从基因水平对HSP的发病机制进行探讨,为其预测及临床治疗提供新的理论依据。
1 资料与方法 1.1 研究对象选取2014年1月至2015年12月在西安交通大学第一附属医院住院的HSP患儿60例为病例组;HSP诊断符合《诸福棠实用儿科学》 [10]中的诊断标准,均为陕西省汉族儿童,均为初发病例,入院前1个月未接受过糖皮质激素及免疫抑制剂等治疗,排除了其他疾病如血液系统疾病、结缔组织病、原发肾病、乙肝病毒相关性肾炎及狼疮性肾炎等继发性肾脏损害,监护人知情同意;其中男33例,女27例,平均年龄7.6±2.7岁。按有无肾脏损害分为HSPN组和Non-HSPN组;HSPN组30例,平均年龄7.8±2.4岁,Non-HSPN组30例,平均年龄7.4±3.1岁。所有纳入患者均详细记录其临床资料,包括姓名、性别、年龄、病情变化、辅助检查及治疗情况。
对照组来源于西安交通大学第一附属医院门诊健康普查的陕西省汉族儿童,病史询问排除既往过敏性紫癜、系统性红斑狼疮等疾病史,4周内无感染及过敏史,经体格检查、肝肾功能、尿常规等实验室检查后确定为健康儿童,共30例,其中男18例,女12例,平均年龄7.6±2.5岁。
1.2 血标本采集及DNA提取研究对象暂禁食12 h,次日清晨抽取静脉血2 mL,置于含有EDTA抗凝液的试管中,于-80℃冰箱低温保存。采用北京天根生物公司合成的人类基因组全血DNA提取试剂盒提取DNA。
1.3 CTLA-4基因多态性分析遵守引物设计原则,利用Primer Premier 5.0分别设计2对引物,委托北京奥科鼎盛生物科技有限公司合成。+49位点上游引物:5'-CCACGGCTTCCTTTCTCGTA-3',下游引物5'-AGTCTCACTCACCTTTGCAG-3',片段大小为329 bp;-1722位点上游引物:5'-GCTTTGTCCTGTGACCATAATG-3',下游引物:5'-CCTGCCTGTTTTCTATACACTG-3',片段大小为416 bp。PCR反应体系(25 μL):Mix 12.5 μL,上、下游引物各1 μL,DNA 10 μL,ddH2O 0.5 μL。PCR反应条件:94 ℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,共30个循环;72℃终末延伸7 min。PCR产物经1.5%琼脂糖凝胶电泳分析,确定为目的产物后,均采用限制性内切酶Bbv Ⅰ(NEB公司)进行酶切反应,若+49位点未发生A→G突变,则不存在酶切位点,若发生突变,则产生一个酶切位点;若-1722位点未发生T→C突变,则不存在酶切位点,若发生突变,则产生一个酶切位点。酶切产物经1.5%琼脂糖凝胶电泳,紫外灯下判断结果并拍照。
1.4 统计学分析采用SPSS 18.0统计软件对数据进行统计学分析,CTLA-4基因+49位点及-1722位点的基因型频率及等位基因频率以百分率(%)表示,各组间基因型频率及等位基因频率比较采用卡方检验或Fisher确切概率法,P < 0.05为差异有统计学意义。
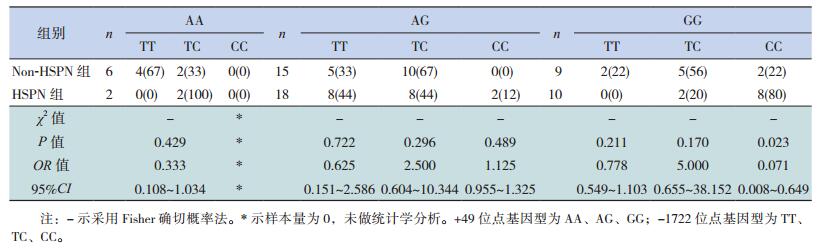
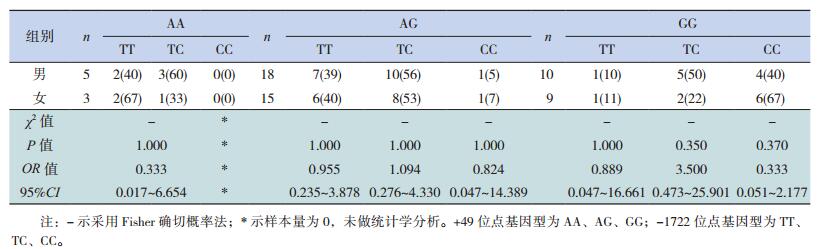
2 结果 2.1 CTLA-4基因多态性电泳图+49位点扩增的目的基因片段大小为329 bp。当该位点发生A→G突变时,产生一个Bbv Ⅰ酶切位点,故经酶切反应后可出现AA(野生型)、AG(杂合型)及GG(突变型)等3种基因型(图 1);-1722位点扩增的目的基因片段大小为416 bp。当该位点发生T→C突变时,产生一个Bbv Ⅰ酶切位点,故经酶切反应后出现TT(野生型)、TC(杂合型)及CC(突变型)等3种基因型(图 2)。
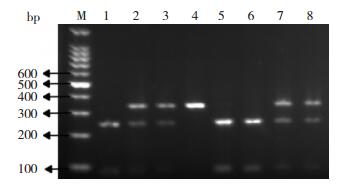
|
图 1 +49位点酶切产物电泳图 M为DNA Ladder,4泳道为AA型,2、3、7、8泳道为AG型,1、5、6泳道为GG型。 |
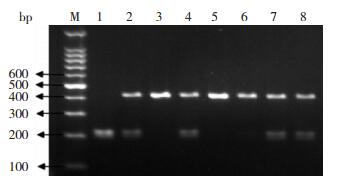
|
图 2 -1722位点酶切产物电泳图 M为DNA Ladder,3、5、6泳道为TT型,2、4、7、8泳道为TC型,1泳道为CC型。 |
2.2 HSP患儿基因多态性分布情况
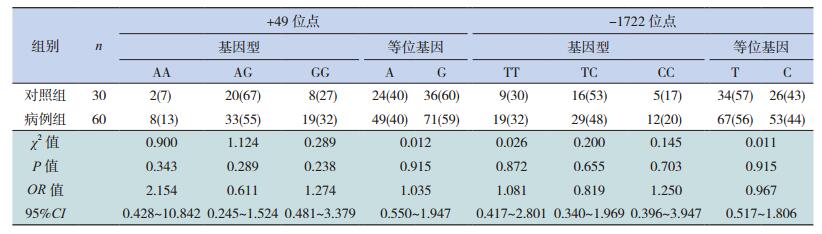
分别将CTLA-4 +49位点AA、AG、GG基因型频率及A、G等位基因频率在病例组和对照组之间进行比较,差异无统计学意义(P>0.05);分别将-1722位点TT、TC、CC基因型频率及T、C等位基因频率在病例组和对照组之间进行比较,差异无统计学意义(P>0.05)。见表 1。
| 表 1 病例组与对照组+49位点与-1722位点基因型及等位基因频率的比较[例(%)] |
2.3 有无肾脏损害对HSP患儿基因多态性分布的影响
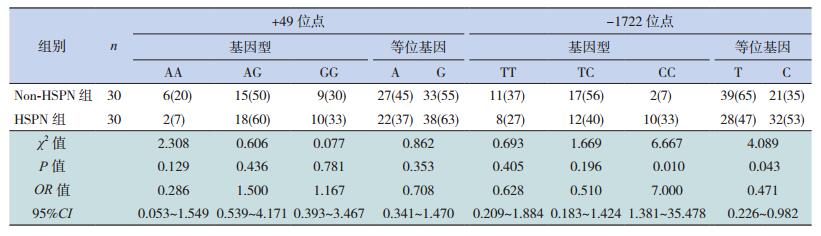
依据有无肾脏损害,将病例组分为HSPN组与Non-HSPN组。将CTLA-4 +49位点AA、AG、GG基因型频率及A、G等位基因频率在HSPN组与Non-HSPN组间进行比较,差异无统计学意义(P>0.05);将-1722位点TT、TC、CC基因型频率在HSPN组与Non-HSPN组间进行比较,CC基因型频率在两组间差异有统计学意义(P < 0.05),CC基因型为HSPN发病的危险因素;将-1722位点T、C等位基因频率在HSPN组与Non-HSPN组间进行比较,差异有统计学意义(P < 0.05),C等位基因为HSPN发病的危险因素。见表 2。
| 表 2 Non-HSPN组与HSPN组+49位点与-1722位点基因型及等位基因频率的比较[例(%)] |
2.4 性别对HSP患儿基因多态性分布的影响
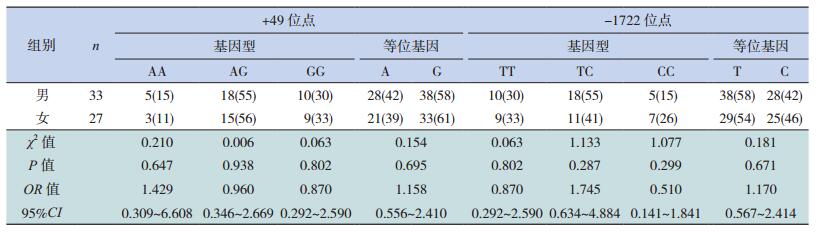
将病例组按照性别分为男女两组。分别将CTLA-4 +49位点AA、AG、GG基因型频率及A、G等位基因频率在男女两组之间进行比较,差异无统计学意义(P>0.05);分别将-1722位点TT、TC、CC基因型频率及T、C等位基因频率在男女两组之间进行比较,差异无统计学意义(P>0.05)。见表 3。
| 表 3 不同性别组+49位点与-1722位点基因型及等位基因频率的比较[例(%)] |
2.5 +49位点与-1722位点组合后对HSP患儿基因多态性分布的影响
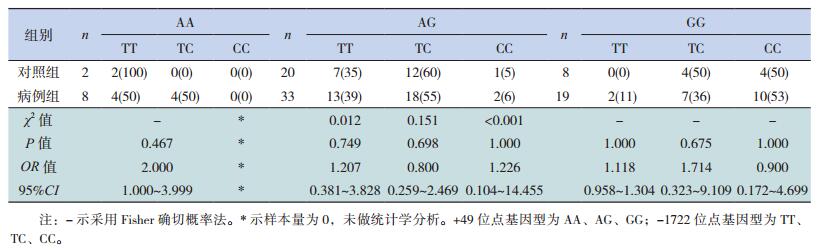
将+49位点与-1722位点组合后分析。以+49位点为参照,将+49位点的AA、AG、GG基因型分别与-1722位点的TT、TC、CC基因型进行两两组合,在病例组与对照组间进行比较,差异无统计学意义(P>0.05)(表 4);在HSPN组与Non-HSPN组间进行比较,结果表明,当+49位点的GG基因型与-1722位点的CC基因型组合后,差异有统计学意义(P < 0.05)(表 5);在男女两组间进行比较,差异无统计学意义(P>0.05)(表 6)。
| 表 4 +49位点与-1722位点各组合基因型频率在病例组与对照组的比较[例(%)] |
| 表 5 +49位点与-1722位点各组合基因型频率在HSPN组与Non-HSPN组的比较[例(%)] |
| 表 6 +49位点与-1722位点各组合基因型频率在不同性别组的比较[例(%)] |
3 讨论
HSP是儿童时期常见的系统性血管炎性疾病,免疫紊乱是HSP发病的关键,包括体液免疫、细胞免疫及免疫分子的参与。患者体内CD4+/CD8+及Th1/Th2比值发生异常,T细胞功能紊乱,导致多种免疫分子分泌异常,B细胞多克隆活化,促使免疫球蛋白分泌增多,尤其是IgA,IgA免疫复合物沉积于皮肤、内脏血管内皮及肾脏组织,引起血管损伤出血及肾脏损害,出现相应临床症状。
HSP在亚洲人群的发病率高于白种人,而黑人的发病率最低,且该病发病具有一定家族聚集性,家族中常见聚集倾向,同胞中可见先后发病者。随着基因水平研究技术的提高和深入,学者们对于HSP与基因的研究也越来越多。人类基因组存在着广泛的多态性,随着基因组计划的步伐不断前进,人们越来越认为基因多态性对于阐明人体对疾病的易感性和耐受性,疾病不同的临床表现,以及机体对药物治疗效果的不同起着重要的作用。基因部分位点突变后出现不同程度的碱基缺失或者高频率携带某个等位基因,均可使患者成为疾病易感者,也影响HSP疾病进展及预后,并提示个体的遗传背景可能与疾病的临床表型之间存在着某种联系。积极寻找与HSP相关的多态性基因位点,可进一步完善HSP的发病机制,了解疾病的基因易感性,预测病理进展,判断预后,并可为治疗开辟新的道路。
CTLA-4 +49位点为自身免疫性疾病中研究最多的一个位点,体外研究表明,等位基因G引起CTLA-4蛋白亚细胞定位异常,最终影响其功能,并导致CTLA-4的无效糖基化,影响其分子表达[11]。普遍研究认为,+49位点的A/G多态性与SLE[4]、GD[5]以及RA[9]等自身免疫性疾病存在相关性,一定程度上增加疾病的患病风险。Wang等[12]对中国西部110名儿童HSP的研究认为,+49位点GG基因型及G等位基因不是HSP的易感基因,但可增加HSPN的发病风险,Soylemezoglu等[13]对土耳其100名HSP患儿的研究认为+49位点基因多态性与HSP及HSPN均无相关性。本研究结果显示,+49位点AA、AG、GG基因型频率及A、G等位基因频率在HSP组与对照组间差异无统计学意义,在HSPN组与Non-HSPN组间差异亦无统计学意义,表明+49位点A/G基因多态性与HSP和HSPN不存在相关性,与Soylemezoglu等[13]对土耳其HSP患儿的分析结果相一致,与Wang等[12]对中国西部HSP患儿的分析结果相反,这种差异原因可能如下:(1)样本量的选择过少,导致实验结果存在偏倚,可继续加大样本量进行研究证实。(2)+49位点的G等位基因分布可能具有地区差异,土耳其及中国陕西省儿童携带G突变基因者较少,而中国西部地区儿童携带者较多,尚需多地区、多种族、多国家来进一步研究证实。Ohl等[14]对原发性肾病综合征患儿的研究显示,+49位点GG基因型及G等位基因与儿童微小病变肾病相关,可推测,+49位点的A/G基因多态性可作为原发性肾病微小病变的预测指标,但本研究提示此位点对继发性HSPN无预测意义,由此可将此位点基因多态性作为原发性肾病与继发性HSPN的参考鉴别指标;继发性肾脏损害除了HSPN,还包括乙肝病毒相关性肾炎和狼疮性肾炎,目前尚未发现+49位点基因多态性与后两种疾病的相关性研究,故关于此位点基因多态性是否可作为原发性肾病和继发性肾脏损害的鉴别指标,还有待进一步探讨。本研究将HSP组按照性别分层后进一步分析,发现+49位点各基因型及等位基因频率在男女两组比较差异无统计学意义,说明HSP患儿男女之间+49位点基因型及等位基因频率分布基本相同。
CTLA-4基因-1722位点是另外一个高频突变位点,已有研究发现,-1722位点基因多态性为SLE[15]及MG[7]的易感基因,而关于此位点基因多态性与HSP的研究,国内外未见相关报道,故本研究为首次将HSP与-1722T/C基因多态性进行相关性分析。结果显示,-1722位点CC基因型及C等位基因在HSPN组与Non-HSPN组间比较差异有统计学意义,说明CC基因型及C等位基因与HSPN的发病相关,可增加HSP患儿发生肾脏损害的风险,分析原因,可能是此位点的T→C突变影响CTLA-4的分子表达,使其对T细胞的抑制作用减弱,T细胞大量增殖活化,导致免疫分子分泌异常,加重对肾脏的损害。而-1722位点TT、TC、CC基因型及T、C等位基因在HSP组与对照组间差异无统计学意义,说明-1722位点T/C基因多态性与HSP的发病无相关性。将HSP组按照性别分层后发现,-1722位点各基因型及等位基因频率在男女两组比较差异无统计学意义,说明HSP患儿男女之间-1722位点基因型及等位基因频率分布基本相同。关于此位点基因多态性与HSP及HSPN的相关性尚需加大样本量去进一步研究证实。
本研究将+49位点各基因型与-1722位点各基因型进行组合分析,发现+49位点GG基因型和-1722位点CC基因型组合后,在HSPN组与Non-HSPN组间比较差异有统计学意义,说明+49位点GG及-1722位点CC组合基因型与HSPN的发病相关,且与单一基因型作用相比,可明显增加HSPN发病风险,可能是组合基因型对CTLA-4的表达及功能影响更大所致。将两个位点其他基因型组合后分析,未发现与HSP及HSPN的相关性。因组合后样本量减少,故仍需加大样本量去分析证实。
综上所述,CTLA-4作为维持机体免疫稳态的一个重要分子,其基因多态性与HSP有着密切的联系,-1722位点CC基因型及C等位基因可增加HSP发生肾脏损害的风险。虽然其具体机制尚不能明确,但CTLA-4基因多态性对HSP的易感性、预后判断和治疗有着重要的意义。
| [1] | Yang YH, Yu HH, Chiang BL. The diagnosis and classification of Henoch-Schönlein purpura:an updated review[J]. Autoimmun Rev, 2014, 13 (4-5): 355–358. DOI:10.1016/j.autrev.2014.01.031 |
| [2] | Gardner D, Jeffery LE, Sansom DM. Understanding the CD28/CTLA-4(CD152) pathway and its implications for costimulatory blockade[J]. Am J Transplant, 2014, 14 (9): 1985–1991. DOI:10.1111/ajt.12834 |
| [3] | Auchincloss H, Turka LA. CTLA-4:not all costimulation is stimulatory[J]. J Immunol, 2011, 187 (7): 3457–3458. DOI:10.4049/jimmunol.1102316 |
| [4] | 周艳, 肖林生. SLE患者CTLA-4基因多态性与ANA、抗dsDNA抗体相关性研究[J]. 临床检验杂志, 2010, 28 (1): 48–50. |
| [5] | Esteghamati A, Khalilzadeh O, Mobarr Z, et al. Association of CTLA-4 gene polymorphism with Graves' disease and ophthalmopathy in Iranian patients[J]. Eur J Intern Med, 2009, 20 (4): 424–428. DOI:10.1016/j.ejim.2008.12.005 |
| [6] | Ahmadi S, Rostamzadeh J, Khosravi D, et al. Association of CTLA-4 gene 49A/G polymorphism with the incidence of type 1 diabetes mellitus in the Iranian Kurdish population[J]. Pak J Biol Sci, 2013, 16 (24): 1929–1935. DOI:10.3923/pjbs.2013.1929.1935 |
| [7] | Wang XB, Kakoulidou M, Qiu Q, et al. CDS1 and promoter single nucleotide polymorphisms of the CTLA-4 gene in human myasthenia gravis[J]. Genes Immun, 2002, 3 (1): 46–49. DOI:10.1038/sj.gene.6363816 |
| [8] | Wagner M, Sobczyński M, Karabon L, et al. Polymorphisms in CD28, CTLA-4, CD80 and CD86 genes may influence the risk of multiple sclerosis and its age of onset[J]. J Neuroimmunol, 2015, 288 : 79–86. DOI:10.1016/j.jneuroim.2015.09.004 |
| [9] | Elshazli R, Settin A, Salama A. Cytotoxic T lymphocyte associated antigen-4(CTLA-4) +49 A>G gene polymorphism in Egyptian cases with rheumatoid arthritis[J]. Gene, 2015, 558 (1): 103–107. DOI:10.1016/j.gene.2014.12.046 |
| [10] | 胡亚美, 汪载芳, 申昆玲, 等. 诸福棠实用儿科学 (第8版)[M]. 北京: 人民卫生出版社, 2015: 773-775. |
| [11] | Ksiaa Cheikhrouhou L, Lakhoua-Gorgi Y, Sfar I, et al. Natural evolution of hepatitis C virus infection in hemodialysis Tunisian patients and CTLA-4 SNP's[J]. World J Gastroenterol, 2015, 21 (35): 10150–10158. |
| [12] | Wang JJ, Shi YP, Yue H, et al. CTLA-4 exon 1+49A/G polymorphism is associated with renal involvement in pediatric Henoch-Schönlein purpura[J]. Pediatr Nephrol, 2012, 27 (11): 2059–2064. DOI:10.1007/s00467-012-2216-7 |
| [13] | Soylemezoglu O, Peru H, Gonen S, et al. CTLA-4+49 A/G genotype and HLA-DRB1 polymorphisms in Turkish patients with Henoch-Schönlein purpura[J]. Pediatr Nephrol, 2008, 23 (8): 1239–1244. DOI:10.1007/s00467-008-0837-7 |
| [14] | Ohl K, Eberhardt C, Spink C, et al. CTLA4 polymorphisms in minimal change nephrotic syndrome in children:a case-control study[J]. Am J Kidney Dis, 2014, 63 (6): 1074–1075. DOI:10.1053/j.ajkd.2014.01.427 |
| [15] | Zhai JX, Zou LW, Zhang ZX, et al. CTLA-4 polymorphisms and systemic lupus erythematosus (SLE):a meta-analysis[J]. Mol Biol Rep, 2013, 40 (9): 5213–5223. DOI:10.1007/s11033-012-2125-7 |
 2017, Vol. 19
2017, Vol. 19