慢性心力衰竭(chronic heart failure, CHF)是心室收缩或舒张功能障碍导致心输出量不足,组织血流灌注减少,造成神经内分泌系统过度激活,引起一系列病理生理改变的一种复杂的临床综合征[1]。心室重塑是心衰发生发展中的重要环节,由一系列分子和细胞机制导致心肌结构、功能和表型的变化,神经内分泌系统的长期、慢性激活将会促进心室重塑,加重心肌损伤和功能恶化,因此,阻断神经内分泌系统和心室重塑是治疗心衰的关键环节之一。
嗜铬粒蛋白A(chromogranin A, CgA)是由肾上腺髓质嗜铬细胞和其它神经内分泌细胞分泌的一种可溶性多肽类物质,是由439个氨基酸组成的酸性亲水性蛋白质,分子量为49 kDa,临床用于前列腺癌、嗜铬细胞瘤、胃肠胰腺等神经内分泌肿瘤的诊断及预后评价[2],近年来在心血管系统中的表达也受到关注。
尾加压素Ⅱ(human urotensin Ⅱ, U Ⅱ)是迄今为止发现的最强大的缩血管活性肽[17],可增强儿茶酚胺、内皮素、血管紧张素Ⅱ的作用,在高血压、动脉粥样硬化、肺动脉高压,糖尿病,肾功能衰竭,代谢综合征等疾病中的表达显著增高[3-4]。U Ⅱ在心室重塑中发挥重要作用,Bousette[5]报道利用UⅡ受体拮抗剂可减少实验动物的心室重塑。
本研究旨在通过测定不同程度CHF患者的CgA和U Ⅱ水平变化,探讨二者与心功能分级及心室重塑之间的关系,并进一步分析两者之间的相关性。
1 资料与方法 1.1 研究对象选取2015年6月至2016年6月郑州大学第一附属医院儿科确诊为CHF的58例患儿为心衰组,其中心内膜弹力纤维增生症(endocardial fibroelastosis, EFE)17例、扩张型心肌病(dilated cardiomyopathy, DCM)41例。心衰组中男30例,女28例,年龄4.0(0.9,9.0)岁。心衰诊断及心功能分级(NYHA心功能分级或改良的Ross评分)参照2006年中华医学会儿科学分会心血管组制定的《小儿心力衰竭诊断与治疗建议》 [6]。排除标准:先天性心脏病、急性心功能不全、严重肝肾功能不全;急性感染、恶性肿瘤、外伤、结缔组织病引起的心功能不全;以及高血压、糖尿病、代谢综合征引起的心功能不全。
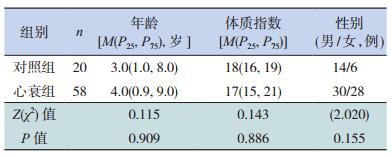
另选取同期我院门诊行健康体检的儿童20例为对照组,其中男14例、女6例,年龄3.0(1.0,8.0)岁。心衰组与对照组在年龄、性别、体质指数的差异无统计学意义(P>0.05),见表 1。本研究获得医院伦理委员会批准,并获得所有入组儿童家长的知情同意。
| 表 1 两组儿童一般情况比较 |
1.2 标本采集
心衰组和对照组均采集清晨空腹静脉血2 mL,室温静置30 min,3 000 r/min离心10 min,将血清分装于EP管中,于-80℃冷冻保存。
1.3 标志物测定CgA及U Ⅱ均采用酶联免疫吸附法(ELISA)检测;氨基末端脑钠肽前体(N-terminal pro-brain natriuretic peptide, NT-pro BNP)采用双向侧流免疫法测定。试剂盒由上海酶联生物科技有限公司生产,批号201605。操作按照试剂盒说明书进行。
1.4 心室重塑参数测定应用PHILIP公司IE33型多普勒超声心动图测定心衰组左心室舒张末径(LVEDD)、舒张末期室间隔厚度(IVSD)、舒张末左心室后壁厚度(PWT)等左心室重塑指标,并记录左室射血分数(LVEF)、左室短轴缩短率(LVFS)。探头频率2.5 Hz。超声由经验丰富的医师完成。依据Devereux公式[7]计算左心室质量(LVM)。
LVM=1.04×[(LVEDD+IVSD+PWT)3-LVEDD3]-14
左心室质量分数(LVMI)=LVM/体表面积。
1.5 统计学分析应用SPSS 21.0统计软件进行数据处理。正态分布的计量资料采用均数±标准差(x±s)表示;非正态分布的计量资料采用中位数(四分位间距)[M(P25,P75)]表示。计量资料的两组间比较采用Mann-Whitney U检验,多组之间比较采Kruskal-Wallis检验。计数资料采用例数表示,两组间比较采用χ2检验。关联性分析采用Pearson相关或Spearman相关分析。P < 0.05为差异有统计学意义。
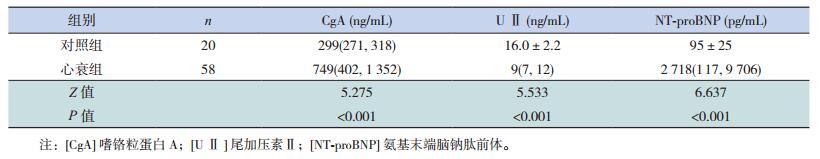
2 结果 2.1 心衰组和对照组的CgA、U Ⅱ及NT-pro BNP浓度比较与对照组相比,心衰组血清CgA浓度、NT-proBNP浓度高于对照组,U Ⅱ浓度低于对照组,差异均具有统计学意义(P < 0.05),见表 2。
| 表 2 心衰组与对照组CgA、U Ⅱ及NT-proBNP的浓度比较[x±s或M(P25,P75)] |
2.2 不同心功能组与对照组CgA、U Ⅱ及NTproBNP浓度的比较
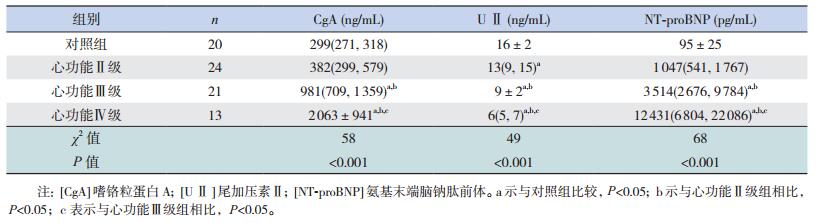
心功能Ⅱ级组的血清CgA、NT-proBNP水平与对照组的差异没有统计学意义(P>0.05)。心功能Ⅲ级、Ⅳ级组的CgA、NT-pro BNP水平高于对照组(P < 0.05);并且随着心功能损害加重而逐渐升高,差异有统计学意义(P < 0.05)。心功能Ⅱ级、Ⅲ级、Ⅳ级组患儿的U Ⅱ浓度均低于对照组(P < 0.05),并且随着心功能损害加重而逐渐降低(P < 0.05)。见表 3。
| 表 3 不同心功能组与对照组血清生化标志物浓度比较[x±s或M(P25,P75)] |
2.3 EFE与DCM所致心衰患儿的血清CgA、U Ⅱ水平比较
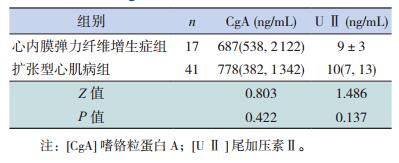
EFE组和DCM组的血清CgA、U Ⅱ浓度差异无统计学意义(P>0.05),见表 4。
| 表 4 心内膜弹力纤维增生症与扩张型心肌病所致心衰患儿的血清CgA、U Ⅱ水平比较[x±s或M(P25,P75)] |
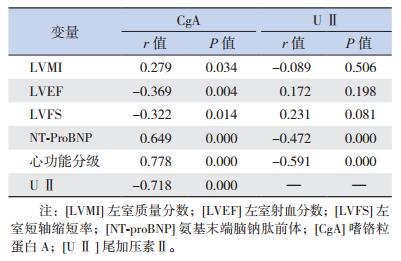
2.4 CgA、U Ⅱ与LVMI、LVEF、LVFS、NTproBNP及心功能分级的相关性分析
血清CgA浓度分别与LVMI、NT-proBNP,以及心功能分级之间成正相关(P < 0.05),与LVEF、LVFS、U Ⅱ之间成负相关(P < 0.05);血清U Ⅱ分别与NT-proBNP、心功能分级成负正相关(P < 0.05),而与LVMI、LVEF、LVFS无明显相关关系(P>0.05)。见表 5。
| 表 5 CgA、U Ⅱ与LVMI、LVEF、LVFS、NT-proBNP及心功能分级的相关性分析 |
3 讨论
神经内分泌因子在心力衰竭的发生发展过程中发挥重要的作用,CgA是神经内分泌细胞的分泌产物,具有扩张冠状动脉,拮抗肾上腺素、内皮素等作用[8-9]。既往研究表明,血清CgA水平在慢性心衰病人显著升高,且与心衰严重程度成正相关[10, 20],Steiner[11]等证实,CgA与心房钠尿肽(ANP)共同定位于大鼠心房内分泌颗粒内;而Pieroni[12]等证实,CgA与BNP共同表达于人心肌细胞内,并且与BNP水平成正相关。本文结果表明,慢性心衰患儿血清CgA水平高于对照组,并且随着心功能损害加重而升高,与NT-proBNP、心功能分级、LVEF呈现正相关。在分子水平上,Tota[9]等发现,CgA在体内的半衰期为18 min,在蛋白水解酶的作用下衍生成以下几种主要的生物活性多肽:(1)血管抑制因子1(vasostatin1, VS-1)及VS-2,氨基酸片段为1-76、1-113;(2)儿茶酚胺抑素(catestatin, Cst),氨基酸片段344-364;(3)Serpinin,氨基酸片段403-428。其中VS-1、VS-2和Cst发挥抗肾上腺素和内皮素的作用,从而抑制心肌过度收缩和舒张,扩张冠状动脉,发挥心血管保护作用[13];Serpinin则发挥肾上腺素能激动剂的作用,加强心肌收缩和舒张,是心血管疾病的风险因子。CgA衍生的3种主要片段相互拮抗,共同维护心血管自稳态的动态平衡。然而,本文只涉及血清CgA水平,对于CgA衍生片段的作用仍需进一步的研究。此外,Pasqua[14]证实,CgA对心肌和冠脉的效应具有浓度依赖性,在低浓度(0.1~4 nmol/L)时发挥效应,在高浓度(10 nM~16 nmol/L)时效应消失。
U Ⅱ是11个氨基酸的环状多肽,首先发现于虾虎鱼的尾垂腺中,尔后相继在哺乳动物体内发现,并与多种病理状态相关[15-17]。Ames于1999年发现U Ⅱ的受体,即孤立的G蛋白偶联受体(GPR14),主要表达在心、脑、肾、肾上腺等部位,并且发现小剂量的U Ⅱ可使灵长类动物心输出量增加,大剂量(>30 pg/kg)导致浓度依赖性心功能下降和心输出量减低[17-18]。U Ⅱ与其受体结合,能够引起血管收缩,促进血管平滑肌细胞和心肌成纤维细胞增殖,促使Ⅰ型和Ⅲ型胶原纤维合成,参与心力衰竭、心室重塑[19]。关于U Ⅱ在慢性心衰患者血清中的变化目前仍有争议[4]。本研究发现,心衰组U Ⅱ水低于对照组,且与NTproBNP、心功能分级、LVEF成负相关,这与贺兆发、钟萍等[20-22]研究结果一致。其可能的机制如下:(1)Douglas等[23]证实,早期CHF患者有弱而集中的U Ⅱ mRNA表达和免疫活性,终末期CHF患者心肌细胞有更强的U Ⅱ表达,主要集中在心肌细胞、内皮细胞等,因此U Ⅱ可能通过自分泌、旁分泌方式在心肌局部发挥作用,使之在循环系统中的浓度并没有明显的增加;(2)CHF病程中,机体产生过多的缩血管物质,如内皮素、血管紧张素等,通过负反馈调节减少U Ⅱ分泌,使得外周血U Ⅱ浓度减少;(3)U Ⅱ是否存在组织利用增加、排泄增加抑或循环过程中衰减,有待进一步研究证实。
心室重塑是CHF发生、发展的基本机制。在心室重塑过程中,各种心肌保护因子和损伤因子相互作用,共同维护内环境的平衡。谢烨卿[24]等发现,扩张性心肌病患者心肌的CgA水平与Ⅰ型、Ⅲ型胶原纤维mRNA表达呈正相关,并且免疫组化中CgA阳性区域附近的纤维化明显,CgA在分子水平参与了对纤维母细胞的粘附和伸展作用,与心室重塑有关[25]。LVMI是结合左心室舒张末径(LVEDD)、舒张末室间隔厚度(IVSD)、舒张末左心室后壁厚度(PWT)等的一个心室重塑指标。本研究发现,CgA与LVMI、LVEF、LVFS成正相关,提示其可能参与心室重塑的过程,但缺乏基因学和形态学的进一步研究;而U Ⅱ水平与LVMI无明显相关性,可能与样本量少、个体心室重塑差异、对治疗反应不同等有关。
综上所述,CgA可能参与CHF患儿心室重塑,血清CgA和U Ⅱ有可能为心衰的诊断和心功能判断提供参考。具体机制有待进一步研究。
| [1] | 黄国英.心力衰竭[M]//江载芳, 申昆玲, 沈颖.诸福棠实用儿科学下册.第8版.北京:人民卫生出版社, 2015:1603-1616. |
| [2] | Eriksson B, Oberg K, Stridsberg M. Tumor markers in neuroendocrine tumors[J]. Digestion, 2000, 62 (Suppl1): 33–38. |
| [3] | Richards AM, Nicholls MG, Lainchbury JG, et al. Plasma urotensin Ⅱ in heart failure[J]. Lancet, 2002, 360 (9332): 545–546. DOI:10.1016/S0140-6736(02)09709-X |
| [4] | Ross B, McKendy K, Giaid A. Role of urotensin Ⅱ in health and disease[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298 (5): R1156–1172. DOI:10.1152/ajpregu.00706.2009 |
| [5] | Bousette N, Pottinger J, Ramli W, et al. Urotensin-Ⅱ receptor blockade with SB-611812 attenuates cardiac remodeling in experimental ischemic heart disease[J]. Peptides, 2006, 27 (11): 2919–2926. DOI:10.1016/j.peptides.2006.06.011 |
| [6] | 中华医学会儿科学分会心血管学组, 《中华儿科杂志》编辑委员会. 小儿心力衰竭诊断与治疗建议[J]. 中华儿科杂志, 2006, 44 (10): 753–757. |
| [7] | Devereux RB, Reichek N. Echocardiographic determination of left ventricular mass in man. Anatomic validation of the method[J]. Circulation, 1977, 55 (4): 613–618. DOI:10.1161/01.CIR.55.4.613 |
| [8] | 李佳. 嗜铬粒蛋白A研究进展[J]. 中华实用诊断与治疗志, 2012, 26 (6): 527–528. |
| [9] | Tota B, Angelone T, Cerra MC. The surging role of chromogranin A in cardiovascular homeostasis[J]. Front Chem, 2014, 2 : 64. |
| [10] | 张雯, 宋书凯, 吕孝欣. 慢性心力衰竭患者血清嗜铬粒蛋白A、脑钠肽水平及左室质量指数相关性研究[J]. 临床合理用药, 2011, 4 (5A): 3–4. |
| [11] | Steiner HJ, Weiler R, Ludescher C, et al. Chromogranins A and B are co-localized with atrial natriuretic peptides insecretory granules of rat heart[J]. J Histochemistry Cytochem, 1990, 38 (6): 845–850. DOI:10.1177/38.6.2139887 |
| [12] | Pieroni M, Corti A, Tota B, et al. Myocardial production of chromogranin A in human heart:a new regulatory peptide of cardiac function[J]. European Heart J, 2007, 28 (9): 1117–1127. DOI:10.1093/eurheartj/ehm022 |
| [13] | Goelze JP, Alehaqen U, Flyvbjerg A, et al. Chromogranin A as a biomarker in cardiovascular disease[J]. Biomarkers Med, 2014, 8 (1): 133–140. DOI:10.2217/bmm.13.102 |
| [14] | Pasqua T, Corti A, Gentile S, et al. Full-length human chromogranin-A cardioactivity:myocardial, coronary, and stimulus-induced processing evidence in normotensive and hypertensivemale rat hearts[J]. Endocrinology, 2013, 154 (9): 3353–3365. DOI:10.1210/en.2012-2210 |
| [15] | Pearson D, Shively JE, Clark BR, et al. Urotensin Ⅱ:a somatostatin-like peptidein the caudal neurosecretory system of fishes[J]. Proc Natl Acad Sci U S A, 1980, 77 (8): 5021–5024. DOI:10.1073/pnas.77.8.5021 |
| [16] | Prosser HCG, Leprince J, Vaudry H, et al. Cardiovascular effects of native and non-native urotensin Ⅱ and urotensin Ⅱ-related peptide on rat and salmon hearts[J]. Peptides, 2006, 27 (12): 3261–3268. DOI:10.1016/j.peptides.2006.09.012 |
| [17] | Ames RS, Sarau HM, Chambers JK, et al. Human urotensin-Ⅱ is a potent vasoconstrictor and agonist for the orphan receptor GPR14[J]. Nature, 1999, 401 (6750): 282–286. DOI:10.1038/45809 |
| [18] | Matsushita M, Shichiri M, Imai T, et al. Co-expression of urotensin Ⅱ anditsreceptor (GPR14) in human cardiovascular and renal tissues[J]. J Hypertens, 2001, 19 (12): 2185–2190. DOI:10.1097/00004872-200112000-00011 |
| [19] | Liu W, Han Q, Liu Q, et al. An investigation into the expression and mechanism of action of urotensin Ⅱ in chronic pressure-overloaded rat hearts[J]. Mol Med Rep, 2015, 12 (5): 6626–6634. |
| [20] | 贺兆发, 高占群, 金梅花, 等. 慢性心衰患者血浆尾加压素Ⅱ与嗜铬粒蛋白A的相关性[J]. 心血管康复医学杂志, 2011, 20 (2): 123–125. |
| [21] | 钟萍, 李志樑, 吴宏超, 等. 心力衰竭患者血浆尾加压素Ⅱ与心钠素关系的研究[J]. 中国循环杂志, 2003, 18 (2): 132–134. |
| [22] | 宋爱新. 尾加压素Ⅱ、NT-proBNP在慢性心力衰竭患者重的变化及其相关性[J]. 中国实用医药, 2012, 7 (13): 88–90. |
| [23] | Douglas SA, Tayara L, Ohlstein EH, et al. Congestive heart failure and expression of myocardial urotensin Ⅱ[J]. Lancet, 2002, 359 (9322): 1990–1997. DOI:10.1016/S0140-6736(02)08831-1 |
| [24] | 谢烨卿, 陈瑞珍, 虞勇, 等. 扩张型心肌病中嗜铬粒蛋白A的表达及其与心肌纤维化的关系[J]. 中华心血管病杂志, 2009, 37 (12): 1081–1084. |
| [25] | Ratti S, Curnis F, Longhi R, et al. Structure-activity relationship of chromogranin A in cell adhesion. Identification of an adhesion site for fibroblasts and smooth muscle cells[J]. J Biolo Chem, 2000, 275 (38): 29257–29263. DOI:10.1074/jbc.M003796200 |
 2017, Vol. 19
2017, Vol. 19