2. 上海交通大学附属儿童医院新生儿科, 上海 200062;
3. 南京医科大学附属儿童医院儿童保健科, 江苏 南京 210008
脓毒症(sepsis)是指由感染引起的全身炎症反应综合征,全球每年有超过1 800万严重脓毒症病例,美国每年有75万例脓毒症患者,并且这一数字还以每年1.5%~8.0%的速度上升。全球每天约14 000人死于其并发症,美国每年约21.5万人死亡[1-2]。重症监护病房中约40%的患者患有脓毒症,病死率高达36%[3]。儿童严重脓毒症的发病率是0.56/1 000,以婴儿的发病率最高,病死率为10.3%,有基础疾病患儿病死率上升至
12.8% [4-5]。近年来,尽管对脓毒症的发病机制、临床特征的认识不断提高,各种器官功能支持技术不断进步,但到目前为止,脓毒症的发病机制仍不明确,治疗手段有限且不确切,其病死率未见下降。炎症反应及免疫功能紊乱是脓毒症的重要病理生理改变,直接影响着疾病的发生和发展,而机体免疫功能紊乱可能是导致脓毒症患者预后差的关键因素,免疫功能紊乱与大量淋巴细胞凋亡及免疫受抑状态密切相关[6-7]。ω-3多不饱和脂肪酸(ω-3 polyunsaturated fatty acids, ω-3PUFAs)提炼于深海鱼油,主要成分为α-亚麻酸、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的脂肪乳。研究表明[8-9],ω-3PUFAs不仅可以为机体提供能量和底物,还可以调控机体的炎症反应、增强免疫功能,所以又称为免疫营养素或免疫调节因子,应用ω-3PUFAs治疗脓毒症可以降低炎性细胞因子的水平,提高气体交换功能,缩短患者的住院日,提高患者的生存率。目前的研究主要集中在ω-3PUFAs对脓毒症炎症反应机制的作用,对脓毒症发病过程中淋巴细胞凋亡的影响还不清楚。本研究拟观察ω-3PUFAs对脓毒症大鼠脾脏和胸腺淋巴细胞凋亡发生情况的影响,并进一步探讨其作用机制。
1 材料与方法 1.1 实验动物和试剂80只SPF级7~8周龄雌性Sprague-Dawley(SD)大鼠,体重200~220 g,购于北京维通利华实验动物技术有限公司南京分公司。传统脂肪乳剂和ω-3鱼油脂肪乳注射液(100 mL含10 g ω-3PUFAs)购于无锡华瑞制药有限公司;原位细胞凋亡检测试剂盒(德国Roche公司)。
1.2 模型制备采用盲肠结扎穿孔法(CLP)[10]制作脓毒症大鼠模型,SD大鼠于江苏省动物实验中心饲养1周以上,术前称重,大鼠模型制作前不禁食水。应用乙醚吸入麻醉,备皮,取前腹正中切口2~3 cm,游离肠系膜和盲肠,自盲肠远端顶点为起点,4号线于盲肠中点处结扎,应用21号针头采取单次贯通穿刺盲肠方法于肠系膜端穿透至对侧,穿刺过程中注意避免损伤盲肠动脉盲肠支,挤出肠内容物少许,酒精棉球拭净,逐层关腹。术后分笼喂养,恢复正常饮食和补充水,观察大鼠精神、饮食情况变化。
1.3 动物分组及治疗建模后,将SD大鼠随机分成模型组、传统脂肪乳剂治疗组(每日0.1 g/kg)、ω-3PUFAs低剂量治疗组(每日0.1 g/kg)、ω-3PUFAs中剂量治疗组(每日0.2 g/kg)和ω-3PUFAs高剂量治疗组(每日0.3 g/kg)。每组再按动物处死时间分为24 h和72 h两个亚组,每组8只大鼠。建模后即刻,脂肪乳剂和ω-3PUFAs分别用葡萄糖注射液稀释到1.5 mL后尾静脉注射给药,模型组予等量葡萄糖注射液尾静脉注射,以后每天1次,直到预定时间点处死。本次实验ω-3PUFAs的剂量参照Heller等[11]的研究。
1.4 标本留取由于脓毒症时淋巴细胞的凋亡于24 h达高峰,以后逐渐下降,持续数天左右[12]。本次实验设计各组分别于术后24 h和72 h时间点处死动物,切除胸腺及脾脏组织,用于后续实验待测。
1.5 苏木精-伊红染色观察胸腺和脾脏病理改变取大鼠胸腺和脾脏组织,10%甲醛固定标本后,24 h内用石蜡包埋切片;切片经二甲苯20 min、100%乙醇→95%乙醇→75%乙醇(各3 min)梯度脱蜡,自来水冲洗2 min;苏木精染色30 min,取出自来水冲洗2 min;盐酸乙醇分化5 s,自来水冲洗2 min;伊红5 s,自来水冲洗2 min;95%乙醇→100%乙醇→二甲苯(各3 min)脱水透明;中性树胶封片,在光学显微镜下观察拍照,观察胸腺和脾脏病理改变。
1.6 脾脏和胸腺淋巴细胞凋亡测定取脾脏和胸腺组织石蜡切片,每个样本随机取3张切片,常规脱蜡、水化后,用焦碳酸二乙酯水溶液处理30 min,按试剂盒说明书进行TUNEL染色。具体步骤:石蜡切片于染色缸中,二甲苯浸洗2次共5 min,梯度乙醇浸洗3 min×5次;3%H2O2甲醇中浸洗20 min,抑制内源性过氧化氢酶;用蛋白酶K室温孵育30 min;PBS洗约5 min×2次,此阶段配制TUNEL反应混合物(即配即用,4℃避光);滴加50 μL的TUNEL反应混合液(阴性对照片,混合液中不加TDT),在湿盒中37℃孵育60 min,PBS洗5 min×3次;擦干样品周围的水分,加入50 μL转化剂POD,湿盒中37℃孵育30 min。PBS洗5 min×3次;加入100 μL DAB底物溶液,室温(25℃)孵育10 min,PBS洗5 min×3次;滴加甘油于样本区,盖上盖玻片封片,在普通光镜下随机选择10个高倍镜视野,用显微成像系统和图像分析软件获取和分析实验结果,计算平均凋亡细胞数,即凋亡指数(apoptotic index, AI)=凋亡细胞数/细胞总数×100%。
1.7 统计学分析应用SPSS 19.0及Prism 5.0统计分析软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况术后密切观察大鼠精神状态、生活习性改变发现:CLP术前,大鼠精神好,皮毛干净柔顺,进食饮水主动,嘴唇、前后爪红润,排便排尿正常;CLP术后,出现精神倦怠、活动减少、寒战蜷缩、腹胀、眼角分泌物增多、竖毛以及低体温等表现,处死后发现大鼠空肠肠管胀气,腹腔有较多血性积液,盲肠出现肿胀坏死、发黑、黏连等表现,从而确定脓毒症大鼠模型造模成功。
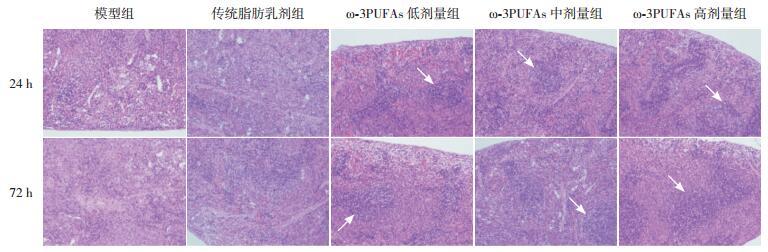
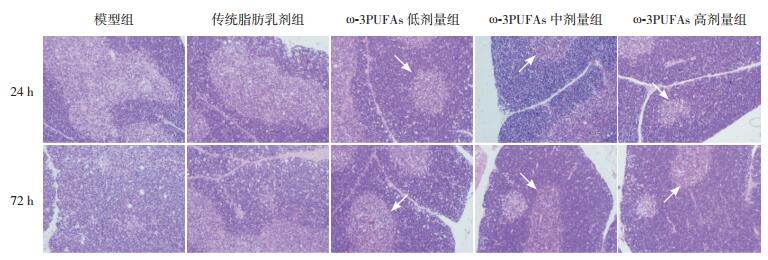
2.2 大鼠脾脏和胸腺的病理变化模型组和传统脂肪乳剂治疗组大鼠脾脏组织红髓和白髓结构紊乱,界限不清,脾小结明显缩小甚至消失,淋巴细胞减少;ω-3PUFAs低剂量、中剂量和高剂量治疗组红髓和白髓结构比较完整,脾小结存在。模型组和传统脂肪乳剂治疗组大鼠胸腺小叶结构欠完整,皮质变薄,皮髓质结构不清,淋巴细胞明显减少;ω-3PUFAs低剂量、中剂量和高剂量治疗组胸腺小叶结构基本恢复,且皮髓质结构清晰,淋巴细胞增多。见图 1~2。
|
图 1 各组大鼠脾脏24 h和72 h病理变化典型图谱(苏木精-伊红染色,×200) 模型组和传统脂肪乳剂治疗组脾脏红髓和白髓结构紊乱,界限不清,脾小结明显缩小甚至消失,淋巴细胞减少;ω-3PUFAs低剂量、中剂量和高剂量治疗组红髓和白髓结构较完整,脾小结存在(白色箭头所示)。 |
|
图 2 各组大鼠胸腺24 h和72 h病理变化典型图谱(苏木精-伊红染色,×200) 模型组和传统脂肪乳剂治疗组胸腺小叶结构欠完整,皮质变薄,皮髓质结构不清,淋巴细胞明显减少;ω-3PUFAs低剂量、中剂量和高剂量治疗组胸腺小叶结构完整,皮髓质结构清晰(白色箭头所示),淋巴细胞增多。 |
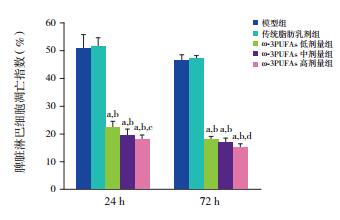
2.3 各组大鼠脾脏淋巴细胞的凋亡
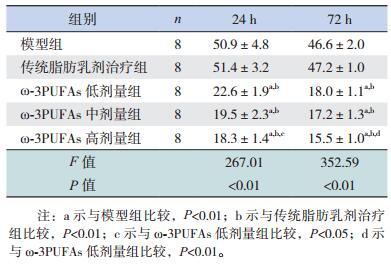
所有ω-3PUFAs治疗组大鼠脾脏淋巴细胞凋亡程度均显著低于模型组及传统脂肪乳剂治疗组(P < 0.01);不同治疗剂量ω-3PUFAs组大鼠脾脏淋巴细胞凋亡指数比较,ω-3PUFAs高剂量组24 h和72 h脾脏淋巴细胞凋亡指数均较ω-3PUFAs低剂量组显著降低(P < 0.05)。见表 1,图 3。
| 表 1 各组大鼠脾脏淋巴细胞凋亡指数比较(x±s,n=8,%) |
|
图 3 各组大鼠脾脏淋巴细胞凋亡指数比较(n=8) a示与模型组比较,P < 0.01;b示与传统脂肪乳剂治疗组比较,P < 0.01;c示与ω-3PUFAs低剂量组比较,P < 0.05;d示与ω-3PUFAs低剂量组比较,P < 0.01。 |
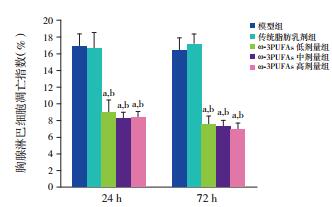
2.4 各组大鼠胸腺淋巴细胞的凋亡
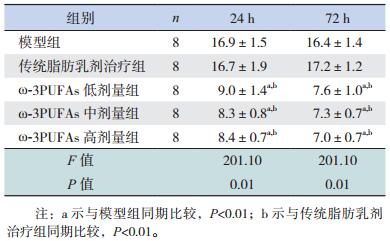
所有ω-3PUFAs治疗组大鼠胸腺淋巴细胞凋亡程度均低于模型组及传统脂肪乳剂治疗组(P < 0.01);不同治疗剂量ω-3PUFAs组大鼠胸腺淋巴细胞凋亡指数比较差异无统计学意义(P > 0.05)。见表 2,图 4。
| 表 2 各组大鼠胸腺淋巴细胞凋亡指数比较(x±s,n=8,%) |
|
图 4 各组大鼠胸腺淋巴细胞凋亡指数比较(n=8) a示与模型组同期比较,P < 0.01;b示与传统脂肪乳剂治疗组同期比较,P < 0.01。 |
3 讨论
脓毒症早期免疫系统被过度激活引起“细胞因子风暴”,以大量促炎介质的释放为主,如TNF-α、IL-1及IL-6等,这些介质通过促进自由基、缓激肽、组胺等物质的产生,激活补体等加重组织损伤[13]。但是,严重脓毒症患者往往由于炎性细胞不能有效激活,抗炎因子产生不足,机体发生免疫抑制[14],表现为免疫及炎症反应紊乱,免疫功能障碍,大量淋巴细胞凋亡伴增殖能力下降,导致T细胞反应降低或无反应[15]。这种低下的炎症反应即免疫麻痹,使得机体更易发生难以控制的继发性感染,也是导致脓毒症患者病情进展的原因之一[16]。近年来越来越多的研究证明淋巴细胞凋亡是脓毒症发病机理中非常重要的过程,也是脓毒症免疫麻痹的重要机制。
胸腺是机体重要的中枢免疫器官,是T淋巴细胞分化和发育成熟的场所,产生淋巴细胞运送至淋巴结和脾脏等处,在机体细胞免疫中占据重要地位。而脓毒症病程中,胸腺有大量淋巴细胞凋亡[17]。脾脏是人体最大的外周免疫器官,是成熟T淋巴细胞(CD3CD4和CD3CD8)和B淋巴细胞定居并发生特异性免疫应答与对抗的场所。在不同类型的脓毒症模型实验中可观察到,淋巴细胞对凋亡刺激的敏感性明显增高,因此可以认为脓毒症时脾脏的免疫功能变化具有代表性。
CLP模型以多重细菌混合感染更接近于人类脓毒症病理生理特性被认作是脓毒症研究的经典动物模型。本实验CLP术后大鼠均出现精神萎靡,体温降低,进食饮水减少,反应迟钝,大便稀溏;解剖发现存在弥漫性腹腔感染及肠道水肿,腹腔积液,肠黏连,盲肠结扎部分坏死,此外结合脾脏胸腺病理切片结果,证实本实验CLP模型符合脓毒症标准。
本实验中所有ω-3PUFAs治疗组大鼠胸腺仍然保持小叶结构,且皮质和髓质分界较传统脂肪乳剂治疗组清晰;脾脏病理切片中,传统脂肪乳剂治疗组脾脏红髓和白髓结构紊乱,脾小结明显缩小或消失,而所有ω-3PUFAs治疗组红髓、白髓结构尚存,可见脾小结结构,表明ω-3PUFAs可以缓解胸腺和脾脏正常组织结构的损伤。应用ω-3PUFAs治疗的脓毒症大鼠,无论是脾脏还是胸腺,24 h和72 h淋巴细胞凋亡程度较模型组和传统脂肪乳剂治疗组均有明显降低,且ω-3PUFAs高剂量组24 h和72 h脾脏淋巴细胞凋亡指数均较ω-3PUFAs低剂量组显著降低。表明ω-3PUFAs治疗脓毒症大鼠具有改善脾脏及胸腺淋巴细胞凋亡的作用,减轻淋巴细胞凋亡的作用可能随剂量增加而增强。分析原因可能是ω-3PUFAs可诱导炎症反应中过度激活的T淋巴细胞的凋亡而减弱促炎反应;另一方面也可能同时具有减少脓毒症机体脾脏和胸腺淋巴细胞的异常凋亡,改善其免疫功能的作用。研究发现,ω-3PUFAs诱导细胞凋亡的作用仅针对过度激活的T细胞以及恶性肿瘤细胞,而正常的细胞则不受侵害[18];同时ω-3PUFAs可抑制促炎反应减少机体损伤,抑制凋亡相关因子如TNF-α等表达[19];还有研究发现,一定剂量的ω-3PUFAs可增加谷胱甘肽过氧化物酶、超氧化物歧化酶等抗氧化应激产物的生成,减缓氧化应激的进展,而活性氧簇正好在细胞凋亡的线粒体途径中发挥了非常重要的作用,能够开启线粒体外膜小孔,直接导致线粒体外膜通透性增高,引发细胞凋亡[20-22]。
综上所述,ω-3PUFAs可以减轻脓毒症大鼠脾脏和胸腺淋巴细胞的凋亡,且减轻淋巴细胞凋亡的程度和剂量大小可能有关,从而可以调节脓毒症大鼠的淋巴细胞免疫反应,但其具体机制仍需进一步研究。
| [1] | Martin GS. Sepsis, severe sepsis and septic shock:changes in incidence, pathogens and outcomes[J]. Expert Rev Anti Infect Ther, 2012, 10 (6): 701–706. |
| [2] | Novosad SA, Sapiano MR, Grigg C, et al. Vital signs:epidemiology of sepsis:prevalence of health care factors and opportunities for prevention[J]. MMWR Morb Mortal Wkly Rep, 2016, 65 (33): 864–869. DOI:10.15585/mmwr.mm6533e1 |
| [3] | Moore LJ, McKinley BA, Turner KL, et al. The epidemiology of sepsis in general surgery patients[J]. J Trauma, 2011, 70 (3): 672–680. |
| [4] | de Souza DC, Barreira ER, Faria LS. The epidemiology of sepsis in childhood[J]. Shock, 2017, 47 (1S Suppl 1): 2–5. |
| [5] | de Souza DC, Shieh HH, Barreira ER, et al. Epidemiology of sepsis in children admitted to PICUs in South America[J]. Pediatr Crit Care Med, 2016, 17 (8): 727–734. |
| [6] | Hotchkiss RS, Monneret G, Payen D. Immunosuppression in sepsis:a novel understanding of the disorder and a new therapeutic approach[J]. Lancet Infect Dis, 2013, 13 (3): 260–268. DOI:10.1016/S1473-3099(13)70001-X |
| [7] | Luan YY, Dong N, Xie M, et al. The significance and regulatory mechanisms of innate immune cells in the development of sepsis[J]. J Interferon Cytokine Res, 2014, 34 (1): 2–15. |
| [8] | Chen S, Zhang H, Pu H, et al. n-3 PUFA supplementation benefits microglial responses to myelin pathology[J]. Sci Rep, 2014, 4 : 7458. DOI:10.1038/srep07458 |
| [9] | Garcia M, Greco LF, Favoreto MG, et al. Effect of supplementing essential fatty acids to pregnant nonlactating Holstein cows and their preweaned calves on calf performance, immune response, and health[J]. J Dairy Sci, 2014, 97 (8): 5045–5064. |
| [10] | Rittirsch D, Huber-Lang MS, Flierl MA, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4 (1): 31–36. |
| [11] | Heller AR, Rössler S, Litz RJ, et al. Omega-3 fatty acids improve the diagnosis-related clinical outcome[J]. Crit Care Med, 2006, 34 (4): 972–979. DOI:10.1097/01.CCM.0000206309.83570.45 |
| [12] | 张畔, 郭聪芳, 骆宁, 等. 补阳还五汤对脓毒症大鼠脾细胞凋亡的实验研究[J]. 中国危重病急救医学, 2011, 23 (8): 486–489. |
| [13] | Pathan N, Franklin JL, Eleftherohorinou H, et al. Myocardial depressant effects of interleukin 6 in meningococcal sepsis are regulated by p38 mitogen-activated protein kinase[J]. Crit Care Med, 2011, 39 (7): 1692–1711. |
| [14] | Boomer JS, To K, Chang KC, et al. Immunosuppression in patients who die of sepsis and multiple organ failure[J]. JAMA, 2011, 306 (23): 2594–2605. |
| [15] | Gentile LF, Cuenca AG, Efron PA, et al. Persistent inflammation and immunosuppression:a common syndrome and new horizon for surgical intensive care[J]. J Trauma Acute Care Surg, 2012, 72 (6): 1491–1501. |
| [16] | Lang JD, Matute-Bello G. Lymphocytes, apoptosis and sepsis:making the jump from mice to humans[J]. Crit Care, 2009, 13 (1): 109. |
| [17] | Hotchkiss RS, Opal S. Immunotherapy for sepsis-a new approach against an ancient foe[J]. N Engl J Med, 2010, 363 (1): 87–89. |
| [18] | Kohli P, Levy BD. Resolvins and protectins:mediating solutions to inflammation[J]. Br J Pharmacol, 2009, 158 (4): 960–971. DOI:10.1111/j.1476-5381.2009.00290.x |
| [19] | Park KS, Lim JW, Kim H. Inhibitory mechanism of omega-3 fatty acids in pancreatic inflammation and apoptosis[J]. Ann N Y Acad Sci, 2009, 1171 : 421–427. |
| [20] | Tayyebi-Khosroshahi H, Houshyar J, Tabrizi A, et al. Effect of omega-3 fatty acid on oxidative stress in patients on hemodialysis[J]. Iran J Kidney Dis, 2010, 4 (4): 322–326. |
| [21] | Garrel C, Alessandri JM, Guesnet P, et al. Omega-3 fatty acids enhance mitochondrial superoxide dismutase activity in rat organs during postnatal development[J]. Int J Biochem Cell Biol, 2012, 44 (1): 123–131. |
| [22] | Zugno AI, Chipindo HL, Volpato AM, et al. Omega-3 prevents behavior response and brain oxidative damage in the ketamine model of schizophrenia[J]. Neuroscience, 2014, 259 : 223–231. |
 2017, Vol. 19
2017, Vol. 19