2. 陕西省人民医院妇产科, 陕西 西安 710068
我国从2000年开始禁止机动车辆添加含铅(四乙基铅)汽油,儿童血铅平均水平下降了58.37%[1]。但大样本数据表明,中国儿童血铅水平超过全球平均水平16%之多[2]。儿童铅中毒的特征是先天性和不可避免性:铅元素可以在胎盘组织中蓄积并自由通过胎盘屏障,对胚胎、胎儿以及出生后的婴幼儿生长发育造成严重的损害[3]。
儿童铅中毒除了出现神经、精神、心理、行为等方面[4]的表现外,还可出现运动感觉[5]、大运动发育[6]、精细运动[7]等运动或协调能力方面受损,但该方面所受关注有限。尽管孕妇脱离了铅接触,但长期蓄积在骨骼内的铅元素在孕期释放入血显著增加[8]。目前进入生育高峰年龄的女性,其生长发育及成长开始于20~30年以前,当时正是铅污染较为严重的时期。因此关注胚胎期铅暴露对子代运动、协调能力影响的研究具有十分重要的现实意义和非常显著的社会效益。
c-Fos蛋白是即刻早期基因c-fos转录翻译的产物,生理状态下在神经细胞中含量极低;而在各种病理性因素的刺激下,c-Fos蛋白可迅速大量表达并与病理性刺激的特性、强度和持续时间密切相关。因此,在各种病理状态下,c-Fos的表达常用来灵敏地反映神经元的活动或激活状态。海马苔藓纤维发芽(mossy fiber sprouting, MFS)的本质是神经纤维的异位投射和神经突触联系的重建[9],与平衡协调及运动能力等关系密切[10]。有报道证实海马部位神经元的坏死可能是“诱发”MFS的重要机制之一[11],本课题组前期研究发现胚胎期铅暴露可导致仔鼠海马神经元出现严重的病理变化[12],这些变化是否也会伴随海马MFS现象并进而影响仔鼠运动协调能力是本实验的重要研究内容。
1 材料与方法 1.1 实验动物同窝遗传背景一致的雌性Sprague-Dawley大鼠6只(SPF级,西安交通大学医学院实验动物中心提供),体重为240~260 g,按随机数字法均分为正常对照组、低剂量铅暴露组、高剂量铅暴露组。上述雌鼠与同一成年雄鼠依次按2 : 1合笼配对,应用光镜下观察雌鼠阴道涂片内存在雄鼠精子及肉眼发现雌鼠阴道栓相结合的方法确定雌鼠受孕并记为受孕第0天。
1.2 大鼠胚胎期铅暴露模型的制备参考文献方法[13]建立大鼠胚胎期铅暴露模型:受孕第0天开始,低剂量铅暴露组、高剂量铅暴露组母鼠分别自由饮用0.1%、0.2%醋酸铅三蒸水溶液至仔鼠娩出为止,而正常对照组整个孕期饮用三蒸水。雌鼠进入孕期第21天后,仔鼠娩出,铅暴露组母鼠改饮三蒸水;生后第22天,仔鼠与母鼠分离;生后第24天各组仔鼠改普通颗粒料喂养;生后第30天将各组雌、雄仔鼠分离,将雄性仔鼠纳入研究(正常对照组12只、低剂量铅暴露组10只、高剂量铅暴露组9只),进行转体实验和衣架实验。生后第36天,各组任选8只雄性仔鼠观察c-Fos蛋白在海马CA1区的表达及海马MFS情况。
1.3 转体实验将大鼠按头向下的方向放置于45°倾斜的木板上,记录大鼠本能地转体为头向上所需的时间,时间单位为s。非连续测试3次,取转体所需最短时间记录。
1.4 衣架实验三角形金属衣架水平部直径为5 mm,长度为40 cm,顶端灵活悬挂空中,使水平部距地面高度50 cm。实验时使动物双前肢抓住水平部金属杆的中部,确认抓牢后迅速松开动物,动物为避免摔落而被迫悬吊于空中并极力保持身体平衡,动态观察动物的行为反应,每次观察60 s,间断进行3次实验,实验间歇期至少10 min[14]。按动物平衡运动灵活性评分标准计分[15],评估测试动物躯体平衡与四肢协调运动能力:动物前肢性悬吊,持续时间不足10 s计0分;动物前肢性悬吊,持续时间达到或超过10 s计1分;动物调动后肢及尾部,力图改变不利悬吊状况计2分;至少1只后爪抓握住水平部或尾部缠绕水平部计3分;四肢均抓握住水平部并且实现尾部缠绕计4分;爬上水平部并移行,达到或未达到一侧末端计5分。
1.5 海马CA1区c-Fos蛋白表达与观察20%乌拉坦(1.20 g/kg)腹腔注射麻醉大鼠后,立即打开胸腔暴露心脏,在心脏搏动状态下经心尖插管至主动脉根部,剪开右心房,选用0.9%生理盐水约50 mL快速灌注冲洗血液,随后以先快后慢的方式灌注4℃预冷处理的4%多聚甲醛(由0.1 mol/L磷酸缓冲液配置,pH=7.4)100~150 mL,约40 min灌完,取脑组织,经4%多聚甲醛固定12 h,修剪脑组织,保留海马部分结构,随后将该脑组织块逐级浸入20%、30%蔗糖溶液中,4℃冰箱过夜至组织块沉底。于-20℃左右在恒冷切片机中作连续冠状切片,片厚40 μm,间隔4片取1片。按c-Fos试剂盒(北京中山生物技术有限公司)步骤进行免疫组化实验(正常山羊血清以标准磷酸盐缓冲液按1 : 20体积比稀释,多克隆兔抗鼠c-Fos以血清按1 : 500体积比稀释),DAB溶液室温显色15 min,PBS充分漂洗后终止反应。每3张切片贴于经多聚赖氨酸处理的一张载玻片上,常规进行脱水、透明,中性树脂封片。随机选取每只大鼠脑组织切片3张,400倍光镜下每张切片随机选5个不同视野观察,于Q550CW型图像信号采集与分析系统(德国Leica公司)下测量海马CA1区c-Fos阳性神经元面积百分比(阳性细胞面积总和占视野面积的百分比)的均值和平均灰度值(灰度值分为0~256级别,和免疫反应的强弱呈反比关系)。
1.6 海马组织取材与改良Timm' s染色海马组织切片的制备方法同上。按文献报道[16]步骤进行改良Timm' s染色。随机选取每只大鼠脑组织切片3张,400倍光镜下每张切片随机选5个不同视野观察,对CA3区及齿状回(dentate gyrus, DG)的MFS分别进行半定量评分。评分标准[17]:(1)海马CA3区:无颗粒计0分;锥体层或起层偶见稀疏分散的颗粒计1分;锥体层或起层有少量至中等程度的颗粒计2分;锥体层或起层有突出的颗粒计3分;锥体层或起层有突出的颗粒,几乎呈连续分布计4分;锥体层或起层连续或近乎连续的稠密颗粒呈层带状分布计5分。(2)海马DG区:无颗粒计1分;有少量散在的斑片状颗粒计1分;较多的斑片状颗粒计2分;颗粒近乎连续分布计3分;出现浓密的颗粒带,连续或近乎连续分布计4分;连续、浓密、呈层分布的颗粒带计5分。
1.7 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间的比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 转体实验中仔鼠位置平衡和身体协调运动能力的变化在转体实验中,各组仔鼠的转体时间比较差异有统计学意义(P < 0.01);其中高剂量铅暴露组转体时间长于正常对照组和低剂量铅暴露组(P < 0.05),低剂量铅暴露组转体时间亦长于正常对照组(P < 0.05)。提示胚胎期铅暴露损害仔鼠位置平衡和身体协调运动能力,而且损害程度与铅暴露水平存在剂量依赖性。见表 1。
| 表 1 各组仔鼠平衡与协调能力的变化比较(x±s) |
2.2 衣架实验中仔鼠躯体平衡与四肢协调运动能力的变化
在衣架实验中,各组仔鼠的平衡运动得分比较差异有统计学意义(P < 0.01);其中高剂量铅暴露组平衡运动得分低于正常对照组和低剂量铅暴露组(P < 0.05),低剂量铅暴露组平衡运动得分亦低于正常对照组(P < 0.05)。提示胚胎期铅暴露降低仔鼠躯体平衡与四肢协调运动能力,而且损害程度与铅暴露水平存在剂量依赖性。见表 1。
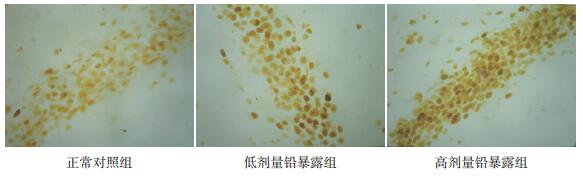
2.3 仔鼠海马CA1区c-Fos表达情况光镜下观察,c-Fos免疫反应阳性物呈细颗粒状,颜色随免疫反应强度增加而由浅黄色、棕色向深棕色过渡,主要沉积在细胞核内,部分神经元胞体及突起可染为视野模糊的极浅黄色(图 1)。各组仔鼠海马CA1区c-Fos阳性细胞面积百分比及平均灰度值比较差异均有统计学意义(P < 0.01);其中高剂量铅暴露组c-Fos阳性细胞面积百分比高于正常对照组和低剂量铅暴露组(P < 0.05),低剂量铅暴露组c-Fos阳性细胞面积百分比亦高于正常对照组(P < 0.05);高剂量铅暴露组c-Fos阳性细胞平均灰度值低于正常对照组和低剂量铅暴露组(P < 0.05),低剂量铅暴露组c-Fos阳性细胞平均灰度值亦低于正常对照组(P < 0.05)。提示胚胎期铅暴露可导致仔鼠海马CA1区c-Fos阳性表达增加,其表达强度与铅暴露水平存在剂量依赖性。见表 2。
|
图 1 各组仔鼠海马CA1区c-Fos阳性细胞分布(免疫组化,×400) 正常对照组c-Fos蛋白表达量较少,细胞着色较浅,呈浅黄色至浅棕色;低剂量铅暴露组c-Fos蛋白表达增加,细胞着色加深,呈浅棕色至棕色;高剂量铅暴露组c-Fos蛋白表达显著增加,细胞着色明显加深,呈棕色至深棕色。 |
| 表 2 各组仔鼠海马c-Fos表达及海马MFS评分比较(x±s) |
2.4 仔鼠海马CA3区及DG区MFS情况
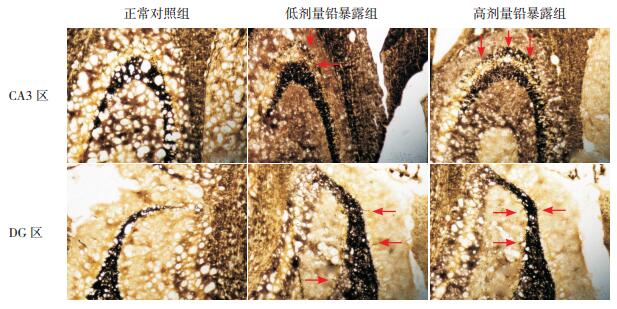
光镜下观察,海马CA3区苔藓纤维(MF)主要集中分布于内侧的透明层内;MFS发生时,黑色的Timm' s颗粒会出现在外侧的锥体细胞层内,甚至更外侧的起始层内;铅暴露组仔鼠海马CA3区MF不断向锥体细胞层及起始层内投射,Timm' s颗粒不断增多,甚至密集分布呈带状MFS现象(图 2)。海马DG区的MF主要集中分布于颗粒层内侧的门区内;MFS发生时,黑色的Timm' s颗粒及条索会向外侧的颗粒细胞层及内、外分子层投射(图 2)。各组仔鼠海马CA3区及DG区MFS的半定量评分比较差异均有统计学意义(P < 0.01);其中高剂量铅暴露组CA3区及DG区MFS的半定量评分均高于正常对照组和低剂量铅暴露组(P < 0.05);低剂量铅暴露组CA3区及DG区MFS的半定量评分亦高于正常对照组(P < 0.05)。上述数据提示胚胎期铅暴露可导致子代大鼠海马CA3区及DG区出现MFS,且程度与铅暴露水平存在剂量依赖性。见表 2。
|
图 2 各组仔鼠海马CA3区及DG区MFS情况(Timm' s染色,×200) 正常对照组CA3区MF主要分布于透明层,锥体细胞层几乎无黑色的Timm' s颗粒;低剂量铅暴露组CA3区锥体细胞层可见少量黑色的Timm' s颗粒(箭头所示),部分聚集呈稀疏带状;高剂量铅暴露组CA3区锥体细胞层可见大量黑色的Timm' s颗粒(箭头所示),密集呈带状,部分向起始层投射。正常对照组海马DG区MF主要分布于门区,颗粒细胞层几乎无黑色的Timm' s颗粒或条索;低剂量铅暴露组DG区颗粒细胞层出现少量黑色的Timm' s条索(箭头所示)或颗粒;高剂量铅暴露组DG区颗粒细胞层出现较多黑色的Timm' s条索(箭头所示)及颗粒,部分条索向内分子层投射。 |
3 讨论
本研究对各组生后第30天(相当于人类7~9岁左右)仔鼠进行转体实验及衣架实验并观察海马CA1区c-Fos蛋白表达及CA3区、DG区MFS现象,主要的发现包括:(1)胚胎期铅暴露仔鼠在衣架实验中平衡运动灵活性得分减少,在转体实验中躯体平衡性转体时间延长,提示胚胎期铅暴露可导致发育期子代大鼠出现以运动和协调能力障碍为主要表现的精神发育迟滞。而且上述损害的严重程度与胚胎期铅暴露剂量之间存在一定的剂量-效应关系。(2)运动及协调功能障碍的仔鼠海马CA1区c-Fos蛋白表达显著增多,提示即刻早期基因c-fos参与了胚胎期铅暴露导致的运动、协调功能受损。(3)在铅暴露引起的运动及协调功能障碍的子代大鼠海马CA3区及DG区出现了明显的MFS发芽现象,尤其以CA3区的表现更为突出,CA3区MFS的Timm' s颗粒延伸至锥体细胞层及起始层内,且许多颗粒相互聚集,呈带状分布;而DG区的MFS主要投射至颗粒细胞层,投射进入分子层的颗粒或条索较少,提示海马CA3区的MFS与运动及协调功能障碍的发生关系更紧密。
海马属于脑边缘系统,与学习、记忆、认知、情感等脑的高级功能密切相关。大鼠的海马通路主要由CA1区、CA3区及DG区构成,内嗅区发出的纤维到达DG区颗粒细胞,颗粒细胞又分别通过MF及轴突与CA3区及CA1区连接,CA1区又发出纤维与内嗅区相连,形成一个闭合的神经元回路。海马CA1区神经元对缺血、缺氧、感染、氧化应激、外伤等病理性刺激非常敏感,容易出现受损的表现,而海马CA3区及DG区神经元则不易出现损害[18]。而在各种有害因素的刺激下,c-Fos蛋白通过使靶基因转录活性或水平改变而代替执行c-fos基因的功能,c-Fos不仅广泛参与细胞生长、分化、变性、凋亡、坏死等生理及病理过程[19],而且与心理、行为、学习和记忆等多种脑的高级机能[20]有关。因此,观察海马CA1区神经元c-Fos蛋白表达是反映中枢神经系统遭受各种应激而发生变化的灵敏指标。c-Fos蛋白表达变化是病理状态严重程度的反映还是机体对有害因素作出的保护性反应,研究结论不尽相同。蒋犁等[21]在缺氧缺血后新生鼠脑c-Fos蛋白表达与脑海马迟发性神经元死亡关系的研究中发现,在缺血损伤最严重的部位c-Fos蛋白表达少而神经元死亡较轻的部位c-Fos蛋白表达较多。Park等[22]在研究母鼠分离诱发的仔鼠抑郁的干预防治中发现,运动训练在改善仔鼠抑郁表现的同时,仔鼠海马DG及下丘脑室旁核c-Fos蛋白表达显著增加。而陈衍晨等[23]研究发现,缺氧会导致斑马鱼脑细胞内c-fos基因表达上调,脑组织中c-fos基因表达在缺氧6 h时达到高潮,并在24 h时仍然对缺氧刺激积极地响应,研究结果提示c-fos基因表达可能是导致缺氧后期脑细胞凋亡激增的机制之一。已经明确地发现氧化应激增强,活性氧簇增加是刺激c-fos基因激活及c-Fos蛋白表达的重要机制[24]。
研究已经证实,在各种病理状态的刺激下[25],原本走形规律的MF会以MFS的形式芽生侧支, 折返穿入本部DG内分子层,并与自身颗粒细胞发出的近侧树突形成突触或穿越CA3区透明层, 在锥体细胞层和起始层与锥体细胞发出的顶树突形成新的异位投射和神经突触联系的重建[9]。伴随MFS异位投射和神经突触重建的是原有神经元之间联系的中断及先前神经突触结构的破坏。大量研究证实海马部位细胞死亡是诱发MFS的关键因素[11],这与本课题组前期实验[12]发现的MR子代大鼠海马CA1区出现的病理超微结构改变相一致。但不同部位(CA3、CA1区)以及不同程度的病理改变(变性、坏死)是否会影响MFS的分布部位(CA3区、DG)及出芽程度(MFS到达的范围)是值得进一步研究的内容。
MFS是损伤严重程度的标志,还是对损伤进行修复的保护性反应?迄今为止,这一疑问尚未得到合理的解释。但多数研究结果支持“损害说”的观点,认为MFS是一种损害证据。MFS导致的重建性突触多为兴奋性突触[26]的研究结论支持MFS是一种损害性表现。Lobo等[27]的研究证实,异常MFS可使神经突触的走行和分布发生变化,出现神经受体和递质的不恰当分布表达,最终产生异常兴奋回路,是许多高级脑功能受损的可能机制之一[28]。尽管研究结果存在争议,MFS和运动之间的关系十分密切。研究发现,不管是强制性跑台运动抑或自主性轮跑运动,一定持续时间的训练后,大鼠海马CA3起始层MFS显著增加[10]。在匹鲁卡品诱发癫癎持续状态并导致脑损害的研究中证实,有氧运动训练抑制抽搐发作频率并减轻脑功能损伤的同时,大鼠海马齿状回MFS现象减少[29]。在青霉素诱发的惊厥性脑损害中,跑步训练可减轻SD大鼠海马DG及CA3区域的异位MFS,同时改善实验动物学习能力[30]。考虑到重金属铅对中枢神经系统几乎不加选择的损害的特点,推测海马CA3及DG部位的突触或MFS相关的重构性突触会出现变性、坏死等病理变化。因此,MFS可能是胚胎期铅暴露导致仔鼠运动、协调功能受损的证据和重要机制。
| [1] | 林国祯, 吴家刚, 彭荣飞, 等. 广州市使用无铅汽油十年后儿童血铅水平调查[J]. 中华预防医学杂志, 2008, 42 (10): 727–730. |
| [2] | van der Kuijp TJ, Huang L, Cherry CR. Health hazards of China's lead-acid battery industry:a review of its market drivers, production processes, and health impacts[J]. Environ Health, 2013, 12 : 61. DOI:10.1186/1476-069X-12-61 |
| [3] | Mazumdar I, Goswami K. Congenital lead poisoning:an unusual presentation[J]. Indian J Clin Biochem, 2014, 29 (2): 257–259. |
| [4] | Nevin R. Trends in preschool lead exposure, mental retardation, and scholastic achievement:association or causation?[J]. Environ Res, 2009, 109 (3): 301–310. DOI:10.1016/j.envres.2008.12.003 |
| [5] | 张艳淑, 郝玉兰, 闫立成, 等. 槲皮素对铅致大鼠某些神经功能损伤缓解作用研究[J]. 中国职业医学, 2011, 38 (4): 302–305. |
| [6] | 张琳, 邹时朴, 李国林. 高血铅对幼儿智力发育的影响[J]. 南昌大学学报 (医学版), 2014, 54 (6): 65–66,69. |
| [7] | 孙慧生. 铅中毒儿童运动功能与心理学特点及干预措施的临床研究[J]. 中国健康心理学杂志, 2006, 14 (1): 102–104. |
| [8] | Alba A, Carleton L, Dinkel L, et al. Increased lead levels in pregnancy among immigrant women[J]. J Midwifery Womens Health, 2012, 57 (5): 509–514. DOI:10.1111/jmwh.2012.57.issue-5 |
| [9] | Galván EJ, Cosgrove KE, Barrionuevo G. Multiple forms of long-term synaptic plasticity at hippocampal mossy fiber synapses on interneurons[J]. Neuropharmacology, 2011, 60 (5): 740–747. DOI:10.1016/j.neuropharm.2010.11.008 |
| [10] | Toscano-Silva M, Gomes da Silva S, Scorza FA, et al. Hippocampal mossy fiber sprouting induced by forced and voluntary physical exercise[J]. Physiol Behav, 2010, 101 (2): 302–308. DOI:10.1016/j.physbeh.2010.05.012 |
| [11] | Siddiqui AH, Joseph SA. CA3 axonal sprouting in kainite-induced chronic epilepsy[J]. Brain Res, 2005, 1066 (1-2): 129–146. DOI:10.1016/j.brainres.2005.10.066 |
| [12] | 周戬平, 王帆, 黄剑锋, 等. 孕期铅暴露对子代大鼠海马区神经元超微结构及突触形态学影响的研究[J]. 中国儿童保健杂志, 2012, 20 (3): 231–234. |
| [13] | 周戬平, 王帆, 杨玉凤, 等. 孕期铅暴露对子代大鼠情感行为及学习记忆变化的实验研究[J]. 中国儿童保健杂志, 2012, 20 (2): 135–138. |
| [14] | Jazayeri SB, Firouzi M, Abdollah Zadegan S, et al. The effect of timing of decompression on neurologic recovery and histopathologic findings after spinal cord compression in a rat model[J]. Acta Med Iran, 2013, 51 (7): 431–437. |
| [15] | Vijayaprakash KM, Sridharan N. An experimental spinal cord injury rat model using customized impact device:a cost-effective approach[J]. J Pharmacol Pharmacother, 2013, 4 (3): 211–213. DOI:10.4103/0976-500X.114607 |
| [16] | 宋青, 孟书聪, 董晓敏, 等. 改良的Timm染色法显示大鼠海马苔藓纤维末梢出芽的变化[J]. 四川解剖学杂志, 2001, 9 (2): 98. |
| [17] | 马勋泰, 晏勇, 王学峰. 皮质发育障碍大鼠小脑回形态学和海马苔藓纤维发芽的研究[J]. 中华神经医学杂志, 2005, 4 (4): 334–337. |
| [18] | 孙晓彩, 李力, 张敏, 等. Wistar大鼠海马CA1区、CA3区和齿状回区的解剖分割[J]. 中国应用生理学杂志, 2012, 28 (2): 189–192. |
| [19] | Lui MM, Lam DC, Ip MS. Significance of endothelial dysfunction in sleep-related breathing disorder[J]. Respirology, 2013, 18 (1): 39–46. DOI:10.1111/j.1440-1843.2012.02212.x |
| [20] | 吴超, 林孟群, 林贤文. 颅脑损伤与c-Fos基因的研究进展[J]. 四川生理科学杂志, 2011, 33 (1): 34–36. |
| [21] | 蒋犁, 丁艳洁, 晋光荣. 缺血缺氧后新生鼠脑c-fos表达与脑海马迟发性神经元死亡[J]. 中华围产医学杂志, 2001, 4 : 247–250. |
| [22] | Park JK, Lee SJ, Oh CS. Treadmill exercise exerts ameliorating effect on isolation-induced depression via neuronal activation[J]. J Exerc Rehabil, 2013, 9 (2): 234–242. |
| [23] | 陈衍晨, 赵丹, 卿娣, 等. 缺氧再灌注斑马鱼胚胎脑部细胞凋亡及c-fos基因的表达[J]. 中国组织工程研究, 2013, 17 (37): 6613–6619. |
| [24] | Shizuki K, Ogawa K, Matsunobu T, et al. Expression of c-Fos after noise-induced temporary threshold shift in the guinea pig cochlea[J]. Neurosci Lett, 2002, 320 (1-2): 73–76. |
| [25] | Hunt RF, Haselhorst LA, Schoch KM, et al. Posttraumatic mossy fiber sprouting is related to the degree of cortical damage in three mouse strains[J]. Epilepsy Res, 2012, 99 (1-2): 167–170. DOI:10.1016/j.eplepsyres.2011.10.011 |
| [26] | Safiulina VF, Fattorini G, Conti F, et al. GABAergic signaling at mossy fiber synapses in neonatal rat hippocampus[J]. J Neurosci, 2006, 26 (2): 597–608. DOI:10.1523/JNEUROSCI.4493-05.2006 |
| [27] | Lobo MK, Itri JN, Cepeda C, et al. Ionotropic glutamate receptor expression and dopaminergic modulation in the developing subthalamic nucleus of the rat:an immunohistochemical and electrophysiological analysis[J]. Dev Neurosci, 2003, 25 (6): 384–393. |
| [28] | Jeffery KJ, Hayman R. Plasticity of the hippocampal place cell representation[J]. Rev Neurosci, 2004, 15 (5): 309–331. |
| [29] | Gomes FG, Gomes Da Silva S, Cavalheiro EA, et al. Beneficial influence of physical exercise following status epilepticus in the immature brain of rats[J]. Neuroscience, 2014, 274 : 69–81. DOI:10.1016/j.neuroscience.2014.05.024 |
| [30] | Ni H, Li C, Tao LY, et al. Physical exercise improves learning by modulating hippocampal mossy fiber sprouting and related gene expression in a developmental rat model of penicillin-induced recurrent epilepticus[J]. Toxicol Lett, 2009, 191 (1): 26–32. DOI:10.1016/j.toxlet.2009.07.028 |
 2017, Vol. 19
2017, Vol. 19