2. 江西省上饶市第五人民医院ICU, 江西 上饶 334000;
3. 武汉亚洲心脏病医院ICU, 湖北 武汉 430022;
4. 中国人民解放军第九四医院ICU, 江西 南昌 330002
先天性心脏病矫治术后液体超负荷常提示存在急性肾损伤及更高的死亡率和并发症,液体超负荷已成为预测肾功能损伤的标志[1-2]。由于疾病复杂、低心排综合征、体外循环时间长和畸型矫正不满意等因素,低龄先天性心脏病根治术后的患儿常常存在急性肾损伤(acute kidney injury, AKI)和不同程度液体超负荷[3-4]。而液体超负荷是否是这类患儿急性肾损伤的独立影响因素,以及是否与术后不良事件(术后30 d死亡率、机械通气时间、ICU停留时间和住院时间)具有相关性,并不明确。本文通过多中心研究阐明先天性心脏病根治术的婴儿液体超负荷对术后合并急性肾损伤等不良治疗结局的影响,为此类患儿的液体治疗提供理论参考。
1 资料与方法 1.1 研究对象收集2015年4月至2016年4月多中心(上饶市第五人民医院ICU、解放军第九四医院ICU和武汉亚洲心脏病医院ICU)88例行先天性心脏病根治术患儿的临床资料,年龄3~176 d,平均73±51 d,其中室间隔缺损6例,房间隔缺损18例,房间隔缺损合并室间隔缺损17例,法洛氏四联症和右室双出口共18例,D-大动脉转位8例,完全肺静脉异位引流7例,肺动脉闭锁9例,其他5例。2例患儿经历2期Switch手术,余均为1期根治。54例术后未合并AKI,其中2例发生不可逆低心排死亡;34例术后发生AKI,其中6例死亡:2例畸形矫正不满意,2例死于多脏器功能衰竭,2例死于低心排综合症。
排除标准:(1)患儿术前存在气道或肺部疾病行气管插管;(2)出生胎龄 < 35周的患儿;(3)术前存在肾损伤;(4)急诊手术。
收集所有患儿的临床资料,利用先天性心脏病手术风险评估共识(the risk adjustment for congenital heart surgery-1, RACHS-1)[6]对手术复杂程度进行评分,记录治疗结局包括是否连续肾脏替代治疗(continuous renal replacement therapy, CRRT)、术后30 d死亡率、低心排综合征发生率、是否体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)治疗、机械通气时间、ICU停留时间和住院时间。
1.2 研究方法所有患儿都在体外循环下经心脏中心医生采用相同手术标准进行手术,根据患儿情况进行改良超滤,以最大限度维持患儿循环稳定的前提下减轻水肿。
术后患儿接受心脏中心标准的液体治疗,维持正常胶体渗透压、心率、动脉收缩压,精确计算出入量;在循环稳定、心率正常范围内使用呋塞米利尿,使液体超负荷降至最低;其他辅助治疗包括血管活性药物和强心治疗,呼吸机辅助通气,符合腹膜透析标准的进行腹膜透析[7]。
收集患儿术前、术后连续5 d的血肌酐(serum creatinine, SCr)、体重及液体平衡记录。累积液体超负荷(cumulative fluid overload, cFO)为每日超负荷液体的累加。
每日超负荷液体(%)[8] = [(输入液体总量-排出液体总量)/手术前体重] ×100%(1 L液体相当于1 kg)。
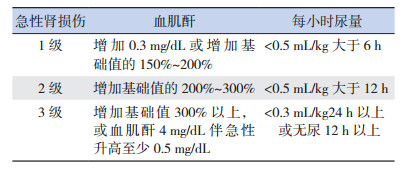
AKI诊断参照急性肾损伤网络(acute kidney injury network, AKIN)诊断标准(表 1)[9]。术后均进行血管活性药物评分(vasoactive inotrope score, VIS)[10]。以是否发生AKI进行分组,观察cFO对患儿的影响;并参照文献[11],以术后第二天cFO截点值5%进行分组分析。
| 表 1 急性肾损伤诊断标准 |
1.3 统计学分析
采用SPSS 19.0统计学软件进行数据处理。正态分布的计量资料以均数±标准差(x± s)表示,多组间比较采用方差分析,组间两两比较采用t检验;非正态分布的计量资料以中位数(范围)表示,多组间比较采用Kruskal Wallis H检验,组间两两比较采用Wilcoxon秩和检验。计数资料采用百分率(%)表示,多组间等级资料比较采用Kruskal Wallis H检验。多元logistic回归分析进行相关性分析。P < 0.05为差异有统计学意义。
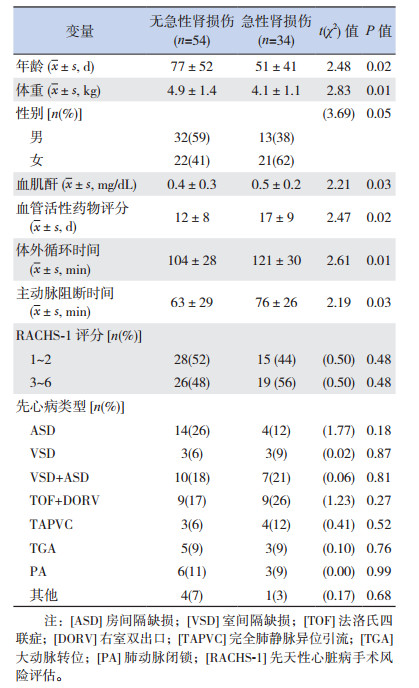
2 结果 2.1 术后有无合并急性肾损伤患者的一般资料和治疗结局比较34例(39%,34/88)患儿术后合并AKI,1期20例、2期8例、3期6例。术后有或者无急性肾损伤患儿的手术复杂程度(RACHS-1评分)、先心病类型的差异无统计学意义(P > 0.05);与术后无AKI患儿比较,合并AKI者年龄更小、体重更低,Scr、VIS更高,且术中体外循环时间和主动脉阻断时间更长,差异均有统计学意义(P < 0.05)。见表 2。
| 表 2 术后有无合并急性肾损伤患者的一般资料比较 |
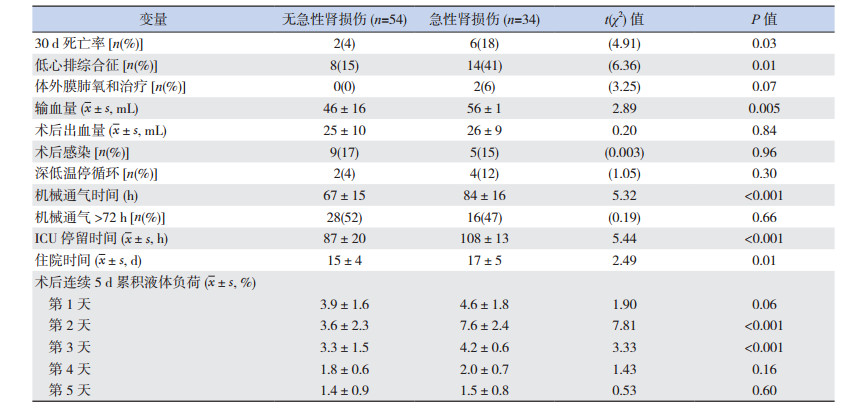
54例(61%,54/88)术后无AKI的患儿中,2例发生不可逆低心排死亡,2例右心衰竭导致腹腔积液(经强心及腹腔引流后存活);34例术后发生AKI的患儿中死亡6例:2例畸形矫正不满意、2例死于多脏器功能衰竭、2例死于低心排综合征,其中3例接受CRRT治疗。与术后无AKI患儿比较,合并AKI的患儿输血量更多、低心排综合征发生率更高,机械通气时间、ICU停留时间、住院时间更长,ECMO使用率以及30 d死亡率更高,术后第2、3天的cFO更高,差异均有统计学意义(P < 0.05)。见表 3。
| 表 3 术后有无合并急性肾损伤的两组患者治疗结局比较 |
2.2 AKI发生的影响因素
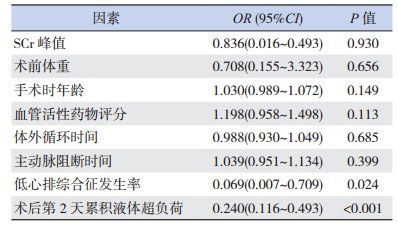
Logistic多元回归分析发现低心排综合征和术后第2天最大累积超负荷是术后AKI发生的影响因素(P < 0.05),见表 4。
| 表 4 术后发生AKI的影响因素 |
2.3 液体超负荷对患儿对治疗结局的影响
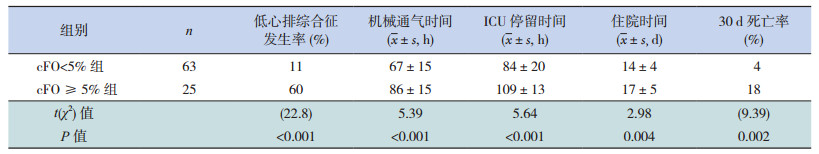
根据术后第2天cFO,将88例患儿分为≥5%与 < 5%两个等级。与cFO≥5%组比较,cFO < 5%患儿的低心排综合征发生率、30 d死亡率较低,机械通气时间、ICU停留时间和住院时间均较短,差异均具有统计学意义(P < 0.01)。见表 5。
| 表 5 术后第2天累积液体超负荷对治疗结局的影响 |
3 讨论
先天性心脏病根治术后液体管理对患儿的恢复十分重要[3, 5, 12]。体外循环导致的血液稀释和毛细血管渗漏均使血管内的液体向组织间隙渗漏,加重组织水肿[13]。而术后因早期血流动力学不稳定需要大量液体复苏以及血制品输入,由此可能加重患儿的液体超负荷以及组织水肿,增高腹腔压力,减少肾脏组织灌注[14];术后也可能因肾素-血管紧张素-醛固酮系统的刺激加重水钠潴留[15]。因此先天性心脏病根治术患者的术后液体管理尤为重要,尤其对于低体重、低龄的先天性心脏病患儿。
有报道指出,婴儿先天性心脏病术后发生AKI的患儿累积液体超负荷峰值平均为6.8%;液体超负荷≥5%时,不良事件发生概率增加[5, 12]。婴儿先天性心脏病术后心肌水肿高峰一般发生在术后72 h之内,术后第2天也是体外循环引起炎症反应的高峰期,而血管渗漏及低心排导致更多液体输入以维持血流动力学稳定,因此cFO往往在术后第2天达到高峰,随后呈下降趋势,术后第2天的cFO与死亡率和并发症都密切相关[5, 11]。因此,我们以术后第2天cFO是否≥5%作为截点来分析液体超负荷对治疗结局的影响,发现cFO < 5%患儿的低心排综合征发生率、30 d死亡率较低,机械通气时间、ICU停留时间和住院时间均较短。
Arikan等[16]发现心脏术后液体超负荷可导致脏器功能降低,生存率下降。本研究结果显示,cFO≥5%的患儿机械通气时间、ICU停留时间及住院时间明显延长,低心排发生率和死亡率都较高;低心排综合征和术后第2天累积液体超负荷量是术后AKI发生的主要影响因素。根据Blinder等[17]研究,低心排导致术后AKI发生往往与术后心肌水肿、大量血管活性药物影响肾脏的灌注以及炎症反应有关。液体超负荷也是发生AKI及低心排后患者的一种被动反应。本研究还显示,与术后无AKI患儿比较,术后合并AKI者年龄更小、体重更低,Scr、VIS更高,且术中体外循环时间和主动脉阻断时间更长。长时间的体外循环和主动脉阻断可引起心肌和肾脏灌注减少、炎症反应更重,因此术后更容易发生低心排综合征以及SCr升高;而为了维持这些患者的循环稳定,大量使用血管活性药以及补液,因此这些患者的VIS更高。
综上所述,先天性心脏病术后液体超负荷的婴儿容易发生急性肾损伤,液体超负荷可能与患儿术后不良结局有关。因此婴儿先天性心脏病术后的液体管理有助于改善其预后。但本研究样本量较小,cFO界值5%也是参照文献设定,还需进行更多研究单位参与的多中心、大样本研究以进一步予以论证。
| [1] | Hassinger AB, Wald EL, Goodman DM. Early postoperative fluid overload precedes acute kidney injury and is associated with higher morbidity in pediatric cardiac surgery patients[J]. Pediatr Crit Care Med, 2014, 15 (2): 131–138. DOI:10.1097/PCC.0000000000000043 |
| [2] | 郑俊波, 叶明, 于凯江, 等. 容量超负荷对心脏术后应用连续性肾脏替代治疗患儿预后的影响[J]. 中国血液净化, 2011, 10 (8): 412–415. |
| [3] | Sethi SK, Kumar M, Sharma R, et al. Acute kidney injury in children after cardiopulmonary bypass:Risk factors and outcome[J]. Indian Pediatr, 2015, 52 (3): 223–226. DOI:10.1007/s13312-015-0611-4 |
| [4] | Aydin SI, Seiden HS, Blaufox AD. Acute kidney injury after surgery for congenital heart disease[J]. Ann Thorac Surg, 2012, 94 (5): 1589–1595. DOI:10.1016/j.athoracsur.2012.06.050 |
| [5] | Lex DJ, Tóth R, Czobor NR, et al. Fluid overload is associated with higher mortality and morbidity in pediatric patients undergoing cardiac surgery[J]. Pediatr Crit Care Med, 2016, 17 (4): 307–314. DOI:10.1097/PCC.0000000000000659 |
| [6] | Thiagarajan RR, Laussen PC. Risk adjustment for congenital heart surgery-1(RACHS-1) for evaluation of mortality in children undergoing cardiac surgery[M]//Barach PR, Jacobs JP, Lipshultz SE, et al. Pediatric and congenital cardiac care. London:Springer, 2015:327-336. |
| [7] | 史珍英. 各类先天性心脏病监护和处理[M]//丁文祥, 苏肇伉, 史珍英. 小儿心脏外科重症监护手册. 上海: 世界图书出版公司, 2009: 249-323. |
| [8] | Selewski DT, Cornell TT, Lombel RM, et al. Weight-based determination of fluid overload status and mortality in pediatric intensive care unit patients requiring continuous renal replacement therapy[J]. Intensive Care Med, 2011, 37 (7): 1166–1173. DOI:10.1007/s00134-011-2231-3 |
| [9] | Khwaja A. KDIGO clinical practice guidelines for acute kidney injury[J]. Nephron Clin Pract, 2012, 120 (4): c179–184. DOI:10.1159/000339789 |
| [10] | Gaies MG, Gurney JG, Yen AH, et al. Vasoactive-inotropic score as a predictor of morbidity and mortality in infants after cardiopulmonary bypass[J]. Pediatr Crit Care Med, 2010, 11 (2): 234–238. DOI:10.1097/PCC.0b013e3181b806fc |
| [11] | Seguin J, Albright B, Vertullo L, et al. Extent, risk factors, and outcome of fluid overload after pediatric heart surgery[J]. Crit Care Med, 2014, 42 (12): 2591–2599. DOI:10.1097/CCM.0000000000000517 |
| [12] | Hazle MA, Gajarski RJ, Yu S, et al. Fluid overload in infants following congenital heart surgery[J]. Pediatr Crit Care Med, 2013, 14 (1): 44–49. DOI:10.1097/PCC.0b013e3182712799 |
| [13] | Hirleman E, Larson DF. Cardiopulmonary bypass and edema:physiology and pathophysiology[J]. Perfusion, 2008, 23 (6): 311–322. DOI:10.1177/0267659109105079 |
| [14] | Beck R, Halberthal M, Zonis Z, et al. Abdominal compartment syndrome in children[J]. Pediatr Crit Care Med, 2001, 21 (1): 51–56. |
| [15] | Paolillo S, Perrone Filardi P. Cardio-renal protection through renin-angiotensin-aldosterone system inhibition:current knowledge and new perspectives[J]. Eur Heart J Cardiovasc Pharmacother, 2015, 1 (2): 132–133. DOI:10.1093/ehjcvp/pvv008 |
| [16] | Arikan AA, Zappitelli M, Goldstein SL, et al. Fluid overload is associated with impaired oxygenation and morbidity in critically ill children[J]. Pediatr Crit Care Med, 2012, 13 (3): 253–258. DOI:10.1097/PCC.0b013e31822882a3 |
| [17] | Blinder JJ, Goldstein SL, Lee VV, et al. Congenital heart surgery in infants:Effects of acute kidney injury on outcomes[J]. J Thorac Cardiovasc Surg, 2012, 143 (2): 368–374. DOI:10.1016/j.jtcvs.2011.06.021 |
 2017, Vol. 19
2017, Vol. 19