远端肾小管酸中毒(distal renal tubular acidosis, dRTA)是由于远端肾小管分泌H+障碍,导致代谢性酸中毒,常伴有低钾血症、肾脏钙质沉着和肾结石[1]。原发性dRTA是由于基因变异导致肾小管酸化尿液能力受损而致病,常见的遗传模式为常染色体显性遗传(autosomal dominant, AD);常染色体隐性遗传(autosomal recessive, AR)也有报道,但十分罕见,可同时伴有神经性耳聋。
既往研究已发现ATP6V0A4(MIM 605239),ATP6V1B1(MIM 192132)和SLC4A1(MIM 109270)三种基因突变均可导致遗传性dRTA[2-6]。ATP6V0A4和ATP6V1B1基因突变影响肾小管细胞表达H+-ATP酶,导致AR的dRTA。遗传学研究发现,SLC4A1(MIM 109270)基因位于17q21,编码Cl-/HCO3-阴离子交换膜蛋白1(anion exchanger member 1, AE l),该蛋白主要表达于红细胞和肾脏远端小管α-闰细胞[7]。与红细胞表达的AE1相比,肾型AE l由SLC4A1第4~20号外显子编码[8]。既往研究报道,该基因杂合突变导致常染色体显性遗传性dRTA[1]。
对临床可疑的遗传性dRTA患者寻找致病基因,有助于做出准确的遗传学诊断。目前中国人群中关于SLC4A1突变的报道鲜见。本研究分析了来自两个dRTA家系的3例患者的临床特点和SLC4A1基因突变情况。
1 资料与方法 1.1 研究对象来自2个家庭的8人中患者3例,余家系成员为正常表型。
病例1来自家系1,男,9岁。因双下肢畸形6年就诊。患儿听力无异常。曾被诊断为维生素D缺乏,给予维生素D治疗(具体药物和剂量不详);5岁行双下肢矫形手术,效果不佳;8岁后无明显诱因出现发作性软瘫2次,伴口渴、多饮,补钾治疗后好转。患儿2岁能独立行走,3岁出现步态异常,呈“鸭步”,并逐渐出现膝外翻。患儿父母非近亲结婚,母亲孕产史无殊。查体:身高120 cm(小于第三百分位),体重17 kg,血压正常。无特殊面容,牙齿多发龋齿,肋骨串珠,心、肺听诊无异常,腹软、肝脾未及,双下肢膝外翻。实验室检查:高氯性代谢性酸中毒(血pH 7.25,碳酸氢根15.9 mmol/L,实际碱剩余-10.4 mmol/L,血氯114 mmol/L),碱性尿(尿pH 7.5),低钾、低磷血症(血钾3.0 mmol/L,血磷0.76 mmol/L),碱性磷酸酶(911 U/L)显著升高,血红蛋白水平和红细胞形态均正常;超声检查显示肾实质高回声(肾髓质钙盐沉积),双手腕关节X片提示佝偻病改变。患者的父母和妹妹表型均正常。
病例2来自家系2,男,4岁。因身材矮小就诊。听力正常。患儿出生胎龄30周,剖宫产出生,出生身长47 cm、体重2.4 kg。人工喂养,出牙、说话和走路均晚于同龄儿。幼儿期生长速度较慢(具体不详),身高落后于同龄儿,曾“补钙”治疗。患儿父母非近亲结婚,其父体健(身高170 cm);其母身材矮小(身高144 cm)、膝外翻,外院发现代谢性酸中毒伴碱性尿(血pH 7.3,碳酸氢根17.8 mmol/L,实际碱剩余-8.3 mmol/L,尿pH 7.5),以及低钾血症(血钾3.1 mmol/L),诊断为RTA,予以枸橼酸盐和碳酸氢钠片口服。患儿胞兄9岁,身高120 cm,目前无dRTA临床征象。查体:身高94 cm(小于第三百分位),体重12 kg。无特殊面容,心、肺、腹查体无异常,无胸廓和肢体畸形。实验室检查:正常阴离子间隙代谢性酸中毒(血pH 7.26,碳酸氢根15.2 mmol/L,实际碱剩余-10.7 mmol/L),碱性尿(尿pH 7.0),血钙、血磷、血红蛋白、血红细胞形态均正常。超声提示双肾髓质强回声(肾髓质钙盐沉积)。
本研究获得中国医学科学院北京协和医院伦理委员会批准及家系成员知情同意。
1.2 方法对所有患者和家系成员进行临床资料收集和外周血采集。采用DNA提取试剂盒(Qiagen,德国)提取患者及其家庭成员外周血基因组DNA。SLC4A1基因的DNA由在线数据库获得(GenBank, No. NC_000012)。采用Oligo7软件设计17对引物(表 1),对所有20个外显子和外显子-内含子剪切区进行PCR扩增。采用ABI3730XLDNA分析仪进行测序。
| 表 1 SLC4A1测序引物 |
2 结果 2.1 dRTA患者的临床特点及治疗
2个家系的3例患者均表现为身材矮小,肾脏酸化功能异常(反常性碱性尿),低钾血症以及肾脏钙质沉着,均未见肾功能不全表现。这些临床特征与遗传性肾小管酸中毒相符。患者经基因确诊后,根据代谢性酸中毒的程度和血钾水平,2例患儿予口服枸橼酸盐和碳酸氢钠片治疗,代谢性酸中毒、电解质紊乱和发育迟滞均得以逐步纠正。其母外院予以口服枸橼酸盐和碳酸氢钠片,治疗后代谢性酸中毒和低钾血症得到纠正。
2.2 致病基因突变分析通过直接测序发现,3例dRTA患者均为SLC4A1 cDNA第1 766位碱基的错义突变R589H(c.1766G > A),其他家系成员中未发现该突变。该突变在既往常染色体显性遗传的dRTA家系中已有报道。家系1(见图 1)患儿父母均无dRTA相关表现,SLC4A1基因位点检测均为野生型,提示患儿发病为新生基因突变的结果。家系2(见图 2)的患儿及其母均有dRTA临床表现和R589H突变,符合AD遗传。
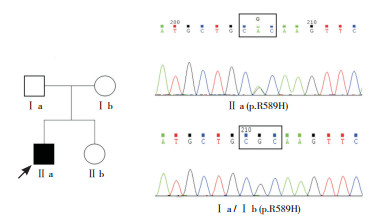
|
图 1 家系1成员SLC4A1基因突变和野生型测序图 注:□正常表型男性;○正常表型女性;■男性患者;●女性患者;↗先证者。家系1患儿SLC4A1基因携带致病突变p.R589H,患儿父母SLC4A1基因均为野生型。 |
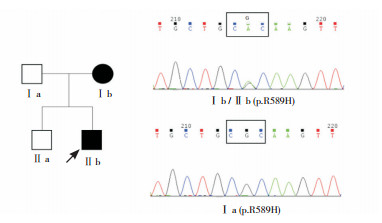
|
图 2 家系2成员SLC4A1基因突变和野生型测序图 注:□正常表型男性;○正常表型女性;■男性患者;●女性患者;↗先证者。家系2患儿及其母SLC4A1基因均携带致病突变p.R589H,患儿父亲SLC4A1基因为野生型。 |
3 讨论
原发性dRTA患者在代谢性酸中毒时,肾脏不能产生适当的酸性尿,或酸负荷后远端肾小管存在泌氢功能障碍。本研究通过家系调查和基因分析,两个家系共3例患者被诊断为dRTA。因患者均未合并神经性耳聋,且家系2提示为AD遗传,首先对患者进行SLC4A1基因检测,发现3例患者均为SLC4A1基因杂合错义突变(c.1766G > A),AE1蛋白589位精氨酸被替换为组氨酸。
既往研究发现,SLC4A1所致dRTA的遗传模式可为AD或AR[1]。中国的dRTA家系研究鉴定出SLC4A1复合杂合突变(G494S和G701D)表现为AR遗传特点,而SLC4A1缺失突变(D905dup)则表现为常染色体显性遗传模式。本研究中,SLC4A1杂合突变(R589H)在家系1中为新生突变,而在家系2中表现为AD遗传。SLC4A1杂合突变(R589H)最早由Bruce等报道,Bruce等[3]对4个dRTA遗传家系进行SLC4A1基因检测,在两个家系鉴定出R589H突变,遗传模式均为AD。Jarolim等[10]在3个AD遗传的dRTA家系中再次证实该位点突变;并通过体外实验证实,R589H杂合突变减弱了Cl-/HCO3-的离子交换,导致dRTA,但该突变并不引起红细胞异常;并对589位精氨酸进行保守性预测,发现该氨基酸在脊椎动物蛋白结构中是高度保守的,因此提示了其功能的重要性。因此,SLC4A1基因发生R589H突变导致AD的dRTA是明确的。至今,已报道编码该氨基酸的3种错义突变(R589C,R589H,R589S),可见于AD的dRTA遗传家系或散发患者中[11-13]。
值得注意的是,本研究2例患儿虽为相同基因型,但家系1患儿表型更为严重,表现为严重的生长发育障碍、下肢畸形,以及严重的代谢性酸中毒,低钾血症、低磷血症,影像学提示明显的佝偻病改变。推测其临床表现更为严重可能与病程较长、未能得到有效治疗有关,而长期远端肾小管酸中毒可能引起更为广泛的肾小管损伤。此外,2例患儿均出现肾脏钙质沉着,但尚未出现肾功能不全。研究发现,部分显性遗传性dRTA可在青春期或成年后发病且临床症状较轻,不伴有肾脏钙质沉着或肾结石[14]。目前,SLC4A1基因型与临床表型的相关性并不明确,仍需进一步研究。
本研究首次在国内报道遗传性dRTA家系SLC4A1基因R589H致病突变。对疑似遗传性dRTA患者进行基因检测可提高早期诊断率。
| [1] | Batlle D, Haque SK. Genetic causes and mechanisms of distal renal tubular acidosis[J]. Nephrol Dial Transplant, 2012, 27 (10): 3691–3704. DOI:10.1093/ndt/gfs442 |
| [2] | Stover EH, Borthwick KJ, Bavalia C, et al. Novel ATP6V1B1 and ATP6V0A4 mutations in autosomal recessive distal renal tubular acidosis with new evidence for hearing loss[J]. J Med Genet, 2002, 39 (11): 796–803. DOI:10.1136/jmg.39.11.796 |
| [3] | Bruce LJ, Cope DL, Jones GK, et al. Familial distal renal tubular acidosis is associated with mutations in the red cell anion exchanger (Band 3, AE1) gene[J]. J Clin Invest, 1997, 100 (7): 1693–1707. DOI:10.1172/JCI119694 |
| [4] | 高延霞, 窦以河, 隋爱华, 等. 常染色体隐性遗传性远端肾小管酸中毒患儿ATP6V0A4和ATP6V1B1基因突变分析[J]. 中华肾脏病杂志, 2012, 28 (1): 1–4. |
| [5] | Elhayek D, Perez de Nanclares G, Chouchane S, et al. Molecular diagnosis of distal renal tubular acidosis in Tunisian patients:proposed algorithm for Northern Africa populations for the ATP6V1B1, ATP6V0A4 and SCL4A1 genes[J]. BMC Med Genet, 2013, 14 : 119. |
| [6] | Gómez J, Gil-Peña H, Santos F, et al. Primary distal renal tubular acidosis:novel findings in patients studied by nextgeneration sequencing[J]. Pediatr Res, 2016, 79 (3): 496–501. DOI:10.1038/pr.2015.243 |
| [7] | Lux SE, John KM, Kopito RR, et al. Cloning and characterization of band 3, the human erythrocyte anionexchange protein (AE1)[J]. Proc Natl Acad Sci U S A, 1989, 86 (23): 9089–9093. DOI:10.1073/pnas.86.23.9089 |
| [8] | Kollert-Jöns A, Wagner S, Hübner S, et al. Anion exchanger 1 in human kidney and oncocytoma differs from erythroid AE1 in its NH2 terminus[J]. Am J Physiol, 1993, 265 : F813–F821. |
| [9] | Zhang Z, Liu KX, He JW, et al. Identification of two novel mutations in the SLC4A1 gene in two unrelated Chinese families with distal renal tubular acidosis[J]. Arch Med Res, 2012, 43 (4): 298–304. DOI:10.1016/j.arcmed.2012.05.001 |
| [10] | Jarolim P, Shayakul C, Prabakaran D, et al. Autosomal dominant distal renal tubular acidosis is associated in three families with heterozygosity for the R589H mutation in the AE1(band 3) Cl-/HCO3- exchanger[J]. J Biol Chem, 1998, 273 (11): 6380–6388. DOI:10.1074/jbc.273.11.6380 |
| [11] | Sritippayawan S, Kirdpon S, Vasuvattakul S, et al. A de novo R589C mutation of anion exchanger 1 causing distal renal tubular acidosis[J]. Pediatr Nephrol, 2003, 18 (7): 644–648. |
| [12] | Yenchitsomanus PT. Human anion exchanger1 mutations and distal renal tubular acidosis[J]. Southeast Asian J Trop Med Public Health, 2003, 34 (3): 651–658. |
| [13] | Heras Benito ME, Garcia-Gonzalez MA, Valdenebro Recio M, et al. The need for genetic study to diagnose some cases of distal renal tubular acidosis[J]. Nefrologia, 2016, 36 (5): 552–555. DOI:10.1016/j.nefro.2016.06.008 |
| [14] | 王琼, 陈楠. 遗传性肾小管酸中毒相关基因研究进展[J]. 中华肾脏病杂志, 2009, 25 (5): 404–407. |
 2017, Vol. 19
2017, Vol. 19



