2. 华中科技大学同济医学院附属武汉市儿童医院/武汉市妇幼保健院风湿免疫科, 湖北 武汉 430016
过敏性紫癜(Henoch-Schönlein purpura, HSP)是儿童时期最常见的一种自身免疫性系统性血管炎性疾病,主要表现为非血小板减少性紫癜、关节炎、腹痛,或者胃肠道出血以及肾脏损害[1],在学龄前儿童多见,其中20%的患儿发生消化道出血。由于发病机制不明确,主要采用对症治疗,疗效欠佳。血小板活化因子(platelet activating factor, PAF)可诱导血小板和中性粒细胞聚集,促使细胞产生趋化性,调节白介素分泌。经血小板活化因子乙酰水解酶(platelet-activating factor acetylhydrolase, PAF-AH)水解后失去生物活性,所以PAF-AH的浓度直接影响PAF活性。近年来研究发现,PAF-AH基因多态性与PAF-AH的表达水平密切相关,而且PAF及PAF-AH水平与肾脏损害相关[2-3],但是关于PAF-AH活性及其基因多态性与HSP消化道症状的关系尚未见报道。本研究拟分析PAF-AH基因多态位点Val279Phe(G > T)及PAF和血小板活化标志物α颗粒膜糖蛋白140(platelet α-granule membrane glycoprotein-140, GMP-140)、β-血小板球蛋白(β-thromboglobulin, β-TG)和血小板第4因子(platelet factor, PF4)水平与过敏性紫癜消化道出血的关系。
1 资料与方法 1.1 研究对象选择2012年3月至2014年12月武汉市儿童医院确诊的HSP患儿516例作为研究对象,均符合2006年欧洲抗风湿病联盟/欧洲儿科风湿协会的HSP诊断标准[4],且排除血小板减少性紫癜、系统性红斑狼疮、肝脏疾病等全身性疾病。根据患儿是否呕血、便血以及大便潜血试验分为消化道出血组和非消化道出血组,本研究分类不考虑肾脏及关节累及情况。
收集所有患儿的一般资料包括性别、年龄、临床症状、相关病史等。
本研究获患儿监护人知情同意及医院伦理委员会批准。
1.2 基因组DNA提取所有HSP患者入院次日采集空腹静脉抗凝血5 mL,分离血浆于-20℃保存待检测。并提取样本基因组DNA,-20℃保存。
1.3血浆PAF、GMP-140、β-TG及PF4检测
采用ELISA方法检测所有患儿血浆PAF、GMP-140、β-TG及PF4水平,试剂由美国Rapidbio公司和武汉优尔生有限公司提供。
1.4 PAF-AH活性测定对82例患儿采用PAF-AH活性检测试剂盒(Cayman Chemical公司,美国)进行血浆PAF-AH活性测定。操作根据试剂盒说明书进行。酶标仪读取不同时间(1、5、10、15、20、25、30 min)各样本在405 nm波长下的吸光度值(A405),计算各样本PAF-AH活性。
1.5 PAF-AH基因Val279Phe多态位点检测利用引物(5'-TGGGTAAACAAGAATGAGG-3'和5'-TCTTCTAACACCACGAAAT-3')通过PCR分别扩增包含Val279Phe的基因片段,产物长度为384 bp,限制性内切酶Acl Ⅰ在37℃消化,2%琼脂糖胶电泳,紫外灯下观察结果并确定基因型:纯合子TT为109 bp、275 bp两条带;纯合子GG只有384 bp一条带;而杂合子GT显示109 bp、275 bp和384 bp三条带。
1.6 统计学分析采用SPSS 16.0软件进行数据处理。计量资料采用均数±标准差(x± s)表示。利用频率计数法计算各组基因型和等位基因频率,利用Hardy-Weinberg遗传平衡定律检验。各组间基因型频率分布的比较采用卡方检验,等位基因频率的比较采用Z检验。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料本研究共纳入516例患儿,男309例、女207例;平均年龄6.8±2.6岁(1.1~14.2岁);其中表现为肾脏损害者212例(41.1%),关节痛症状者163例(31.6%),腹痛的298例(57.8%),消化道出血的182例(35.3%)。
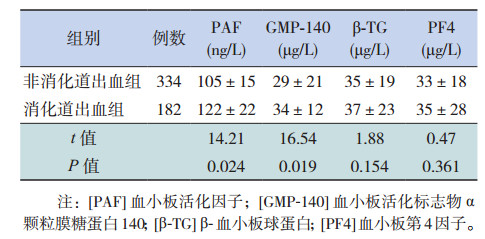
2.2 两组患儿的血小板活化标志物水平比较与非消化道出血组比较,消化道出血组的血浆PAF及GMP-140水平显著增高(P < 0.05);而两组间β-TG及PF4水平差异无统计学意义(P > 0.05)。见表 1。
| 表 1 两组血浆PAF、GMP-140、β-TG和PF4比较(x± s) |
2.3 两组患儿的PAF-AH活性比较
与非消化道出血组相比,消化道出血组的血浆PAF-AH水平较低[40±31 nmol /(min · mL) vs 45±24 nmol /(min · mL)],差异有统计学意义(P < 0.01)。
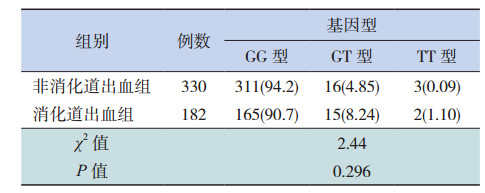
2.4 Val279Phe基因型(GG、GT、TT)分布情况Val279Phe基因型及等位基因频率分布符合Hardy-Weinberg平衡,具有群组代表性,其中纯合突变基因型TT占0.97%,杂合子占6.05%。三种基因型GG、GT和TT的分布在消化道出血组(182例)和非出血组(334例中4例未扩增出来)的差异没有统计学意义(P=0.296),见表 2。T等位基因频率在出血组为5.22%,高于对照组(3.33%),差异具有统计学意义(Z=5.95,P < 0.01)。
| 表 2 两组基因型比较[例(%)] |
2.5 消化道出血组Val279Phe基因型与各生化指标的关系
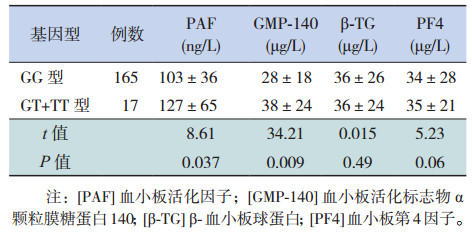
由于TT基因型患者数目较少,所以并入GT组比较GG基因型和GT+TT基因型与各生化指标的关系。T等位基因携带者(GT和TT基因型)的血浆PAF和GMP-140水平高于野生型(GG基因型)(P < 0.05),两组间β-TG和PF4表达的差异无统计学意义(P > 0.05)。见表 3。PAF-AH活性在T等位基因携带者(GT和TT基因型)低于GG基因型患者[44±30 nmol/(min · mL) vs 48±27 nmol/(min · mL)],差异有统计学意义(P < 0.05)。
| 表 3 消化道出血组不同基因型患者的血浆PAF、GMP-140、β-TG和PF4比较(x± s) |
3 讨论
HSP是累及全身小血管的变态反应性疾病,如累及胃肠黏膜毛细血管可出现各种消化道症状,包括腹痛、呕吐和消化道出血,甚至少数患儿以消化道出血为首发症状,但是引起消化道出血的具体机制不清楚。
PAF是一种具有广泛生物活性的炎性介质,中性粒细胞、单核巨噬细胞、肥大细胞、血小板和内皮细胞等在一定条件下均可产生,并促进血小板和中性粒细胞聚集,刺激这些细胞产生肿瘤坏死因子、白介素、前列腺素、血管内皮生长因子等,引起血管扩张或血管内皮细胞通透性增加,促进水肿发生,引起粘膜微循环障碍而发生坏死、出血和溃疡[5]。PAF还可刺激胃壁细胞分泌胃酸,加重对胃粘膜的损害;PAF通过活化花生四烯酸类物质的代谢促进氧自由基产生,氧自由基与胞膜上的酶及受体进行共价结合,或直接引起胞膜多聚未饱和脂肪酸过氧化而影响膜结构,致使膜的孔隙扩大、通透性增加,毛细血管内皮细胞损伤,加重炎症反应,导致细胞广泛性损害和病变[6-8]。
PAF在PAF-AH作用下水解乙酰基团后产生无活性的lyso-PAF。PAF-AH对PAF的水解能力决定了PAF在血浆和组织中的水平[9]。PAF-AH基因位于6号染色体,由12个外显子组成。近年研究发现,人血浆型PAF-AH基因存在多个位点突变类型,在西欧人主要为第4、7、ll号外显子的G275A、T539C和T1136C错义突变[10],而东亚人主要为第9号外显子的Val279 Phe突变,该位点位于PAF-AH的催化结构域内,是蛋白质适当折叠保持活性的关键。早在1996年,Stafforini等[11]发现日本人Val279Phe位点突变导致PAF-AH催化活性降低(杂合突变)或丧失(纯合突变),使PAF降解减少。此后在不同种族展开较多关于PAF-AH及Val279Phe的研究,以在心脑血管疾病的研究较多,认为是成人脑血管病的独立危险因素。有报道显示,该多态位点与过敏、多囊肾等疾病有关,而且PAF和PAF-AH及其基因型与HSP或HSP合并肾脏损害的关系也有报道[12-13]。陆彪等[3]、张静等[14]报道,合并肾炎的HSP患者PAF-AH mRNA及蛋白水平高于不伴有肾脏损害的HSP患者,而且PAF-AH基因也被报道与紫癜性肾炎有相关性。这些研究均显示PAF以及PAF的调控因素参与HSP的多种病理过程,但PAF以及PAF-AH是否与HSP合并消化道出血有关尚未见相关报道。本研究结果显示,有消化道出血的HSP患者血浆PAF和GMP-140水平高于无消化道出血的HSP组,PAF-AH活性也较低,PAF-AH基因多态位点Val270Phe与HSP消化道出血相关;且GT和TT基因型的PAF、GMP-140水平高于GG基因型患者,PAF-AH活性低于GG基因型患者,这些均提示HSP患儿的血小板活化和PAF-AH基因多态性可能与消化道出血有关。
血小板活化状态和PAF水平密切相关。本研究结果显示,血小板活化标志物PAF-AH和GMP-140水平以及PAF活性在有消化道出血症状的HSP组明显升高,但两组间的另两个血小板活化标志物β-TG及PF4的差异无统计学意义。这是否受病程等其他因素影响,还需要更大样本的分层研究以总结规律。
综上所述,PAF-AH Val279Phe基因多态性与血浆PAF-AH活性、PAF及GMP-140水平有关,PAF-AH Val279Phe基因多态性可能是HSP消化道出血的一个风险因素。
| [1] | Pohl M. Henoch-Schönlein purpura nephritis[J]. Pediatr Nephrol, 2015, 30 (2): 245–252. DOI:10.1007/s00467-014-2815-6 |
| [2] | 张琦, 童文娟, 孙建新, 等. PAF-AH在过敏性紫癜和紫癜性肾炎中的变化及意义[J]. 现代实用医学, 2016, 28 (07): 931–934. DOI:10.3969/j.issn.1671-0800.2016.07.046 |
| [3] | 陆彪, 刘静. 血小板活化因子乙酰水解酶与过敏性紫癜肾脏损害的关联性[J]. 实用儿科临床杂志, 2012, 27 (5): 331–333. |
| [4] | Ozen S, Ruperto N, Dillon MJ, et al. EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides[J]. Ann Rheum Dis, 2006, 65 (7): 936–941. |
| [5] | Verouti SN, Fragopoulou E, Karantonis HC, et al. PAF effects on MCP-1 and IL-6 secretion in U-937 monocytes in comparison with oxLDL and IL-1β effects[J]. Atherosclerosis, 2011, 219 (2): 519–525. DOI:10.1016/j.atherosclerosis.2011.07.123 |
| [6] | Xu LF, Teng X, Guo J, et al. Protective effect of intestinal trefoil factor on injury of intestinal epithelial tight junction induced by platelet activating factor[J]. Inflammation, 2012, 35 (1): 308–315. DOI:10.1007/s10753-011-9320-x |
| [7] | Mazereeuw G, Herrmann N, Xu H, et al. Platelet activating factors are associated with depressive symptoms in coronary artery disease patients:a hypothesis-generating study[J]. Neuropsychiatr Dis Treat, 2015, 11 : 2309–2314. |
| [8] | Muehlmann LA, Michelotto PV Jr, Nunes EA, et al. PAF increases phagocytic capacity and supemxide anion production in equine alveolar macrophagesand blood neutrophils[J]. Res Vet Sci, 2012, 93 (1): 393–397. DOI:10.1016/j.rvsc.2011.07.008 |
| [9] | Karasawa K. Clinical aspects of plasma platelet-activating factor-acetylhydrolase[J]. Biochim Biophys Acta, 2006, 1761 (11): 1359–1372. DOI:10.1016/j.bbalip.2006.06.017 |
| [10] | Kruse S, Mao XQ, Heinzmann A, et al. The Ile198Thr and Ala379Val variants of plasmatic PAF-acetylhydrolase impair catalytical activities and are associated with atopy and asthma[J]. Am J Hum Genet, 2000, 66 (5): 1522–1530. DOI:10.1086/302901 |
| [11] | Stafforini DM, Satoh K, Atkinson DL, et al. Platelet-activating factor acetylhydrolase deficiency. A missense mutation near the active site of an anti-inflammatory phospholipase[J]. J Clin lnvest, 1996, 97 (12): 2784–2791. DOI:10.1172/JCI118733 |
| [12] | Perelman B, Adil A, Vadas P. Relationship between platelet activating factor acetylhydrolase activity and apolipoprotein B levels in patients with peanut allergy[J]. Allergy Asthma Clin Immunol, 2014, 10 (1): 20. DOI:10.1186/1710-1492-10-20 |
| [13] | Fan P, Liu HW, Wang XS, et al. Identification of the G994T polymorphism in exon 9 of plasma platelet-activating factor acetylhydrolase gene as a risk factor for polycystic ovary syndrome[J]. Hum Reprod, 2010, 25 (5): 1288–1294. DOI:10.1093/humrep/deq047 |
| [14] | 张静, 陆彪, 刘静, 等. EGF、PAF-AH对过敏性紫癜肾脏损害的临床诊断意义[J]. 重庆医学, 2015, 44 (33): 4627–4629. DOI:10.3969/j.issn.1671-8348.2015.33.007 |
 2017, Vol. 19
2017, Vol. 19