新生儿呼吸窘迫综合征(NRDS)是指原发性或继发性肺泡表面活性物质(PS)减少导致的呼吸系统疾病,其病情重、进展快、死亡率高,是造成新生儿死亡的一个重要原因,部分患儿经抢救存活后,肺功能和神经系统可受到损伤,影响未来的生长发育。近些年研究表明,多种炎症介质和细胞因子在NRDS的病理生理过程中起到了重要的作用[1-2]。目前研究多集中于与NRDS相关的早期炎症因子中,但这些早期炎症因子在体内出现时间早,存在时间短,仅有助于NRDS的早期诊断,对NRDS的病情及预后评估存在局限性。因此目前国内外专家开始关注一类以高迁移率族蛋白B1(HMGB1)为代表的在体内出现时间晚、存在时间长的晚期炎症介质,以期为NRDS的病情及预后评估寻找一个可能的参考指标[3-6]。HMGB1是一种重要的炎症介质,由免疫细胞分泌、释放到胞浆甚至胞外,参与和介导成人急性肺损伤、脓毒症、关节炎等多种疾病的炎症反应并与炎症性疾病的病情严重程度及预后密切相关[7-8]。但目前国内外关于HMGB1与NRDS关系的研究还未见报道。因此本研究对NRDS患儿血清中HMGB1的水平进行检测,探讨其与NRDS的相关性,以期找到NRDS诊断及评估病情严重程度、预后的生物学标志物。
1 资料与方法 1.1 研究对象选取2015年12月至2016年8月本院NICU收治的NRDS患儿35例为观察组,其中男性18例,女性17例,胎龄31~40周,平均35.0±3.0周;出生体重1 500~5 050 g,平均2 567±865 g;剖宫产出生16例(46%)。NRDS诊断标准参照第4版《实用新生儿学》[9]。对照组选择同期在本院产科出生的正常新生儿35例。其中男21例,女14例,胎龄34~38周,平均36.0±0.9周;出生体重2 240~4 000 g,平均3 040±343 g;剖宫产出生24例(69%)。将观察组患儿按照病情分为轻度(n=24,入院24 h内首次胸片结果分级为Ⅰ级、Ⅱ级)和重度(n=11,胸片结果分级为Ⅲ级、Ⅳ级);按预后分为生存组(n=21,包括治愈和病情好转出院)与死亡组(n=14,病情危重放弃治疗和死亡)。本研究获得医院伦理委员会批准及家长书面知情同意。
NRDS诊断标准:生后不久出现呼吸急促( > 60次/min)、呼气性呻吟、吸气时三凹征,病情呈进行性加重;血气分析示动脉血氧分压下降和二氧化碳分压升高,碱剩余负值增加;符合RDS特征性的X线表现即Ⅰ级:两肺野透亮度明显降低,可见均匀散在的细小颗粒和网状阴影;Ⅱ级:除Ⅰ级变化加重外,可见支气管充气征,延伸至肺野中外带;Ⅲ级:病变加重,肺野透亮度更加降低,心缘、膈面模糊;Ⅳ级:整个肺野呈白肺,支气管充气征更加明显,似秃叶树枝[9]。
排除标准:(1)伴有实验室依据的肺外严重感染(血液或其他体液培养阳性,外周血白细胞增高或降低、CRP增高);(2)先天性心脏病;(3)先天性代谢紊乱;(4)肺和胸壁的畸形及其他严重的先天畸形。
1.2 研究方法(1)资料采集记录患儿的临床资料、实验室检查结果、入院24 h内首张胸部正位片、预后。
(2)标本采集两组新生儿于出生后12~24 h内留取外周静脉血2 mL置于干燥促凝管中,室温静置30 min后,3 000 rpm/min下离心10 min,取血清1 mL分装于EP管中,放入-80℃下保存备测HMGB1的浓度。
(3)指标测定:采用ELISA法测定外周静脉血HMGB1水平,标本储存和检测步骤严格按照试剂盒说明书操作。试剂盒购自武汉伊莱瑞特生物科技有限公司。
1.3 统计学分析使用SPSS 19.0软件进行统计学分析,计量资料数据以均数±标准差(x± s)表示,组间比较采用F检验或t检验;计数资料以率(%)表示,组间比较采用χ2检验;应用受试者工作特性(ROC)曲线分析HMGB1对NRDS的灵敏度、特异度并计算曲线下面积(AUC)。P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况比较两组新生儿胎龄、性别、出生方式的差异无统计学意义(P > 0.05),观察组体重(2 567±865 g)明显低于对照组(3 040±343 g),差异有统计学意义(t=3.005,P=0.004)。
轻型和重型NRDS患儿的胎龄、性别、出生体重、出生方式间差异无统计学意义(P > 0.05)。
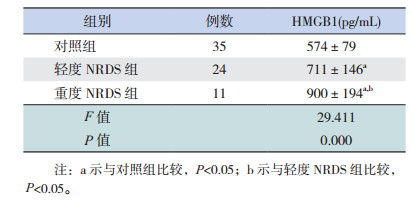
2.2 各组新生儿血清HMGB1水平比较轻度NRDS患儿血清HMGB1水平明显高于正常组,差异有统计学意义(P < 0.05);重度NRDS患儿血清HMGB1水平明显高于正常组和轻度NRDS患儿,差异有统计学意义(P < 0.05)。
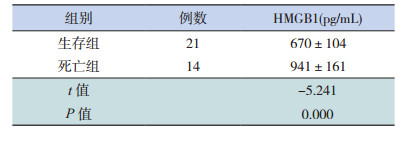
观察组中死亡患儿血清HMGB1水平明显高于存活患儿,差异有统计学意义(P < 0.05)。见表 1,2。
| 表 1 各组新生儿血清HMGB1水平比较 |
| 表 2 生存组与死亡组血清HMGB1水平 |
2.3 血清HMGB1水平对NRDS的诊断及预后的预测价值
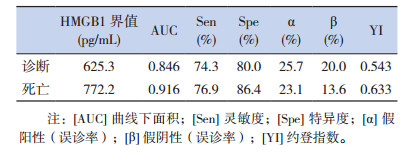
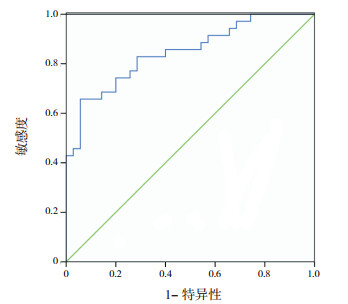
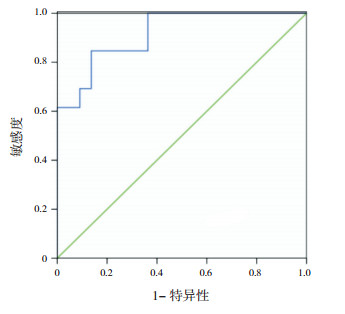
血清HMGB1水平预测NRDS的AUC值为0.846(95%CI:0.755~0.936),预测患儿死亡风险的AUC为0.916(95%CI:0.813~1.000)。见表 3,图 1、2。
| 表 3 血HMGB1水平对NRDS的诊断及预后的预测价值 |
|
图 1 血HMGB1预测NRDS的ROC曲线 |
|
图 2 血HMGB1预测NRDS预后的ROC曲线 |
3 讨论
我国多中心协作研究资料显示,在三级医院的新生儿监护病房中,13.2%的患儿为呼吸衰竭患儿,其中35%为NRDS,其死亡率高达33.8%[10]。NRDS是由于PS缺乏所致,近年来随着对NRDS发病机制的深入研究,研究发现肺部炎症反应等因素导致的继发性PS减少或活性丧失也是造成NRDS发生及加重的原因之一[1, 11-12]。在NRDS患儿发病的早期存在着不同程度的肺部炎症反应[11-12]。炎症因子的释放可影响肺泡表面活性物质蛋白B基因,造成肺表面活性物质蛋白B合成、分泌减少,进而引起PS的数量与功能均发生变化,最终诱发NRDS [13-15]。肿瘤坏死因子α(tumor necrosis factor-alpha, TNF-α)、白细胞介素1(interleukin-1, IL-1)、白细胞介素6(interleukin-6, IL-6)等早期炎症因子与NRDS的临床表现、X线表现等有较好的相关性,且可在脐血、外周血及肺泡灌洗液中检测到,有助于NRDS的早期诊断[1-2],但这些早期炎症因子在体内存在时间短,对NRDS的病情及预后评估存在一定的局限性。HMGB1由巨噬细胞活化后4 h产生,在18~24 h达到高峰,并可在体内持续较长一段时间[3-6, 16],是目前公认的一种重要的晚期炎症介质,参与和介导成人急性肺损伤、肺纤维化、关节炎等多种疾病的炎症反应并与炎症性疾病的病情严重程度及预后密切相关[17-18]。HMGB1还具有警报素的作用,其浓度的高低可以反映机体炎症及组织损伤的严重程度,并与疾病的预后密切相关。本研究结果显示NRDS患儿血清HMGB1水平均明显高于正常新生儿,而且与患儿病情严重程度有关,病情越重血清中HMGB1水平越高。死亡的NRDS患儿血清HMGB1水平明显高于存活患儿,提示血清HMGB1水平与NRDS预后有关。当血清HMGB1水平为625.3 pg/mL时预测NRDS的AUC值为0.846,当血清HMGB1水平为772.2 pg/mL时,预测患儿死亡风险的AUC为0.916。当约登指数(YI)为0.543时,血清HMGB1诊断NRDS的敏感度和特异度分别为74.3%和80.0%;当YI为0.633时,血清HMGB1预测NRDS死亡风险的敏感度和特异度分别为76.9%和86.4%,提示检测患儿血清中HMGB1水平可能有助于NRDS的诊断和预后评价,且具有较好的预测价值。
综上,血清HMGB1水平可以作为诊断NRDS的指标,并且可以反映患儿病情严重程度,可作为协助评价病情、判断预后的生物学指标。
| [1] | Speer CP. Neonatal respiratory distress syndrome:an inflammatory disease?[J]. Neonatology, 2011, 99 (4): 316–319. DOI:10.1159/000326619 |
| [2] | Bhargava R, Janssen W, Altmann C, et al. Intratracheal IL-6 protects against lung inflammation in direct, but not indirect, causes of acute lung injury in mice[J]. PLoS One, 2013, 8 (5): e61405. DOI:10.1371/journal.pone.0061405 |
| [3] | Zhao H, Zhang J, Yu J. HMGB-1 as a potential target for the treatment of diabetic retinopathy[J]. Med Sci Monit, 2015, 21 : 3062–3067. DOI:10.12659/MSM.894453 |
| [4] | Zhou H, Ji X, Wu Y, et al. A dual-role of Gu-4 in suppressing HMGB1 secretion and blocking HMGB1 pro-inflammatory activity during inflammation[J]. PLoS One, 2014, 9 (3): e89634. DOI:10.1371/journal.pone.0089634 |
| [5] | Li Y, Xiang M, Yuan Y, et al. Hemorrhagic shock augments lung endothelial cell activation:role of temporal alterations of TLR4 and TLR2[J]. Am J Physiol Regul Integr Comp Physiol, 2009, 297 (6): R1670–R1680. DOI:10.1152/ajpregu.00445.2009 |
| [6] | Liu Z, Liu J, Wang J, et al. Role of testis-specific high-mobilitygroup protein in transcriptional regulation of inducible nitric oxide synthase expression in the liver of endotoxic shock mice[J]. FEBS J, 2014, 281 (9): 2202–2213. DOI:10.1111/febs.12774 |
| [7] | Yang Q, Liu X, Yao Z, et al. Penehyclidine hydrochloride inhibits the release of high-mobility group box 1 in lipopolysaccharide-activated RAW264.7 cells and cecal ligation and puncture-induced septic mice[J]. J Surg Res, 2014, 186 (1): 310–317. DOI:10.1016/j.jss.2013.08.015 |
| [8] | Musumeci D, Roviello GN, Montesarchio D. An overview on HMGB1 inhibitors as potential therapeutic agents in HMGB1-related pathologies[J]. Pharmacol Ther, 2014, 141 (3): 347–357. DOI:10.1016/j.pharmthera.2013.11.001 |
| [9] | 孙波. 呼吸系统疾病[M]//邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学. 第4版. 北京: 人民卫生出版社, 2011: 395-398. |
| [10] | Qian L, Liu C, Zhuang W, et al. Neonatal respiratory failure:a 12-month clinical epidemiologic study from 2004 to 2005 in China[J]. Pediatrics, 2008, 121 (5): e1115–e1124. DOI:10.1542/peds.2006-2426 |
| [11] | Britt RD, Jr, Velten M, Tipple TE, et al. Cyclooxygenase-2 in newborn hyperoxic lung injury[J]. Free Radic Biol Medicine, 2013, 61 : 502–511. DOI:10.1016/j.freeradbiomed.2013.04.012 |
| [12] | Sarafidis K, Drossou-Agakidou V, Kanakoudi-Tsakalidou F, et al. Evidence of early systemic activation and transendothelial migration of neutrophils in neonates with severe respiratory distress syndrome[J]. Pediatr Pulmonol, 2001, 31 (3): 214–219. DOI:10.1002/ppul.1031 |
| [13] | Lyra PP, Diniz EM, Abe-Sandes K, et al. Surfactant protein B gene polymorphism in preterm babies with respiratory distress syndrome[J]. Braz J Med Biol Res, 2011, 44 (1): 66–72. DOI:10.1590/S0100-879X2010007500147 |
| [14] | Hamvas A, Heins HB, Guttentag S H, et al. Developmental and Genetic Regulation of Human Surfactant Protein B in vivo[J]. Neonatology, 2008, 95 (2): 117–124. |
| [15] | 曾凌空, 李文斌, 潘睿, 等. 肺表面活性物质蛋白B基因多态性与新生儿呼吸窘迫综合征易感性的研究[J]. 中国循证儿科杂志, 2011, 6 (1): 37–41. |
| [16] | Ferhani N, Letuve S, Kozhich A, et al. Expression of highmobility group box 1 and of receptor for advanced glycation end products in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2010, 181 (9): 917–927. DOI:10.1164/rccm.200903-0340OC |
| [17] | 王贵佐, 卢家美, 谢新明, 等. 过氧化物酶体增殖物激活受体在肺部疾病中的作用[J]. 中国药理学通报, 2013, 29 (1): 18–22. |
| [18] | Ebina M, Taniguchi H, Miyasho T, et al. Gradual increase of high mobility group protein b1 in the lungs after the onset of acute exacerbation of idiopathic pulmonary fibrosis[J]. Pulm Med, 2011, 2011 : 916486. |
 2017, Vol. 19
2017, Vol. 19