2. 新疆医科大学第一附属医院新疆维吾尔自治区循证医学研究所, 新疆 乌鲁木齐 830054;
3. 新疆医科大学第一附属医院药学部, 新疆 乌鲁木齐 830054
侵袭性念珠菌病(invasive candidiasis)是由念珠菌属引起的系统性真菌感染,包括念珠菌血症、播散性念珠菌病以及累及深部器官念珠菌病。随着儿童免疫缺陷病、恶性肿瘤病例的增加,以及广谱抗生素的广泛应用、侵袭性操作的增多,临床上发现儿童侵袭性念珠菌病病例增多,病死率居高不下。国内成年人侵袭性念珠菌院内感染的病死率高达37.7%[1],尚缺乏儿童侵袭性念珠菌院内感染系统的流行病学资料。本研究采用多中心回顾性调查,收集乌鲁木齐市5家三级医院2010年1月至2015年12月收治的确诊或临床诊断的134例侵袭性念珠菌病病例,分析侵袭性念珠菌感染的病原菌分布、临床特点、高危因素、治疗和预后,为提高儿童侵袭性真菌感染诊疗水平及改善患儿预后提供参考。
1 资料与方法 1.1 研究对象2010年1月至2015年12月间于新疆医科大学第一附属医院、新疆维吾尔自治区人民医院、乌鲁木齐市第一人民医院、新疆医科大学第二附属医院、新疆医科大学第五附属医院5家三级医院住院,血液、正常无菌体液(包括脑脊液、胸水、腹水、胆汁、关节腔积液等)、深部脏器组织(包括肺、肝、脑等)念珠菌培养或镜检阳性的病例纳入本研究。依据侵袭性真菌病诊断标准[2-3]筛选出“确诊”及“拟诊”为侵袭性念珠菌病的病例。剔除病例资料不全及重复病例,痰标本中分离出念珠菌菌株的病例也予以排除。根据上述入选标准,本研究共入选侵袭性念珠菌病病例134例,其中确诊127例,拟诊7例。134例患儿中,男78例(58.2%),女56例(41.8%),年龄7 d至14岁,平均年龄4岁5个月。其中新疆医科大学第一附属医院41例,新疆维吾尔自治区人民医院34例,乌鲁木齐市第一人民医院32例,新疆医科大学第二附属医院15例,新疆医科大学第五附属医院12例。
1.2 方法按照设计的侵袭性念珠菌病调查表,回顾性分析符合上述入选标准的侵袭性念珠菌病患儿的病例资料,包括患儿年龄、性别、住院科室、基础疾病、侵入性操作(留置深静脉置管、留置导尿管、有创机械通气、留置体腔引流管)、胃肠外营养、是否存在微生物学检查证实的相同真菌定植及抗生素使用情况等临床资料,并记录患儿抗真菌药物使用情况及预后。
1.3 统计学分析统计分析采用SPSS 19.0软件。计数资料以例数和百分比(%)表示,两组间率的比较采用χ2检验。对单因素分析有统计学意义的变量进行非条件多因素logistic回归分析,以明确念珠菌血流感染发生的独立危险因素。P < 0.05为差异有统计学意义。
2 结果 2.1 患儿一般情况134例患儿中,年龄 < 1个月18例(13.4%),1~24个月68例(50.7%), > 24个月48例(35.9%)。血流感染68例(50.7%),尿路感染45例(33.6%),其他部位感染21例(15.7%)。侵袭性念珠菌病发生前,56例(41.8%)曾入住PICU,13例(9.7%)入住NICU,65例(48.5%)入住儿科普通病房。机械通气治疗59例(44.0%),94.8%患儿出现侵袭性念珠菌病之前静脉使用过抗生素治疗。50例(37.3%)患儿培养结果出来之前经验性预防性使用过抗真菌药物。本组病例单用抗真菌药物治疗情况为:氟康唑79例(59.0%),卡泊芬净24例(17.9%),两性霉素B 20例(14.9%),伏立康唑5例(3.7%)。4例(3%)患儿伊曲康唑无效后改联合卡泊芬净与两性霉素B治疗。2例(1.5%)患儿联合卡泊芬净与伏立康唑治疗。30 d内病死率为17.2%(23例)。
2.2 微生物学检测结果134例患儿各种标本中分离出134株念珠菌菌株,其中白色念珠菌63株(47.0%),非白色念珠菌71株(53.%)。71株非白色念珠菌各类型菌种分布为:近平滑念珠菌18株,热带假丝酵母菌11株,光滑念珠菌6株,葡萄牙假丝酵母菌5株,乳酒假丝酵母菌3株,高里假丝酵母菌2株,克鲁斯假丝酵母菌和都柏林念珠菌各1株,另24株归为非白色念珠菌,但无法分类。不同感染部位、住院科室的念珠菌菌株分布见表 1。
| 表 1 不同感染部位及住院科室的念珠菌菌株分布[例(%)] |
2.3 血流感染组与非血流感染组间临床特征的比较
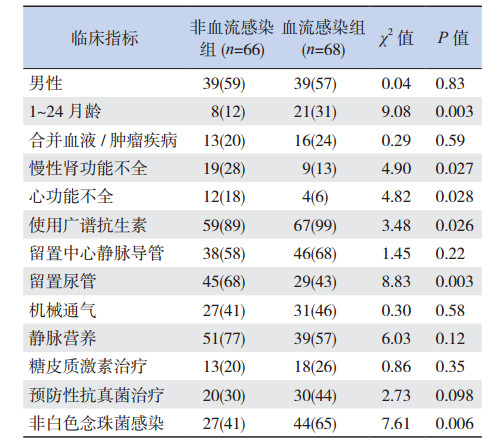
念珠菌血流感染组合并慢性肾功能不全、心功能不全、使用广谱抗生素、留置尿管及非白色念珠菌感染的比例高于非血流感染组(P < 0.05);1~24个月患儿比例血流感染组高于非血流感染组,而两组年龄 < 1个月及 > 24个月患儿比例差异无统计学意义(P > 0.05)。两组性别构成比及糖皮质激素使用率、预防性抗真菌治疗率、静脉营养率、机械通气率、留置中心静脉导管率及合并血液/肿瘤疾病率相比差异无统计学意义(P > 0.05)。见表 2。
| 表 2 血流感染组和非血流感染组临床特征的比较[例(%)] |
2.4 念珠菌血流感染的多因素回归分析
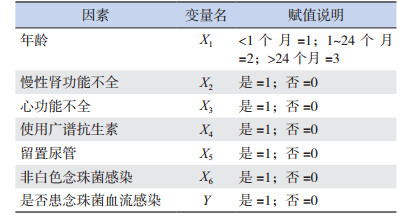
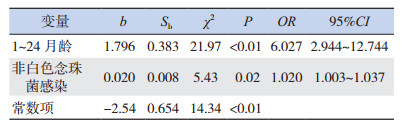
为控制各因素之间的相互作用和混杂,将上述单因素分析中差异有统计学意义的变量行多因素logistic回归分析,各变量赋值见表 3。多因素分析显示,年龄1~24个月(OR=6.027;95%CI:2.944~12.744)、非白色念珠菌感染(OR=1.020;95%CI:1.003~1.037)是发生念珠菌血流感染的独立危险因素(表 4)。
| 表 3 念珠菌血流感染可能的危险因素赋值说明 |
| 表 4 念珠菌血流感染危险因素的多因素回归分析 |
3 讨论
以往研究报道ICU侵袭性念珠菌病的发生率远高于普通病房,但近年的大规模调查结果显示大部分侵袭性念珠菌病病例发生于ICU之外的内外科普通病房[1, 3]。本研究结果显示,侵袭性念珠菌病在PICU及非PICU病区发病率基本相近,与国外学者Celebi等[4]及Pemán等[5]研究结果相近。目前对于新生儿、中性粒细胞减少、血液/肿瘤患儿及PICU住院患儿发生的侵袭性念珠菌病,由于高危因素较为明确,医生容易掌握及诊断。但在非PICU及非血液/肿瘤病区患儿中,侵袭性念珠菌病的误诊率相对较高,影响了患儿的治疗及预后。造成误诊的主要原因之一是对这些患儿发生侵袭性念珠菌病的高危因素认识不足。因此,临床工作中对各病区合并不同基础疾病及有潜在危险因素的患儿均应注意预防和监测侵袭性念珠菌病的发生。
近年来随着新型抗真菌药物应用于临床,菌种对抗真菌药易感性差异以及免疫缺陷性疾病及器官移植术增多等,真菌血流感染的病原体谱也发生着变迁,非白色念珠菌比例不断升高[6-8]。本研究中,非白色念珠菌占侵袭性念珠菌病菌种的53.0%,与文献报道结果相一致[9]。念珠菌血流感染的病原体谱与地域、年龄、原发病、住院科室(ICU及非ICU)、抗生素使用情况及抗真菌药物使用习惯不同有关[9-11]。
本研究多因素logistic回归分析结果显示,非白色念珠菌感染增加念珠菌血流感染的风险。本组病例中,近平滑念珠菌检出率在念珠菌血流感染患儿中达18%,仅次于白色念珠菌的检出率,成为本组病例血流感染的第二位病原菌。无论国内或国外的研究,近平滑念珠菌血液分离率都高于其他非白色念珠菌[9-12]。从近平滑念珠菌的分离部位来源看,血液都是近平滑念珠菌最常见的感染部位,生物膜形成是近平滑念珠菌最重要的毒力因子之一。由于近平滑念珠菌在高脂营养液中具有较好生长能力和对置入性导管等医疗装置的易亲和力,临床上也常见于导管相关感染或进行静脉高营养的患者[13]。值得注意的是,近平滑念珠菌在病人使用医疗设备前即可通过相关人员的手粘附到医疗设备上,从而形成生物膜,这与院内感染的发生有着密不可分的关系。这提示临床工作中应加强各种置管的严格无菌操作,采取合理预防措施以减少院内获得性侵袭性真菌感染的发生。
本研究单因素分析显示,应用广谱抗生素与念珠菌血流感染相关。长时间应用广谱抗生素可能破坏了肠内菌群环境,将杀死或抑制人体生态平衡菌群中的敏感菌株,导致真菌过度生长甚至恶性繁殖,继发真菌感染[14]。与年长儿相比,年幼儿皮肤黏膜屏障功能较差,真菌易定植,吞噬细胞和T淋巴细胞功能尚未发育成熟,对真菌的清除能力不足,这些因素造成年幼儿发生的念珠菌血流感染机会大于年长儿。本研究多因素分析结果显示,年龄1~24个月是发生念珠菌血流感染的独立危险因素,与其他两个年龄组患儿比较,1~24月龄患儿发生念珠菌血流感染危险性约增加5倍。
本研究134例侵袭性念珠菌病患儿病死率为17.2%,明显低于文献报道的25.5%~60%[4, 6]。本组病例病死率较低的原因考虑为:本研究的研究对象不包括骨髓移植者;未局限在PICU病区及高危因素明确患儿;37.3%患儿提前暴露于氟康唑治疗。
本研究尚存在一些局限。首先,本研究存在信息量不足及选择性偏倚等所有回顾性研究都存在的固有限制。其次,本研究为多中心研究,有些中心的药敏试验结果资料不全,故无法进行药敏及耐药性分析。最后,鉴于回顾性分析危险因素,考察的指标可能不够全面。
综上所述,侵袭性念珠菌病在儿科ICU及非ICU病区发生率基本相同,因此,临床工作中对各病区合并不同基础疾病及危险因素的患儿均应注意预防和监测侵袭性念珠菌病的发生。儿童侵袭性念珠菌病的感染菌株以非白色念珠菌为主,非白念珠菌感染已经成为一个不容忽视的问题。年龄1~24个月、非白色念珠菌感染是发生念珠菌血流感染的独立危险因素。临床怀疑念珠菌血流感染且存在上述高危因素时,如及时做相关病原学检查困难,可尽早进行经验性抗真菌治疗。
志谢: 本研究病例的收集得到新疆维吾尔自治区人民医院儿科罗新辉主任、乌鲁木齐市儿童医院PICU刘璐主任、新疆医科大学第二附属医院儿科李淑芬主任、新疆医科大学第五附属医院儿科陈春花主任的大力支持;本研究数据由新疆医科大学流行病学教研室培尔顿·米吉提副教授协助统计,特此感谢。| [1] | Cuenca-Estrella M, Verweij PE, Arendrup MC, et al. ESCMID* guideline for the diagnosis and management of Candida diseases 2012:diagnostic procedures[J]. Clin Microbiol Infect, 2012, 18 (Suppl 7): 9–18. |
| [2] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童侵袭性肺部真菌感染诊治指南 (2009版)[J]. 中华儿科杂志, 2009, 47 (2): 96–98. |
| [3] | Pappas PG, Kauffman CA, Andes D, et al. Clinical practice guidelines for the management of candidiasis:2009 update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2009, 48 (5): 503–535. DOI:10.1086/597768 |
| [4] | Celebi S, Hacimustafaoglu M, Ozdemir O, et al. Nosocomial candidaemia in children:results of a 9-year study[J]. Mycoses, 2008, 51 (3): 248–257. DOI:10.1111/j.1439-0507.2007.01464.x |
| [5] | Pemán J, Cantón E, Quindós G, et al. Epidemiology, species distribution and in vitro antifungal susceptibility of fungaemia in a Spanish multicentre prospective survey[J]. Antimicrob Chemother, 2012, 67 (5): 1181–1187. DOI:10.1093/jac/dks019 |
| [6] | Hegazi M, Abdelkader A, Zaki M, et al. Characteristics and risk factors of candidemia in pediatric intensive care unit of a tertiary care children's hospital in Egypt[J]. J Infect Dev Ctries, 2014, 8 (5): 624–634. |
| [7] | Wisplinghoff H, Ebbers J, Geurtz L, et al. Nosocomial bloodstream infections due to Candida spp. in the USA:species distribution, clinical features and antifungal susceptibilities[J]. Int J Antimicrob Agents, 2014, 43 (3): 78–81. |
| [8] | Oliveira VK, Ruiz Lda S, Oliveira NA, et al. Fungemia caused by Candida species in a children's public hospital in the city of São Paulo, Brazil:study in the period 2007-2010[J]. Rev Inst Med Trop Sao Paulo, 2014, 56 (4): 301–305. DOI:10.1590/S0036-46652014000400006 |
| [9] | Dutta A, Palazzi DL. Candida non-albicans versus Candida albicans fungemia in the non-neonatal pediatric population[J]. Pediatr Infect Dis, 2011, 30 (8): 664–668. DOI:10.1097/INF.0b013e318213da0f |
| [10] | Kuzucu C, Durmaz R, Otlu B, et al. Species distribution, antifungal susceptibility and clonal relatedness of Candida isolates from patients in neonatal and pediatric intensive care units at a medical center in Turkey[J]. New Microbiol, 2008, 31 (3): 401–408. |
| [11] | 郭鹏豪, 廖康, 陈冬梅, 等. 2009-2012年临床无菌体液标本中真菌的菌群分布及药敏分析[J]. 国际检验医学杂志, 2013, 34 (24): 3414–3416. |
| [12] | 郭靓, 康梅, 谢轶. 华西医院近年血液及脑脊液中真菌培养结果回顾分析[J]. 现代预防医学, 2013, 40 (8): 1510–1513. |
| [13] | Chen CY, Sheng WH, Huang SY, et al. Clinical characteristics and treatment outcomes of patients with candidaemia due to Candida parapsilosis sensu lato species at a medical centre in Taiwan, 2000-12[J]. J Antimicrob Chemother, 2015, 70 (5): 1531–1538. DOI:10.1093/jac/dku540 |
| [14] | Erdem F, Tuncer Ertem G, Oral B, et al. Epidemiological and microbiological evaluation of nosocomial infections caused by Candida species[J]. Mikrobiyol Bul, 2012, 46 (4): 637–648. |
 2017, Vol. 19
2017, Vol. 19