肺炎是小儿常见病,是住院患儿死亡的主要原因之一,部分患儿可反复多次发生肺炎[1]。反复肺炎是指1年内反复患肺炎≥2次,肺炎由肺部体征和影像学证实,两次肺炎诊断期间肺炎体征和影像学改变应完全消失[2]。反复肺炎对某些群体的小儿有着重要的临床现实意义,及时检出高危患儿并给予相应的处理十分必要。反复肺炎的病因复杂,其常见病因为先天性或获得性呼吸系统解剖结构异常、呼吸道吸入、先天性心脏病、哮喘、免疫缺陷等,仍有部分患儿病因不明[1, 3]。部分研究表明反复肺炎患儿存在体液及细胞免疫功能紊乱[4-5]。YKL-40,又称人软骨糖蛋白39(human cartilage glycoprotein-39)、几丁质酶3样蛋白1(human chitinase-3-like protein 1),是人类几丁质酶蛋白家族成员之一,因其氨基末端分别为酪氨酸(Y)、赖氨酸(K)、亮氨酸(L),分子量为40 kD,因而命名为YKL-40[6]。研究表明,YKL-40是一种急性时相蛋白,在炎症反应及多种肿瘤疾病患者中水平增高[7-8],并与肺炎病情及预后相关[9]。YKL-40是目前的研究热点,其在肺炎方面研究的主要对象为社区获得性肺炎,尚无关于反复肺炎YKL-40水平变化的研究,且无YKL-40与免疫功能相关性的研究报道。为此,本研究通过探讨反复肺炎患儿的血清YKL-40及体液免疫功能的变化,并进行YKL-40与体液免疫的相关性分析及YKL-40对反复肺炎诊断价值的分析,为反复肺炎的发生机制提供理论依据,并为反复肺炎的临床诊断寻找新的实验室参考指标。
1 资料与方法 1.1 研究对象反复肺炎组:2014年10月至2016年6月于郑州大学第一附属医院住院并首次确诊的反复肺炎患儿30例,其中男20例,女10例,中位年龄4.0岁,中位体重18.0 kg。反复肺炎诊断标准:1年内反复患肺炎≥2次,肺炎须由肺部体征和影像学证实,两次肺炎诊断期间肺炎体征和影像学改变应完全消失[2]。
急性肺炎组:不满足反复肺炎的诊断标准,经肺部体征和影像学证实的同期于我院住院的急性肺炎患儿30例,其中男16例,女14例,中位年龄6.0岁,中位体重19.5 kg。
对照组:同期于我院门诊体检的健康儿童30例,其中男19例,女11例,中位年龄5.0岁,中位体重18.5 kg。3组儿童的性别、年龄、体重比较差异无统计学意义(P > 0.05)。
以上3组儿童均无先天性免疫缺陷病、先天性气管支气管肺发育畸形、先天性心脏病、支气管异物、支气管哮喘、肿瘤性疾病、结缔组织病、高血压、糖尿病等疾病;本次病程不超过3 d,且院外未应用抗生素。本研究通过我院医学伦理委员会批准,并获得患儿家长书面知情同意。
1.2 血清YKL-40及体液免疫相关指标的检测收集反复肺炎组、急性肺炎组(入院次日)及对照组空腹静脉血2 mL,离心后取上清液至EP管,分别编号并保存于-80℃冰箱待测。
血清YKL-40:应用酶联免疫吸附法测定并计算YKL-40浓度。YKL-40试剂盒由美国Quidel公司生产。血清IgG、IgA、IgE、IgM、补体C3、补体C4含量由郑州大学第一附属医院免疫室测定。
1.3 统计学分析采用SPSS 21.0统计软件进行数据处理与分析。计量资料以均数±标准差(x± s)或中位数(四分位数间距)[M(P25,P75)]表示。3组间比较采用Kruskal-Wallis检验,两个独立样本组间比较采用Wilcoxon检验或t检验。相关性分析采用Pearson或Spearman相关分析。采用受试者工作特征(ROC)曲线分析血清YKL-40对反复肺炎的诊断价值。P < 0.05为差异有统计学意义。
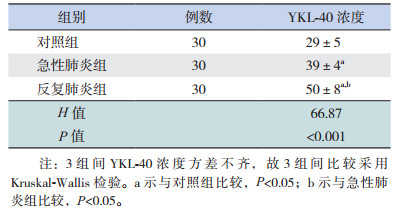
2 结果 2.1 各组血清YKL-40浓度的比较反复肺炎组血清YKL-40浓度高于急性肺炎组及对照组(Z值分别为-5.53,-6.65,P < 0.05);急性肺炎组血清YKL-40浓度高于对照组(Z=-5.64,P < 0.05),见表 1。
| 表 1 各组血清YKL-40浓度的比较(x± s,ng/mL) |
2.2 反复肺炎组和急性肺炎组体液免疫功能的比较
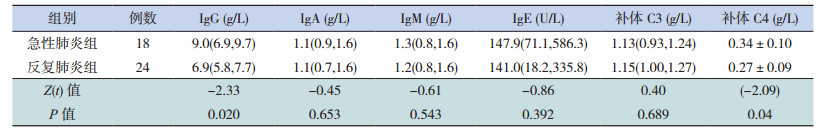
反复肺炎组血清IgG、补体C4水平均低于急性肺炎组(分别Z=-2.33,t=-2.09,均P < 0.05),而两组血清IgA、IgM、IgE、补体C3水平比较差异无统计学意义(P > 0.05),见表 2。
| 表 2 反复肺炎组和急性肺炎组体液免疫功能的比较[M(P25,P75)或x± s] |
2.3 血清YKL-40与体液免疫的相关性
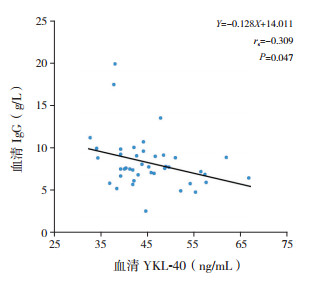
Spearman相关分析显示,反复肺炎组及急性肺炎组患儿血清YKL-40浓度与IgG水平呈负相关(rs=-0.309,P=0.047),见图 1。血清YKL-40浓度与IgA、IgE、IgM、补体C3水平均无明显相关性(P > 0.05)。
|
图 1 患儿血清YKL-40与IgG的相关性 |
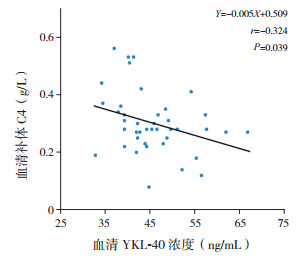
Pearson相关分析显示,反复肺炎组及急性肺炎组患儿血清YKL-40浓度与补体C4水平呈负相关(r=-0.324,P=0.039),见图 2。
|
图 2 患儿血清YKL-40与补体C4的相关性 |
2.4 血清YKL-40对反复肺炎诊断价值的ROC曲线分析
血清YKL-40对反复肺炎诊断价值的ROC曲线分析显示,YKL-40诊断反复肺炎的ROC曲线下面积为0.958(95%CI:0.921~0.994),见图 3。
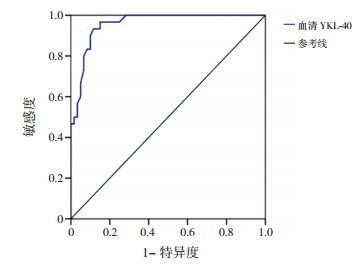
|
图 3 血清YKL-40对反复肺炎诊断价值的ROC曲线 |
3 讨论
世界卫生组织(WHO)和联合国儿童基金会(UNICEF)的儿童流行病学专家组(CHERG)发布的“全球儿童死亡原因”分析显示,肺炎病死率为14.9%,是5岁以下儿童死亡的第一位原因[10],且部分患儿可反复多次发生肺炎,即反复肺炎,给患儿、家庭和社会带来沉重的负担。
反复肺炎的发生率高,据既往流行病学统计,反复肺炎占肺炎的8%左右[1, 11],且反复肺炎病因复杂,其常见病因为先天性或获得性呼吸系统解剖结构异常、呼吸道吸入、先天性心脏病、哮喘、免疫缺陷等,仍有部分患儿病因不明[1, 3]。部分研究表明,反复肺炎患儿存在体液及细胞免疫功能低下,尤其是辅助性T淋巴细胞功能异常、免疫球蛋白IgG等减少及炎性因子IL-8、IL-17增高[4, 5, 12]。本研究结果也显示反复肺炎存在体液免疫功能低下,尤其是免疫球蛋白IgG及补体C4的减低。
YKL-40是几丁质酶蛋白家族成员之一,是由中性粒细胞、巨噬细胞、血管平滑肌细胞、软骨细胞、滑膜细胞及多种肿瘤细胞(如大肠癌、肾癌、肺癌、卵巢癌等)分泌的促炎细胞因子,参与多种急慢性炎症反应[13-17]。国内外研究表明社区获得性肺炎患儿的血清YKL-40水平升高,且与疾病的严重程度及预后相关[9, 18]。本研究发现反复肺炎患儿的血清YKL-40水平较急性肺炎患儿及正常儿童明显升高,且ROC曲线提示YKL-40可作为反复肺炎诊断的指标,可见YKL-40参与反复肺炎的发生,但YKL-40在反复肺炎中的作用机制目前尚不明确。Lee等[19]发现YKL-40在抗原致敏、免疫球蛋白E的诱导、树突状细胞及巨噬细胞的激活中发挥重要作用,且可以通过抑制Fas的表达、激活蛋白激酶B(PKB/AKT)、诱导Faim 3,抑制炎症细胞的凋亡,在Th2型炎症反应起始及效应过程中发挥重要的调节作用,而无YKL-40时,IL-13诱导组织炎症和纤维化的能力也显著降低。Letuve等[20]认为TNF-α可促进慢性阻塞性肺疾病患者肺泡巨噬细胞合成YKL-40,而巨噬细胞在YKL-40的作用下促进IL-8、MCP-1、MIP-1α和金属蛋白酶-9的释放,有助于组织炎症和重塑。Ober等[21]认为CHI3L1启动子(编码YKL-40的基因)中的单核苷酸多态性与循环YKL-40水平及哮喘患病率有关,其中rs12141494和rs4950928的G等位基因与较低的YKL-40水平及较高的FEV1%预计值相关联,rs12141494的风险等位基因A与哮喘严重性及气道高水平YKL-40有关。另有研究发现用YKL-40处理的支气管上皮细胞通过MAPK和NF-κB途径的激活,导致IL-8的产生显著增加,YKL-40诱导的IL-8进一步刺激支气管平滑肌细胞的增殖和迁移,并在去除IL-8后这一作用被抑制[22]。本研究发现血清YKL-40水平与免疫球蛋白IgG及补体C4呈负相关,但YKL-40与IgG及补体C4的具体相互作用过程仍需进一步研究。
综上所述,反复肺炎患儿存在体液免疫功能低下,表现为免疫球蛋白IgG及补体C4水平减低。YKL-40可能参与了反复肺炎的发生,但其具体作用机制尚需进一步研究。YKL-40可作为反复肺炎诊断的参考指标,但反复肺炎诊断的YKL-40浓度参考值仍需大样本研究确定。
| [1] | Saad K, Mohamed SA, Metwallety KA. Recurrent/Persistent pneumonia among children in Upper Egypt[J]. Mediterr J Hematol Infect Dis, 2013, 5 (1): e2013028. DOI:10.4084/mjhid.2013.028 |
| [2] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 反复呼吸道感染的临床概念和处理原则[J]. 中华儿科杂志, 2008, 46 (2): 108–110. |
| [3] | 李惠民, 江载芳, 江沁波, 等. 小儿反复肺炎的基础疾病和诊断分析[J]. 中国实用儿科杂志, 2004, 19 (3): 153–155. |
| [4] | 张立梅. 儿童反复肺炎与机体免疫功能和炎性相关因子的关系研究[J]. 河北医药, 2016, 38 (9): 1333–1335. |
| [5] | Owayed AF, Campbell DM, Wang EE. Underlying causes of recurrent pneumonia in children[J]. Arch Pediatr Adolesc Med, 2000, 154 (2): 190–194. DOI:10.1001/archpedi.154.2.190 |
| [6] | Johansen JS, Williamson MK, Rice JS, et al. Identification of proteins secreted by human osteoblastic cells in culture[J]. J Bone Miner Res, 1992, 7 (5): 501–512. |
| [7] | Libreros S, Iragavarapu-Charyulu V. YKL-40/CHI3L1 drives inflammation on the road of tumor progression[J]. J Leukoc Biol, 2015, 98 (6): 931–936. DOI:10.1189/jlb.3VMR0415-142R |
| [8] | Roslind A, Johansen JS. YKL-40:a novel marker shared by chronic inflammation and oncogenic transformation[J]. Methods Mol Biol, 2009, 511 (7): 159–184. |
| [9] | Wang HL, Hsiao PC, Tsai HT, et al. Usefulness of plasma YKL-40 in management of community-acquired pneumonia severity in patients[J]. Int J Mol Sci, 2013, 14 (11): 22817–22825. DOI:10.3390/ijms141122817 |
| [10] | Liu L, Oza S, Hogan D, et al. Global, regional, and national causes of child mortality in 2000-13, with projections to inform post-2015 priorities:an updated systematic analysis[J]. Lancet, 2015, 385 (9966): 430–440. DOI:10.1016/S0140-6736(14)61698-6 |
| [11] | Patria F, Longhi B, Tagliabue C, et al. Clinical profile of recurrent community-acquired pneumonia in children[J]. BMC Pulm Med, 2013, 13 : 60. DOI:10.1186/1471-2466-13-60 |
| [12] | 王萍, 周戎, 何永涛, 等. 反复呼吸道感染患儿血清免疫指标的观察分析[J]. 中国医院感染学杂志, 2016, 26 (15): 3554–3556. |
| [13] | Volck B, Price PA, Johansen JS, et al. YKL-40, a mammalian member of the chitinase family, is a matrix protein of specific granules in human neutrophils[J]. Proc Assoc Am Physicians, 1998, 110 (4): 351–360. |
| [14] | Hakala BE, White C, Recklies AD. Human cartilage gp-39, a major secretory product of articular chondrocytes and synovial cells, is a mammalian member of a chitinase protein family[J]. J Biol Chem, 1993, 268 (34): 25803–25810. |
| [15] | Malinda KM, Ponce L, Kleinman HK, et al. Gp38k, a protein synthesized by vascular smooth muscle cells, stimulates directional migration of human umbilical vein endothelial cells[J]. Exp Cell Res, 1999, 250 (1): 168–173. DOI:10.1006/excr.1999.4511 |
| [16] | Salvatore V, Focaroli S, Teti G, et al. Changes in the gene expression of co-cultured human fibroblast cells and osteosarcoma cells:the role of microenvironment[J]. Oncotarget, 2015, 6 (30): 28988–28998. |
| [17] | Senetta R, Duregon E, Sonetto C, et al. YKL-40/c-Met expression in rectal cancer biopsies predicts tumor regression following neoadjuvant chemoradiotherapy:a multi-institutional study[J]. PLoS One, 2015, 10 (4): e0123759. DOI:10.1371/journal.pone.0123759 |
| [18] | 孙海斌, 王晓雷, 李征瀛, 等. ROC曲线评价血清人软骨糖蛋白39在儿童社区获得性肺炎诊断和预测并发症中的应用[J]. 东南大学学报 (医学版), 2014, 33 (6): 768–771. |
| [19] | Lee CG, Hartl D, Lee GR, et al. Role of breast regression protein 39(BRP-39)/chitinase 3-like-1 in Th2 and IL-13-induced tissue responses and apoptosis[J]. J Exp Med, 2009, 206 (5): 1149–1166. DOI:10.1084/jem.20081271 |
| [20] | Letuve S, Kozhich A, Arouche N, et al. YKL-40 is elevated in patients with chronic obstructive pulmonary disease and activates alveolar macrophages[J]. J Immunol, 2008, 181 (7): 5167–5173. DOI:10.4049/jimmunol.181.7.5167 |
| [21] | Ober C, Tan Z, Sun Y, et al. Effect of variation in CHI3L1 on serum YKL-40 level, risk of asthma, and lung function[J]. N Engl J Med, 2008, 358 (16): 1682–1691. DOI:10.1056/NEJMoa0708801 |
| [22] | Tang H, Sun Y, Shi Z, et al. YKL-40 induces IL-8 expression from bronchial epithelium via MAPK (JNK and ERK) and NF-κB pathways, causing bronchial smooth muscle proliferation and migration[J]. J Immunol, 2013, 190 (1): 438–446. DOI:10.4049/jimmunol.1201827 |
 2017, Vol. 19
2017, Vol. 19