脑缺氧缺血(HI)所诱导的神经元凋亡是引起新生儿缺氧缺血性脑病病理改变及神经系统后遗症的重要原因之一。c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)信号通路是丝裂原激活蛋白激酶(MAPK)超家族之一,参与神经细胞的生长、分化、凋亡、增殖等调控过程。近年来,在新生鼠缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)动物模型的研究中发现,JNK信号通路在神经细胞凋亡信号转导中起促进作用,选择性抑制JNK可抑制HI诱导的神经细胞凋亡,对HIBD具有保护作用[1]。本课题组前期研究发现,核转录因子FOXO3a的核转位在发育脑HI诱导的神经元凋亡信号转导中发挥重要作用[2]。但是,FOXO3a的核转位是否涉及促凋亡因子JNK的调控,目前尚不清楚,是本课题要探索的核心所在。本实验旨在建立7日龄新生大鼠HIBD模型的基础上,探讨抑制JNK活性对FOXO3a的核转位及发育脑HI后神经元凋亡的保护作用机制,为临床治疗新生儿缺氧缺血性脑病提供新思路。
1 材料与方法 1.1 实验动物与材料清洁级新生7日龄Sprague-Dawley大鼠64只,雌雄不限,体重20~25 g,由四川大学华西医学中心实验动物中心提供。兔抗大鼠JNK单克隆抗体、兔抗大鼠p-JNK多克隆抗体及兔抗大鼠FOXO3a多克隆抗体均购自美国Cell Signaling公司,兔抗大鼠Bim多克隆抗体购自美国Abcam公司,兔抗大鼠CC3多克隆抗体购自美国Millipore公司,兔抗大鼠GAPDH多克隆抗体购自美国Sigma公司。JNK特异性抑制剂AS601245购自美国Sigma公司。TUNEL原位细胞凋亡检测试剂盒购自美国Millipore公司。
1.2 动物分组与模型制作将64只新生大鼠按随机数字表法随机分为假手术组、HI组、二甲基亚砜(DMSO)溶剂组和JNK抑制剂AS601245干预组(JNK抑制剂组),每组8只。HI组在乙醚麻醉下行右侧颈总动脉结扎,氧氮混合气(8%O2、92%N2)缺氧2.5 h,即为HIBD模型[3];假手术组仅分离右侧颈总动脉,不结扎,不做缺氧处理;JNK抑制剂组参照Tu等[4]研究方法,于右侧脑室内注射AS601245(150 nmol,5 μL,溶于DMSO中),30 min后做HI处理;DMSO溶剂组于相同时间点给予右侧脑室注射等容量的DMSO,30 min后做HI处理。
1.3 标本采集于HI后24 h,经乙醚麻醉后处死4组大鼠,取右侧大脑皮层,-80℃冻存。
1.4 Western blot检测JNK、p-JNK、FOXO3a及Bim表达将冻存脑皮层组织取出,冰上匀浆,低温离心机内14 000 r/min,离心30 min。按Pierce蛋白分离试剂盒实验步骤抽提胞核和胞浆蛋白,用作测定胞核及胞浆FOXO3a。取上清,BCA法测蛋白浓度,各孔加入100 μg蛋白样品电泳、转膜,5%小牛血清封闭液封闭1 h,分别加入一抗:兔抗大鼠JNK单克隆抗体(1:1 000)、兔抗大鼠p-JNK多克隆抗体(1:1 000)、兔抗大鼠FOXO3a多克隆抗体(1:800)、兔抗大鼠Bim多克隆抗体(1:200)、兔抗大鼠CC3多克隆抗体(1:100)和兔抗大鼠GAPDH多克隆抗体(1:2 000),4℃孵育过夜。TBST洗膜3次,二抗室温孵育1 h,TBST洗膜3次,ECL显色,用Gel-pro凝胶成像分析软件测定条带的积分光密度值(IOD),并计算目的蛋白和内参GAPDH的IOD比值,即为相对光密度。
1.5 TUNEL染色法检测凋亡细胞每个实验样本行5 μm切片,每隔5张切片选取1张,共取10张切片。按TUNEL细胞凋亡检测试剂盒操作步骤进行。切片常规脱蜡,梯度酒精水化,PBS洗2次,每次5 min,3%过氧化氢室温避光10 min,蛋白酶K(20 μg/mL)消化7 min;PBS洗1次,每次5 min,滴加荧光素片段末端标记TdT酶反应液,37℃孵育60 min,PBS洗2次,每次1 min,DAPI染色。以未添加TdT酶作为阴性对照。每张切片选择5个以上具有代表性的高倍视野(×400)计算凋亡指数。凋亡指数=凋亡细胞数/细胞总数×100%。
1.6 统计学分析采用SPSS 10.0统计软件包对数据进行统计学分析,计量资料以均数±标准差(x± s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
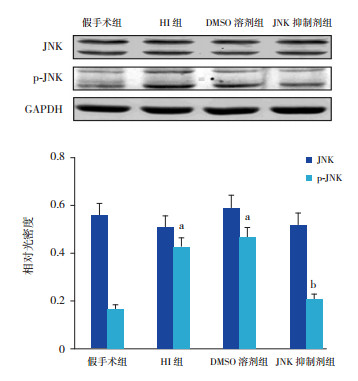
2 结果 2.1 HI后24 h各组大鼠脑皮层JNK及p-JNK的表达Western blot结果显示,HI后24 h,无论应用抑制剂与否,各组大鼠脑皮层JNK蛋白表达水平比较差异无统计学意义(P > 0.05);与假手术组比较,HI组及DMSO溶剂组p-JNK蛋白水平增加(P < 0.01);与HI组及DMSO溶剂组比较,JNK抑制剂组p-JNK蛋白水平降低(P < 0.01)。见图 1。
|
图 1 Western blot检测HI后24 h各组大鼠脑皮层JNK及p-JNK的表达水平 上图为电泳图;下图为统计图(n=8),a示与假手术组比较,P < 0.01;b示与HI组及DMSO溶剂组比较,P < 0.01。 |
2.2 HI后24 h各组大鼠脑皮层FOXO3a蛋白的表达
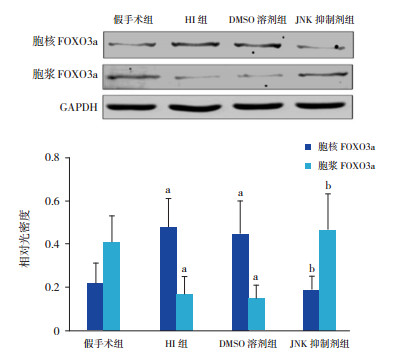
Western blot结果显示,HI后24 h,假手术组、HI组、DMSO溶剂组、JNK抑制剂组脑皮层FOXO3a总蛋白相对光密度值分别为0.73±0.11、0.69±0.08、0.68±0.12、0.74±0.10,差异无统计学意义(F=0.324,P > 0.05)。与假手术组比较,HI组及DMSO溶剂组胞核FOXO3a蛋白水平增加,胞浆FOXO3a蛋白水平降低(P < 0.01);与HI组及DMSO溶剂组比较,JNK抑制剂组胞核FOXO3a蛋白水平降低,胞浆FOXO3a蛋白水平增高(P < 0.01)。见图 2。
|
图 2 Western blot检测HI后24 h各组大鼠脑皮层胞核及胞浆FOXO3a蛋白的表达水平 上图为电泳图;下图为统计图(n=8),a示与假手术组比较,P < 0.01;b示与HI组及DMSO溶剂组比较,P < 0.01。 |
2.3 HI后24 h各组大鼠脑皮层促凋亡蛋白Bim及CC3的表达
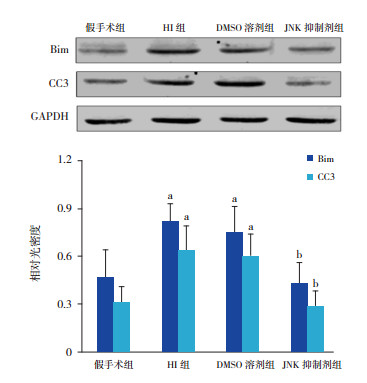
Western blot结果显示,HI后24 h,与假手术组比较,HI组及DMSO溶剂组Bim及CC3蛋白表达增加(P < 0.01);与HI组及DMSO溶剂组比较,JNK抑制剂组Bim及CC3蛋白表达降低(P < 0.01)。见图 3。
|
图 3 Western blot检测HI后24 h各组大鼠脑皮层Bim及CC3的表达水平 上图为电泳图;下图为统计图(n=8),a示与假手术组比较,P < 0.01;b示与HI组及DMSO溶剂组比较,P < 0.01。 |
2.4 HI后24 h各组大鼠脑皮层神经细胞凋亡情况
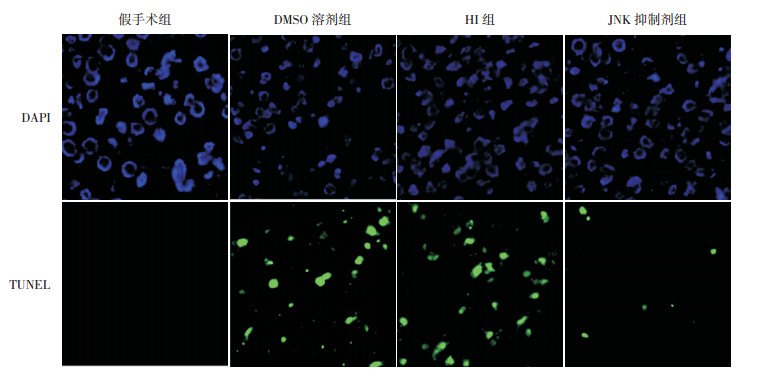
TUNEL染色结果显示,HI后24 h,各组大鼠脑皮层神经细胞凋亡指数比较差异有统计学意义(F=35.43,P < 0.01)。与假手术组凋亡指数(0.55±0.21)比较,HI组凋亡细胞数量增加,凋亡指数(31.36±5.06)升高(P < 0.01);与HI组及DMSO溶剂组凋亡指数(32.27±5.72)比较,JNK抑制剂组凋亡细胞数量减少,凋亡指数(13.17±2.59)降低(P < 0.01)。见图 4。
|
图 4 HI后24 h各组大鼠脑皮层凋亡细胞表达情况(TUNEL染色,×400)(n=8) 假手术组未见凋亡细胞;HI后24 h,HI组及DMSO溶剂组凋亡细胞明显增加;与HI组及DMSO溶剂组比较,JNK抑制剂组凋亡细胞表达显著减少。细胞核染成绿色为凋亡细胞。 |
3 讨论
近年来研究表明,JNK信号通路在神经细胞凋亡信号转导中起促进作用,选择性抑制JNK可阻断前凋亡蛋白Bax转位至线粒体,抑制脑缺血诱导的神经细胞凋亡[5-6]。核转录因子FOXO3a是PI3K/Akt信号通路下游底物[7],与细胞的增殖、衰老、凋亡、分化、肿瘤的发生密切相关[8-9],近年来已成为医学界研究的热点。本课题组前期在新生大鼠脑HI的研究中发现,脑HI刺激后,核转录因子FOXO3a核转位增加,诱导靶基因促凋亡蛋白Bim表达,促进HI神经元凋亡[10]。但发育脑HI后FOXO3a的核转位是否涉及JNK的调控目前尚不清楚,也是本课题探讨的核心所在。
本研究选择生后7日龄Sprague-Dawley大鼠为研究对象,采用Rice等[3]方法建立HIBD模型,以HI后24 h为观察时间点,检测JNK、p-JNK、FOXO3a及促凋亡蛋白Bim、CC3的表达变化。本研究发现新生大鼠HIBD时,JNK发生磷酸化,促进核转录因子FOXO3a发生核转位,启动促凋亡蛋白Bim及CC3表达,诱导神经元凋亡;抑制JNK活性可抑制FOXO3a核转位,下调Bim及CC3蛋白表达,减少神经细胞凋亡,对新生大鼠HI神经元凋亡具有保护作用。
Tu等[4]研究发现,成年大鼠局灶性脑缺血后24 h,JNK活性明显增高,给予JNK特异性抑制剂AS601245,大鼠脑梗塞面积明显减少,对缺血性脑损伤具有保护作用。本研究借鉴该方法,于建立HIBD模型前30 min,给予新生大鼠侧脑室注射AS601245,选择HI后24 h作为观察时间点,检测AS601245对HIBD新生大鼠JNK活性的影响。结果显示,HI后24 h,JNK总蛋白水平无明显变化,但p-JNK水平明显增加,表明HI诱导JNK发生了磷酸化。给予JNK抑制剂AS601245后,JNK总蛋白水平无变化,但p-JNK水平明显降低,表明AS601245对HI诱导的JNK活化具有抑制作用。
近年对肿瘤的研究表明,核转录因子FOXO3a是JNK诱导肿瘤细胞凋亡的下游靶点[11-12]。本课题组前期研究表明,HI促进新生大鼠大脑皮层FOXO3a发生核转位,诱导前凋亡蛋白Bim表达增加,Bim表达增加与神经元凋亡有关[9]。为进一步探讨JNK是否通过调控FOXO3a核转位而参与HI后神经元凋亡调控,本研究采用Western blot检测JNK下游FOXO3a及靶基因促凋亡蛋白Bim的表达变化,TUNEL染色检测凋亡细胞;观察HI后JNK抑制剂AS601245对上述指标的影响。通过分离大脑皮层胞核与胞浆蛋白后发现,与假手术组比较,HI组胞核FOXO3a蛋白水平增高;与之相反,胞浆FOXO3a蛋白水平降低,而FOXO3a总蛋白水平无明显变化。以上结果表明,HI虽未引起新生大鼠大脑皮层FOXO3a总蛋白水平发生改变,但促进了FOXO3a自胞浆转位入胞核。
本研究进一步探讨JNK抑制对HI神经元凋亡的保护机制。结果显示,与HI组及DMSO溶剂组比较,JNK抑制剂组的胞核FOXO3a蛋白水平降低,胞浆FOXO3a蛋白水平增高,而FOXO3a总蛋白水平无明显变化,表明抑制JNK可抑制HI诱导的FOXO3a核转位。促凋亡蛋白Bim是FOXO3a介导凋亡的下游直接靶蛋白[13]。在细胞凋亡的进程中,Bim活化后,可通过拮抗Bcl-2等抗凋亡因子或直接与促凋亡因子如Bax相互作用,并共同转位到线粒体膜,引起细胞色素C释放,激活Caspase,最终导致细胞凋亡[14]。本研究发现,与HI组及DMSO溶剂组比较,JNK抑制剂组的促凋亡蛋白Bim及CC3表达明显降低,TUNEL阳性细胞显著减少,凋亡指数降低约58%。以上的研究结果表明,抑制JNK不仅抑制HI诱导的FOXO3a核转位,下调促凋亡蛋白Bim及CC3表达,还显著减少了神经细胞的凋亡,对HIBD新生大鼠神经元凋亡具有保护作用。
综上,本研究表明,新生大鼠HIBD时,JNK发生磷酸化,活性增高;抑制JNK活性可抑制FOXO3a核转位,下调促凋亡蛋白Bim及CC3表达,减少神经细胞凋亡。
| [1] | Nijboer CH, Bonestroo HJ, Zijlstra J, et al. Mitochondrial JNK phosphorylation as a novel therapeutic target to inhibit neuroinflammation and apoptosis after neonatal ischemic brain damage[J]. Neurobiol Dis, 2013, 54 : 432–444. DOI:10.1016/j.nbd.2013.01.017 |
| [2] | Li D, Qu Y, Mao M, et al. Involvement of the PTEN-AKTFOXO3a pathway in neuronal apoptosis in developing rat brain after hypoxia-ischemia[J]. J Cereb Blood Flow Metab, 2009, 29 (12): 1903–1913. DOI:10.1038/jcbfm.2009.102 |
| [3] | Rice JE 3rd, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J]. Ann Neurol, 1981, 9 (2): 131–141. DOI:10.1002/(ISSN)1531-8249 |
| [4] | Tu YF, Tsai YS, Wang LW, et al. Overweight worsens apoptosis, neuroinflammation and blood-brain barrier damage after hypoxic ischemia in neonatal brain through JNK hyperactivation[J]. J Neuroinflammation, 2011, 8 : 40. DOI:10.1186/1742-2094-8-40 |
| [5] | Okuno S, Saito A, Hayashi T, et al. The c-Jun N-terminal protein kinase signaling pathway mediates Bax activation and subsequent neuronal apoptosis through interaction with Bim after transient focal cerebral ischemia[J]. J Neurosci, 2004, 24 (36): 7879–7887. DOI:10.1523/JNEUROSCI.1745-04.2004 |
| [6] | Gao Y, Signore AP, Yin W, et al. Neuroprotection against focal ischemic brain injury by inhibition of c-Jun N-terminal kinase and attenuation of the mitochondrial apoptosis-signaling pathway[J]. J Cereb Blood Flow Metab, 2005, 25 (6): 694–712. DOI:10.1038/sj.jcbfm.9600062 |
| [7] | Santo EE, Stroeken P, Sluis PV, et al. FOXO3a is a major target of inactivation by PI3K/AKT signaling in aggressive neuroblastoma[J]. Cancer Res, 2013, 73 (7): 2189–2198. DOI:10.1158/0008-5472.CAN-12-3767 |
| [8] | Webb AE, Kundaje A, Brunet A. Characterization of the direct targets of FOXO transcription factors throughout evolution[J]. Aging Cell, 2016, 15 (4): 673–685. DOI:10.1111/acel.2016.15.issue-4 |
| [9] | Eijkelenboom A, Burgering BM. FOXOs:signalling integrators for homeostasis maintenance[J]. Nat Rev Mol Cell Biol, 2013, 14 (2): 83–97. |
| [10] | 李德渊, 屈艺, 李晋辉, 等. 核转录因子FOXO3a在新生大鼠缺氧缺血性脑损伤神经元凋亡中的作用[J]. 中国当代儿科杂志, 2013, 15 (11): 1023–1027. DOI:10.7499/j.issn.1008-8830.2013.11.023 |
| [11] | Yu T, Ji J, Guo YL. MST1 activation by curcumin mediates JNK activation, Foxo3a nuclear translocation and apoptosis in melanoma cells[J]. Biochem Biophys Res Commun, 2013, 441 (1): 53–58. DOI:10.1016/j.bbrc.2013.10.008 |
| [12] | Coomans de Brachène A, Demoulin JB. FOXO transcription factors in cancer development and therapy[J]. Cell Mol Life Sci, 2016, 73 (6): 1159–1172. DOI:10.1007/s00018-015-2112-y |
| [13] | Koenig MN, Naik E, Rohrbeck L, et al. Pro-apoptotic BIM is an essential initiator of physiological endothelial cell death independent of regulation by FOXO3[J]. Cell Death Differ, 2014, 21 (11): 1687–1695. DOI:10.1038/cdd.2014.90 |
| [14] | Gilley J, Coffer PJ, Ham J. FOXO transcription factors directly activate bim gene expression and promote apoptosis in sympathetic neurons[J]. J Cell Biol, 2003, 162 (4): 613–622. DOI:10.1083/jcb.200303026 |
 2017, Vol. 19
2017, Vol. 19


