2. 陕西省人民医院妇产科, 陕西 西安 710068
铅是严重影响胃肠功能的有毒重金属[1],婴幼儿胃平滑肌及肠黏膜肌层发育尚未完善,屏障功能差等因素决定了其胃肠道对铅中毒的高度易感性和临床表现的严重性。尽管铅中毒也可导致儿童出现各种胃肠道反应,但反复腹痛的性质和部位常不如成人“铅绞痛”[2-3]那样典型。近年来儿童铅中毒的主要方式发生了变化[4],控制消化道和呼吸道的铅接触可有效降低出生后儿童铅中毒的发生。但经胎盘途径染铅是儿童出生前难以避免的特异性铅暴露形式[5-6],其对生后婴幼儿胃肠功能影响的特点尚不清楚。因此,观察胚胎期铅中毒对发育期胃肠功能的影响及可能机制具有重要的意义。
1 材料与方法 1.1 实验动物遗传背景一致的SPF级雌性Sprague-Dawley(SD)大鼠18只,由西安交通大学医学院实验动物中心提供,体重为240~260 g,每6只来源于同一窝,每次每窝随机抽取2只均分为正常对照组、低剂量铅暴露组及高剂量铅暴露组,每组最终雌性SD大鼠为6只。
1.2 大鼠胚胎期铅暴露模型的建立参考文献方法[7]建立胚胎期铅暴露模型。将各组雌鼠与同一成年雄鼠依次按2:1合笼配对,雌鼠阴道分泌物涂片内发现雄鼠精子则证实交配成功,并记录为雌鼠受孕的第0天。从受孕第0天开始,低剂量铅暴露组、高剂量铅暴露组母鼠分别自由饮用0.1%、0.2%醋酸铅三蒸水溶液至仔鼠娩出为止,而正常对照组母鼠整个孕期饮用三蒸水。仔鼠娩出后,铅暴露组母鼠改饮三蒸水。仔鼠出生后第42~49天,各组随机选取10只雄性仔鼠,单笼饲养,观察每日摄食量变化;第50天观察粪便性状变化特点。随后各组随机选取8只雄性仔鼠制作电镜标本,观察肠绒毛及肠上皮细胞间连接的超微结构变化。各组随机另选取8只雄性仔鼠进行免疫组化实验,观察胆囊收缩素-8(cholecystokinin-8, CCK-8)、胃动素(motilin, MTL)阳性细胞在摄食中枢—下丘脑外侧区(lateral hypothalamic area, LHA)的表达。第60天,各组随机选取10只雄性仔鼠测定胃排空及小肠推进功能;实验结束后采用苏木精-伊红染色观察胃黏膜组织炎性细胞浸润情况。
1.3 每日摄食量测定每日上午8:00~9:00测量仔鼠体重后,准确称量30 g标准饲料并投放,第2天同时间段再次测量体重、投放同量饲料,并定时更换,连续7 d,记录每只仔鼠每天每100 g体重的平均摄食量。
1.4 粪便性状观测仔鼠出生后第50天,夜间23:00~0:00收集大鼠1 h排出粪便,计数粪便粒数,按分级标准[8]计算各组仔鼠粪便性状级别平均得分。每组大鼠粪便连同滤纸收集,经37℃暖箱过夜充分烘干,烘干前后应用电子天平分别准确称重,计算每克粪便的平均含水量(g)。上述实验完成后,各组仔鼠恢复正常饲养条件,自由进食及饮水,记录24 h粪便粒数,完全烘干称重,计数每粒粪便平均重量,间接反映粪便的大小。
1.5 胃排空及小肠推进能力测定用于检测胃排空及小肠推进功能的糊状混合物按参考文献[9]制作并实施,胃排空率= [1-(胃全质量-胃净质量)/灌胃量]×100%。同时迅速取出小肠,轻轻剥离后直铺于白纸上,测量从幽门至小肠内黑色糊状物前沿的推进长度及幽门至回盲部的全小肠长度,以此推进长度占小肠全长的百分率为小肠推进率,即:小肠推进率=推进长度/小肠全长×100%。
1.6 苏木精-伊红染色观察胃黏膜炎性细胞浸润常规制作胃黏膜石蜡切片并进行苏木精-伊红(HE)染色。每只大鼠任取3张组织切片,400倍光镜下每张切片随机选择5个视野,依文献方法[10]半定量检测炎性细胞浸润情况并计数不同程度炎性细胞浸润的视野数。炎性细胞浸润程度分级:(1)轻度:炎性细胞较少,并局限于黏膜浅层,不超过黏膜层的1/3;(2)中度:炎性细胞浸入黏膜全层的2/3,数量较多;(3)重度:炎性细胞密集,浸入黏膜全层或肌层。
1.7 透射电镜观察空肠微绒毛及细胞连接常规制作透射电镜空肠标本并观察:(1)空肠微绒毛超微形态学:15 000倍电镜视野下,每只大鼠随机选取3张组织切片,每张切片任选5个肠微绒毛纵向排列且计数清晰可辨的视野,记录1 μm长度单位内完整肠微绒毛的数目;按随机起始,每间隔10个选取1个的方式选取5个完整肠微绒毛,测量其长度并计算平均值。(2)空肠黏膜层上皮细胞间连接的超微结构变化:30 000倍电镜视野下,每只大鼠随机选取3张组织切片,每张切片任选5个观察视野,计数2 μm×3 μm范围内桥粒的数目;每视野任选3个结构完整、清晰可辨的桥粒,应用多点平均法测量桥粒致密斑的间隙。
1.8 免疫组化检测摄食中枢MTL、CCK-8表达常规制作脑组织石蜡切片,并按MTL、CCK-8试剂盒(北京博奥森生物科技有限公司)说明书进行免疫组化实验。每只大鼠任取上述MTL、CCK-8免疫组化切片3张,400倍光镜下每张切片任选5个观察视野,计数MTL、CCK-8阳性细胞的平均数目。
1.9 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x± s)表示,多组间比较采用单因素方差分析,进一步组间两两比较采用SNK-q检验;计数资料采用百分率(%)表示,多组间比较采用Kruskal-Wallis H检验,进一步组间两两比较采用Mann-Whitney U检验。P < 0.05为差异有统计学意义。
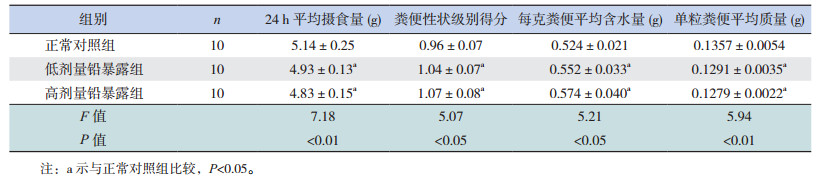
2 结果 2.1 各组仔鼠每日平均摄食量的变化各组雄性仔鼠每24 h的平均摄食量比较差异有统计学意义(P < 0.01)。进一步组间两两比较,高、低剂量铅暴露组24 h平均摄食量均较正常对照组降低(P < 0.05),而高、低剂量铅暴露组间24 h平均摄食量比较差异无统计学意义(P > 0.05)。提示胚胎期铅暴露可导致子代大鼠摄食量减少,但摄食量减少程度与铅暴露剂量之间无剂量-效应关系。见表 1。
| 表 1 各组雄性仔鼠每24 h摄食量及粪便性状变化比较(x± s) |
2.2 各组仔鼠粪便性状的变化
各组雄性仔鼠的粪便性状级别得分、每克粪便平均含水量、单粒粪便平均质量等指标比较差异有统计学意义(P < 0.05)。进一步组间两两比较,高、低剂量铅暴露组粪便性状级别得分和每克粪便平均含水量均高于正常对照组(P < 0.05),单粒粪便平均质量均低于正常对照组(P < 0.05);而上述检测指标在高、低剂量铅暴露组间比较差异无统计学意义(P > 0.05)。提示胚胎期铅暴露可导致仔鼠粪便含水量增加,单粒粪便平均质量减少,但其变化程度与铅暴露剂量之间无剂量-效应关系。见表 1。
2.3 各组仔鼠胃排空率的变化正常对照组、低剂量铅暴露组和高剂量铅暴露组雄性仔鼠的平均胃排空率分别为38.8%±2.4%、37.0%±1.8%、35.7%±1.6%,3组间比较差异有统计学意义(P < 0.01)。进一步组间两两比较,高剂量铅暴露组平均胃排空率低于正常对照组(P < 0.01);而低剂量铅暴露组与正常对照组间,以及高、低剂量铅暴露组间平均胃排空率比较差异无统计学意义(P > 0.05)。提示胚胎期铅暴露可导致仔鼠胃排空能力下降,但其下降程度与铅暴露剂量之间无剂量-效应关系。
2.4 各组仔鼠小肠推进能力的变化正常对照组、低剂量铅暴露组、高剂量铅暴露组雄性仔鼠平均小肠推进率分别为55.9%±2.6%、58.7%±2.9%、60.1%±2.5%,3组间比较差异有统计学意义(P < 0.01)。进一步组间两两比较,高、低剂量铅暴露组平均小肠推进率均高于正常对照组(P < 0.01);而高、低剂量铅暴露组间比较差异无统计学意义(P > 0.05)。提示胚胎期铅暴露可导致仔鼠小肠推进速度加快,但加快的程度与铅暴露剂量之间无剂量-效应关系。
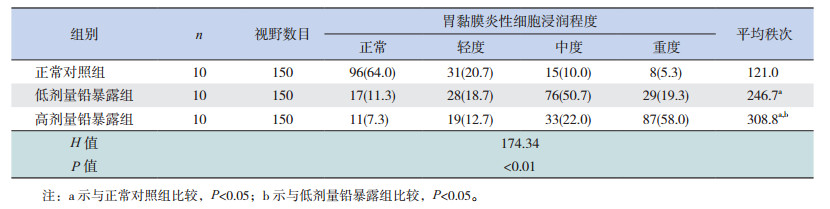
2.5 各组仔鼠胃黏膜炎性细胞浸润情况各组雄性仔鼠胃黏膜细胞浸润程度分级比较差异有统计学意义(H=174.34,P < 0.01)。进一步组间两两比较,高剂量铅暴露组胃黏膜炎性细胞浸润程度重于正常对照组和低剂量铅暴露组(P < 0.05);低剂量铅暴露组胃黏膜炎性细胞浸润程度重于正常对照组(P < 0.05)。正常对照组、低剂量铅暴露组、高剂量铅暴露组胃黏膜炎性细胞浸润的严重程度依次加重,提示胚胎期铅暴露可导致仔鼠胃黏膜出现病理炎症反应,炎性细胞浸润的程度与铅暴露剂量之间存在剂量-效应关系。见表 2。
| 表 2 各组雄性仔鼠胃黏膜炎性细胞浸润程度与频数分布[ n(%)] |
2.6 各组仔鼠空肠黏膜微绒毛超微结构的变化
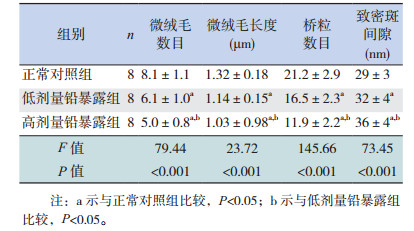
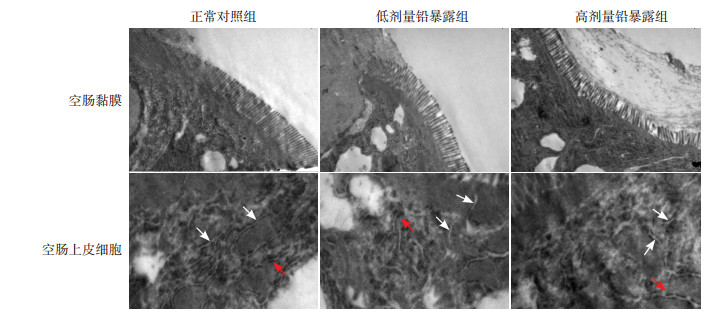
各组每1 μm肠壁纵行长度单位内微绒毛的平均数目及长度比较差异有统计学意义(P < 0.01)。进一步组间两两比较,高、低剂量铅暴露组微绒毛平均数目及长度均较正常对照组减少(P < 0.05);且高剂量铅暴露组微绒毛平均数目及长度均较低剂量铅暴露组减少(P < 0.05)。提示胚胎期铅暴露使仔鼠空肠黏膜微绒毛出现数目减少以及长度缩短等病理超微结构变化,其变化程度与铅暴露剂量间存在剂量-效应关系。见表 3,图 1。
| 表 3 各组雄性仔鼠空肠黏膜微绒毛及上皮细胞间连接的超微结构变化比较(x± s) |
|
图 1 各组仔鼠空肠黏膜微绒毛(×15 000)及上皮细胞间桥粒连接(×30 000)超微结构变化 正常对照组空肠黏膜微绒毛较长,密集分布,排列规整,间隙匀称;低剂量铅暴露组空肠黏膜微绒毛长度缩短,数目有所减少,密集程度下降,相邻微绒毛之间间隙欠匀称;高剂量铅暴露组空肠黏膜微绒毛长度明显缩短,数目显著减少,分布、排列及间隙等出现严重紊乱。正常对照组空肠上皮细胞间桥粒(白色箭头)数目较多,排列规整,致密斑(红色箭头)间隙大小适中;低剂量铅暴露组空肠上皮细胞间桥粒数目减少,排列欠规整,致密斑间隙增宽;高剂量铅暴露组空肠上皮细胞间桥粒数目显著减少,排列紊乱,致密斑间隙显著增大。 |
2.7 各组仔鼠空肠上皮细胞间连接的超微结构变化
各组仔鼠空肠组织切片2 μm×3 μm范围观察区域内空肠上皮细胞间桥粒连接的平均数目及致密斑平均间隙比较差异有统计学意义(P < 0.01)。进一步组间两两比较,高、低剂量铅暴露组空肠上皮细胞间桥粒连接平均数目少于正常对照组(P < 0.01),致密斑平均间隙宽于正常对照组(P < 0.01);高剂量铅暴露组空肠上皮细胞间桥粒连接平均数目少于低剂量铅暴露组(P < 0.01),致密斑平均间隙宽于低剂量铅暴露组(P < 0.01)。结果提示胚胎期铅暴露可导致仔鼠空肠上皮细胞间桥粒数目减少且致密斑间隙异常扩大,上述改变的程度与铅暴露剂量间有剂量-效应关系。见表 3,图 1。
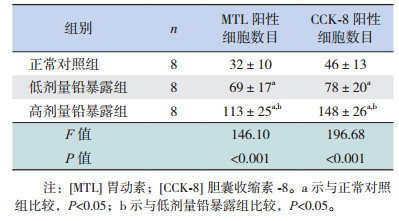
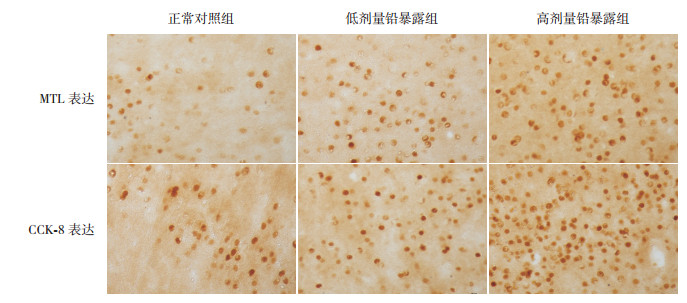
2.8 各组仔鼠摄食中枢MTL及CCK-8表达的变化光镜下,仔鼠摄食中枢LHA MTL及CCK-8免疫阳性物质呈棕黄色至深棕色,细颗粒状,主要沉积于细胞浆内。各组仔鼠LHA MTL、CCK-8免疫阳性细胞平均数目比较差异均有统计学意义(P < 0.01)。进一步组间两两比较,高、低剂量铅暴露组MTL、CCK-8免疫阳性细胞平均数目均较正常对照组增加(P < 0.01);高剂量铅暴露组MTL、CCK-8免疫阳性细胞平均数目多于低剂量铅暴露组(P < 0.01)。上述结果提示胚胎期铅暴露可导致仔鼠摄食中枢MTL、CCK-8表达增加,其增加的程度与铅暴露剂量之间有一定的剂量-效应关系。见表 4,图 2。
| 表 4 各组雄性仔鼠摄食中枢MTL及CCK-8的表达比较(x± s) |
|
图 2 各组仔鼠摄食中枢MTL及CCK-8的表达(免疫组化,×400) MTL及CCK-8免疫阳性物质呈棕黄色至深棕色,细颗粒状,主要沉积于细胞浆内。正常对照组、低剂量铅暴露组、高剂量铅暴露组MTL及CCK-8免疫阳性细胞数目依次增多。 |
3 讨论
本研究发现胚胎期铅暴露可导致摄食、排便异常,仔鼠每天摄食量显著减少,粪便含水量明显增加而单粒粪便的体积减小。同时发现胚胎期铅暴露仔鼠胃黏膜出现明显的病理炎性反应,仔鼠空肠上的微绒毛数目明显减少、长度短缩及肠上皮间桥粒连接的数目减少、桥粒致密斑间隙异常扩大。
胃黏膜的炎性反应与临床上急性浅表性胃炎患者的局部病理反应相类似,因而胚胎期铅暴露仔鼠出现的摄食减少与胃黏膜局部损伤导致的食欲不振有一定关联。空肠上皮保持一定密度和数量的微绒毛是水分和营养素得以吸收的重要结构基础。微绒毛数目减少或长度缩短,使有效吸收面积显著下降,附着于微绒毛上负责钠转运的载体减少,肠壁上无吸收作用的“裸露”区相应增多,肠腔内水、电解质的回吸收障碍;另一方面,受损微绒毛处肠黏膜细胞分泌双糖酶减少,使食物中糖类物质消化不全而滞留肠腔,导致肠腔内渗透压增高,进一步加重肠上皮回吸收水分的难度,最终导致粪便中水分含量增加。此外,微绒毛受损造成的消化吸收不良也可反馈性的抑制食欲,出现摄食量下降。桥粒连接[11]是肠上皮细胞间重要的一种细胞连接形式,对维系肠黏膜局部正常的形态和结构、抵抗一定强度的机械性压力及张力、协调临近细胞间的生理功能以及保障细胞间信息的传递具有重要作用。桥粒连接的数目以及桥粒结构中致密斑间隙保持相对稳定对维持上述功能极其重要[12],如果这些参数在有害因素的刺激下发生了异常变化,肠黏膜正常的消化、吸收及运动功能将受到损害。
本研究发现的仔鼠粪便体积缩小及含水量增多与临床上成人铅中毒患者出现大便秘结的情况不一致。主要原因除了上述微绒毛及桥粒连接的病理超微结构改变外,可能还包括:(1)发育期人或动物胃肠黏膜及平滑肌尚不成熟、大脑皮层参与的胃-结肠反射相对较强[13]。如在临床上,正常婴幼儿大便为含水量较多的、不成形的糊状便,排便次数为4~5次/d左右;而正常成人粪便为成形软便,排便次数为1~2 d 1次至每日1~2次。(2)与铅暴露的途径不同有关。本研究铅元素是通过胎盘垂直转移至胚胎体内,而日常生活中铅进入人体的主要途径为消化道和呼吸道。尤其是铅经过消化道途径进入体内时,铅元素直接作用于胃肠黏膜,对消化道造成的腐蚀性损伤及组织蛋白变性会更严重,对胃肠动力的影响也更明显。
CCK是人类认识的第3个胃肠激素。在大多数哺乳类动物中,CCK的C-末端氨基酸序列为“天门冬-酪-甲硫-甘-色-甲硫-天门冬-苯丙-NH2”的硫化八肽结构(CCK8),因而CCK8被认为是具有CCK全部生物活性的最小分子形式。CCK是强烈促进胆囊收缩的最主要的胃肠激素,进食后促进胆囊收缩并松弛Oddi括约肌,胆汁排出后胆囊体积缩小[14],CCK已经被证实是一种“饱因子”[15-16],使人和动物产生饱腹感而明显抑制摄食。CCK对胃肠运动的主要作用包括引起胃底、胃体松弛而抑制胃排空,增强小肠和结肠运动[17-18]。Blevins等[19]的研究证实,CCK可以通过脑部的相关功能区域抑制摄食,表明了CCK可通过中枢途径对摄食行为进行调节。Staljanssens等[20]及Stengel等[21]的研究结果证实CCK可以作用于摄食中枢,导致饱胀感。而本研究中还发现胚胎期铅暴露仔鼠摄食中枢LHA CCK-8表达增加。因此,胚胎期铅暴露仔鼠摄食中枢CCK-8表达增加可能是摄食量下降、食欲减低的重要原因。
MTL是由Mo细胞分泌的,在空腹状态或消化间期,MTL的分泌呈周期性,人和狗的MTL大约每间隔1~2 h释放1次,而且血MTL水平随消化间期移行性复合运动(interdigestive migrating motor complex, IMMC)的时相而变化,在胃、十二指肠Ⅱ相末及Ⅲ相期达到高峰。MTL与广泛分布于消化系统及其他系统[22]中的MTL受体特异结合,发挥各种生理学功能[23]。MTL对外周消化系统有加快胃排空,促进摄食、消化和吸收的作用。MTL通过促进胃收缩,加快小肠和结肠的运动,对消化腔内容物起清扫作用;此外,MTL对胃肠IMMC Ⅲ期的发生起着至关重要的作用,从而激活摄食中枢, 促进食欲和摄食活动。而摄食中枢LHA MTL表达增加的意义尚不明确,而且相似研究不多。因此,推测MTL在摄食中枢的过度表达变化可能是机体为促进食欲而出现的一种代偿性反应。
| [1] | Assi MA, Hezmee MN, Haron AW, et al. The detrimental effects of lead on human and animal health[J]. Vet World, 2016, 9 (6): 660–671. DOI:10.14202/vetworld. |
| [2] | Mongolu S, Sharp P. Acute abdominal pain and constipation due to lead poisoning[J]. Acute Med, 2013, 12 (4): 224–226. |
| [3] | Vossoughinia H, Pourakbar A, Esfandiari S, et al. Severe abdominal pain caused by lead toxicity without response to oral chelators:a case report[J]. Middle East J Dig Dis, 2016, 8 (1): 67–72. |
| [4] | Rosner D. A lead poisoning crisis enters its second century[J]. Health Aff (Millwood), 2016, 35 (5): 756–759. DOI:10.1377/hlthaff.2016.0362 |
| [5] | Alba A, Carleton L, Dinkel L, et al. Increased lead levels in pregnancy among immigrant women[J]. J Midwifery Womens Health, 2012, 57 (5): 509–514. DOI:10.1111/jmwh.2012.57.issue-5 |
| [6] | Mazumdar I, Goswami K. Congenital lead poisoning:an unusual presentation[J]. Indian J Clin Biochem, 2014, 29 (2): 257–259. DOI:10.1007/s12291-013-0374-4 |
| [7] | 周戬平, 王帆, 杨玉凤, 等. 孕期铅暴露对子代大鼠情感行为及学习记忆变化的实验研究[J]. 中国儿童保健杂志, 2012, 20 (2): 135–138. |
| [8] | 费晓燕, 谢建群, 郑昱, 等. 疏肝饮对腹泻型肠易激综合征模型大鼠胃动素和胆囊收缩素的影响[J]. 上海中医药杂志, 2008, 42 (4): 63–65. |
| [9] | 陈苏宁, 梁靓靓, 史业东. 胃痛消痞方对脾胃虚寒型功能性消化不良大鼠胃肠动力和胃动素的影响[J]. 世界华人消化杂志, 2010, 18 (7): 699–702. |
| [10] | 姚萍, 高鸿亮, 刘发. 荜茇根对胆汁反流胃炎大鼠模型的防治作用及对胃泌素、PGE2、TNF-α、IL-8含量的影响[J]. 中药药理与临床, 2012, 28 (1): 111–114. |
| [11] | Stahley SN, Kowalczyk AP. Desmosomes in acquired disease[J]. Cell Tissue Res, 2015, 360 (3): 439–456. DOI:10.1007/s00441-015-2155-2 |
| [12] | Broussard JA, Getsios S, Green KJ. Desmosome regulation and signaling in disease[J]. Cell Tissue Res, 2015, 360 (3): 501–512. DOI:10.1007/s00441-015-2136-5 |
| [13] | 孙梅. 消化系统疾病[M]//薛辛东. 儿科学. 第2版. 北京: 人民卫生出版社, 2011, 235-236. |
| [14] | Zhang ZH, Qin CK, Wu SD, et al. Roles of sphincter of Oddi motility and serum vasoactive intestinal peptide, gastrin and cholecystokinin octapeptide[J]. World J Gastroenterol, 2014, 20 (16): 4730–4736. DOI:10.3748/wjg.v20.i16.4730 |
| [15] | Alén F, Ramírez-López MT, Gómez de Heras R, et al. Cannabinoid receptors and cholecystokinin in feeding inhibition[J]. Vitam Horm, 2013, 92 : 165–196. DOI:10.1016/B978-0-12-410473-0.00007-6 |
| [16] | Sobrino Crespo C, Perianes Cachero A, Puebla Jiménez L. Peptides and food intake[J]. Front Endocrinol (Lausanne), 2014, 5 : 58. |
| [17] | Dockray GJ. Cholecystokinin[J]. Curr Opin Endocrinol Diabetes Obes, 2012, 19 (1): 8–12. DOI:10.1097/MED.0b013e32834eb77d |
| [18] | Gamble J, Kenny S, Dockray GJ. Plasminogen activator inhibitor (PAI)-1 suppresses inhibition of gastric emptying by cholecystokinin (CCK) in mice[J]. Regul Pept, 2013, 185 : 9–13. DOI:10.1016/j.regpep.2013.06.005 |
| [19] | Blevins JE, Stanley BG, Reidelberger RD. Brain regions where cholecystokinin suppresses feeding in rats[J]. Brain Res, 2000, 860 (1-2): 1–10. DOI:10.1016/S0006-8993(99)02477-4 |
| [20] | Staljanssens D, Azari EK, Christiaens O, et al. The CCK (-like) receptor in the animal kingdom:functions, evolution and structures[J]. Peptides, 2011, 32 (3): 607–619. DOI:10.1016/j.peptides.2010.11.025 |
| [21] | Stengel A, Taché Y. Interaction between gastric and upper small intestinal hormones in the regulation of hunger and satiety:ghrelin and cholecystokinin take the central stage[J]. Curr Protein Pept Sci, 2011, 12 (4): 293–304. DOI:10.2174/138920311795906673 |
| [22] | Dockray GJ. Gastrointestinal hormones and the dialogue between gut and brain[J]. J Physiol, 2014, 592 (14): 2927–2941. DOI:10.1113/jphysiol.2014.270850 |
| [23] | Mondal A, Xie Z, Miyano Y, et al. Coordination of motilin and ghrelin regulates the migrating motor complex of gastrointestinal motility in Suncus murinus[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302 (10): G1207–G1215. DOI:10.1152/ajpgi.00379.2011 |
 2017, Vol. 19
2017, Vol. 19