2. 吉林大学第一医院发育行为儿科,吉林 长春 130021;
3. 长春市绿园区医院儿科,吉林 长春 130000
患儿,男,11个月,因左侧肢体抽搐4 h入院。入院4 h前患儿无明显诱因出现左侧肢体持续抖动,无颜面青紫,无意识障碍。近期无发热、呕吐等。出生史正常。患儿3个月会抬头,6个月会独坐,8个月会爬。父母非近亲结婚。患儿姐姐10月龄起病,表现为持续性部分性癫癎、伴肝功能酶学升高,脑电图提示多灶起源的部分性发作;先后应用托吡酯、奥卡西平、丙戊酸镁、拉莫三嗪、氯硝西泮等治疗,抽搐无明显缓解,并逐渐出现黄疸、肝功能酶学异常加重和高乳酸血症( > 15 mmol/L),起病4个月后死亡。
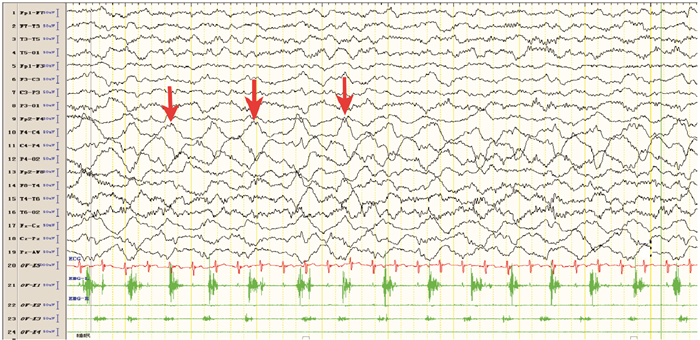
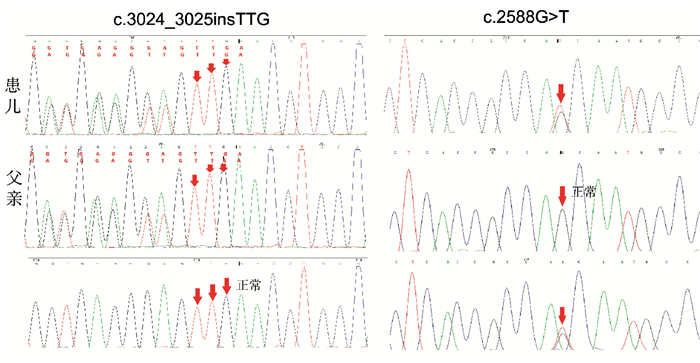
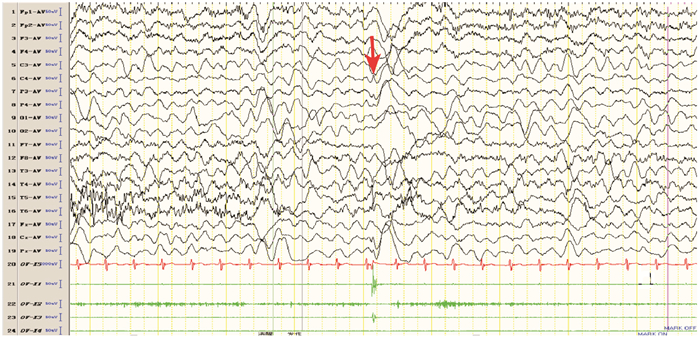
入院查体:发育正常、营养中等,神志清楚,左侧肢体持续抖动,双侧瞳孔等大同圆、对光反射迟钝,双肺呼吸音粗,心率130次/min、律齐、无杂音,腹软,肝脾肋下未触及,左侧肢体肌力因持续抖动无法评估,右侧肢体肌力、肌张力正常,无颈项强直,双侧膝健反射正常,双侧巴氏征阳性。辅助检查:血常规白细胞11.4×109/L,余项正常;乳酸3 mmol/L(参考值0~2 mmol/L);血电解质、血糖正常;肝功能:门冬氨酸氨基转移酶135U/L(参考值15~40 U/L),丙氨酸氨基转移酶155 U/L(参考值9~50 U/L),α-羟丁酸脱氢酶221 U/L(参考值78~182 U/L);脑脊液:蛋白0.47 g/L,潘氏反应+,余项正常。头部MRI:表观弥散系数成像可见双侧尾状核头部对称性低信号。视频脑电图(图 1)监测到左侧肢体节律或非节律性频繁肌阵挛发作,或右侧Rolandic区起始的部分性发作持续状态,表现为弥漫性δ波为主的慢波,以前头部及后头部为著;右侧Rolandic区慢波或夹杂(多)棘波尖波,或(多)棘慢波接近持续发放。血串联质谱、尿有机酸、氨基酸筛查均未见异常。患儿线粒体疾病基因筛查发现POLG(polymerase-gama)基因复合杂合核苷酸突变:c.3024_3025insTTG(编码区第3024_3025号核苷酸间插入TTG)和c.2588G > T(编码区第2 588号核苷酸由G变为T),其父母均携带其中一个杂合突变(患儿父母表型正常,姐姐为患者),见图 2。入院后临床诊断为癫癎、局灶性发作、癫癎持续状态、持续性部分性癫癎、Alpers-Huttenlocher综合征,予咪达唑仑持续泵入、先后予以托吡酯、奥卡西平口服抗癫癎治疗,以及磷酸肌酸、左卡尼汀、维生素B1、维生素C、辅酶Q10、三磷酸腺苷等对症治疗。目前患儿病程已2个月,不能翻身、独坐,反应淡漠,时有烦躁,仍有左侧肢体间断抖动,左侧肢体肌力3级、肌张力略低;复查肝功能:门冬氨酸氨基转移酶173.8 U/L,丙氨酸氨基转移酶114.1 U/L,与入院相比无明显变化;复查脑电图(图 3):监测到清醒期为主的多次左侧上肢或左侧肢体肌阵挛发作,脑电背景活动慢化,双侧Rolandic区或后头部为主的慢波、棘慢波发放。
|
图 1 治疗前癫癎发作期脑电图 治疗前表现为持续性部分性癫癎发作。箭头所指为发作期C4导联连续性δ波发放。 |
|
图 2 POLG基因分析 患儿线粒体疾病基因筛查发现POLG基因复合杂合核苷酸突变:c.3024_3025insTTG(编码区第3024_3025号核苷酸间插入TTG),c.2588G > T(编码区第2588号核苷酸由G变为T);患儿父亲存在c.3024_3025insTTG杂合突变,患儿母亲存在c.2588G > T杂合核苷酸突变。突变位点如箭头所示。 |
|
图 3 治疗2个月后癫癎发作期脑电图 治疗2个月后表现为左上肢局灶性肌阵挛发作。箭头所指为发作期C4导联棘波。 |
讨论:Alpers-Huttenlocher综合征(又称Alpers综合征)为一种常染色体隐性遗传的肝脑综合征,其典型的临床特征为难治性癫癎及进行性肝功能异常,尤其是应用丙戊酸后可能发生急性肝衰竭、皮质盲和精神运动倒退;发病年龄为1个月至25岁,以婴幼儿常见,多在3岁内死亡[1-2]。
Alpers于1931年报道1例生长发育正常的3个月女孩,出现难治性癫癎,进展迅速,1个月内出现深度昏迷,直至死亡;脑组织病理检查发现大脑灰质广泛的神经元细胞脱失,这是关于Alpers-Huttenlocher综合征的早期描述[3]。1976年,Huttenlocher等[4-5]描述了本病肝病方面的特征,进一步确认了本病遗传方式为常染色体隐性遗传。1990年,Harding等[1]报道32例肝病合并脑病的病人,系统阐述了本病的典型临床过程—早期发育正常,逐渐出现发育迟缓,体重增长困难,发作性呕吐,肌张力降低。抽搐可以是首发症状,其他临床症状在抽搐出现后一般会迅速进展;肝脏受累时间差异较大,可能先于抽搐出现,也有些出现在疾病终末期。大脑皮层的病理表现多样,包括海绵层水肿、神经元缺失、星型胶质细胞细胞增生等,但多数累及距状裂皮质,进一步进展累及整个大脑皮层[2]。
Ropp和Copeland等[6]于1996年成功克隆了POLG基因,并阐述了POLG基因的特性。有关POLG相关疾病的研究开启了人们对线粒体—核基因相互关联疾病的认识。Naviaux等[7] 1999年发现,POLG酶活性降低可导致线粒体DNA耗竭,从而建立了Alpers-Huttenlocher综合征与POLG基因生化、酶学方面的关联。Naviaux和Nguyen在2004年描述了POLG基因突变导致的Alpers-Huttenlocher综合征,从而建立了基因型—表型之间的联系,明确了Alpers-Huttenlocher综合征是由基因异常导致的酶学变化,从而使线粒体DNA减少引发线粒体DNA耗竭综合征[8]。
POLG基因位于15q25,编码线粒体DNA多聚酶,该蛋白在线粒体DNA复制与修复中起重要作用,已发现大约200余种POLG基因突变[9]。Alpers综合征常见的POLG基因突变为A467T,占突变等位基因的40%,其次为W748S、G848S和T914P,其余突变检出率很低[10-11]。本文涉及的两处突变的致病性均尚未见文献报道(参考数据库:HGMD Pro及PubMed),不属于多态性变化,在人群中发生的频率极低(参考数据库:1000Genomes、dbSNP)。POLG蛋白结构可分为3个区域:3'-5'核酸外切酶区域、连接区及DNA聚合酶区域,而DNA聚合酶区域是POLG的主要活性区域[9]。本文涉及的两个突变均位于DNA聚合酶区域,突变的核苷酸均引起了氨基酸序列的改变,其中c.2588G > T导致第863号氨基酸由Ser变为Ile(p.Ser863Ile)。丝氨酸通常为蛋白质磷酸化修饰的位点,改变后对蛋白质功能影响较大[12]。另一个突变c.3024_3025insTTG,导致第1008与1009号氨基酸间插入Leu。新插入的Leu为中性氨基酸,而原来此位置的Asp为酸性氨基酸,两种氨基酸性质不同。用polyphen软件对该患儿两处突变进行蛋白功能预测,显示为“可能致病的”;另外通过对黑猩猩、小鼠、大鼠、蟾蜍和人类多重序列进行比对分析,发现黑猩猩、小鼠、大鼠、蟾蜍和人类在这两个位点均分别编码Ser和Asp,说明这两个位点处于进化高度保守区域,此位置突变对POLG蛋白影响大。而有研究表明,POLG基因作为Alpers-Huttenlocher综合征、进行性眼外肌麻痹、共济失调神经病等的致病基因,复合杂合突变可以导致发病[9]。因此推测患儿的这两个突变也可能致病。
Alpers-Huttenlocher综合征的诊断标准[8]:(1)临床表现为难治性癫癎、精神、运动倒退和肝病;(2)没有肝病表现者,进一步诊断需依靠POLG基因测序、或肝活检、尸检或其它表现;(3)其他表现包括(须符合11条中的2条):①颅脑磁共振波普分析提示N-乙酰天门冬氨酸降低、肌酸正常、乳酸升高;②脑脊液蛋白升高;③头部磁共振或CT扫描提示脑容积减少;④至少一次脑电图提示多灶起源的高波幅慢波、棘波/多棘波活动;⑤皮层盲或视神经萎缩;⑥视觉诱发电位异常,而视网膜电流图正常;⑦骨骼肌或肝脏线粒体DNA耗竭;⑧骨骼肌或肝脏聚合酶-γ活性缺陷;⑨除外急性肝衰竭的情况,至少1次血或脑脊液的乳酸升高( > 3 mmol/L);⑩肝细胞呼吸链测定实验提示单独电子传递链复合物Ⅳ缺陷,或复合物Ⅰ、Ⅲ、Ⅳ联合缺陷;⑪家族中有1个同胞被诊断为Alpers-Huttenlocher综合征。
本例患儿以持续性部分性癫癎起病,11月龄起病,表现为精神、运动倒退,血乳酸升高,肝功能酶学升高,脑脊液蛋白轻度升高,基因检测发现POLG基因的复合杂合突变。患儿姐姐10月龄起病,同样表现为持续性部分性癫癎,多种药物联合治疗,抽搐难以控制,脑电图提示多灶起源的部分性发作,肝功酶学升高,应用丙戊酸后出现黄疸、肝功能异常加重、持续高乳酸血症,起病4个月后死亡。根据诊断标准[8],患儿及其姐姐均可诊断为Alpers-Huttenlocher综合征。
丙戊酸可诱发肝衰竭为Alpers-Huttenlocher综合征特点之一,机制尚不完全明确。有学者对于患Alpers-Hutternlocher综合征的同胞进行观察,使用丙戊酸的患儿很快出现肝衰竭,未使用丙戊酸的患儿死于癫癎持续状态,但二者尸检均显示肝脏结节形成,认为肝硬化和肝衰竭可能为本病的病理表现之一,而与药物关系并不密切,但丙戊酸可能加速这一进程[13]。最近有研究报道,丙戊酸导致本病患者发生肝衰竭可能与线粒体膜通透性转运孔(mitochondrial permeability transition pore, mPTP)开放有关,应用环孢素A(mPTP抑制剂)能够挽救丙戊酸所致的这种凋亡效应[14]。本例患儿的姐姐在丙戊酸治疗1个月后出现黄疸、肝功能损害加重,起病后4个月死亡;而本例患儿起病方式与其姐姐极其相似,但在病情早期得以诊断,给予左卡尼汀等支持治疗,同时避免使用丙戊酸,目前病程已2个月,抽搐较前略有好转。
迄今为止,尚无有效手段阻止Alpers-Hutternlocher综合征进展。一种新的临床药物EPI-743(对苯醌类似物,一种抗氧化剂)正在临床观察中,或许能给本病患者带来希望[15]。还有研究提示,在疾病的足够早期开始运动练习能够延缓进展[16]。另外,mPTP的抑制剂虽然只限于细胞模型研究,也使人们看到了本病治疗的一点希望。
Alpers-Huttenlocher综合征的分子-临床-生化方面的研究已有10余年历史,发现基因及环境因素对该疾病有影响,但关于基因变化如何影响表型,如何找到有效的治疗方法,还有大量工作要做。
志谢: 感谢上海诺华贸易有限公司在本研究病例资料收集中给予的支持。| [1] | Harding BN. Progressive neuronal degeneration of childhood with liver disease (Alpers-Huttenlocher syndrome):A personal review[J]. J Child Neurol, 1990, 5 (4): 273–287. DOI:10.1177/088307389000500402 |
| [2] | Egger J, Harding BN, Boyd SG, et al. Progressive neuronal degeneration of childhood (PNDC) with liver disease[J]. Clin Pediatr (Phila), 1987, 26 (4): 167–173. DOI:10.1177/000992288702600401 |
| [3] | Alpers BJ. Diffuse progressive degeneration of the gray matter of the cerebrum[J]. Arch Neurol Psychiatry, 1931, 25 (3): 469–505. DOI:10.1001/archneurpsyc.1931.02230030027002 |
| [4] | Huttenlocher PR, Solitare GB, Adams G. Infantile diffuse cerebral degeneration with hepatic cirrhosis[J]. Arch Neurol, 1976, 33 (3): 186–192. DOI:10.1001/archneur.1976.00500030042009 |
| [5] | Sandback U, Lerman P. Progressive cerebral poliodystrophy-Alpers' disease. Disorganized giant neuronal mitochondria on electron microscopy[J]. J Neurol Neurosurg Psychiatry, 1972, 35 (6): 749–755. DOI:10.1136/jnnp.35.6.749 |
| [6] | Ropp PA, Copeland WC. Cloning and characterization of the human mitochondrial DNA polymerase gamma[J]. Genomics, 1996, 36 (3): 449–458. DOI:10.1006/geno.1996.0490 |
| [7] | Naviaux RK, Nyhan WL, Barshop BA, et al. Mitochondrial DNA polymerase gamma deficiency and mtDNA depletion in a child with Alpers syndrome[J]. Ann Neurol, 1999, 45 (1): 54–58. DOI:10.1002/(ISSN)1531-8249 |
| [8] | Nguyen KV, Sharief FS, Chan SS, et al. Molecular diagnosis of Alpers syndrome[J]. J Hepatol, 2006, 45 (1): 108–116. DOI:10.1016/j.jhep.2005.12.026 |
| [9] | National Institute of Enviromental Health Sciences. Human DNA polymerase gamma mutation database[DB/OL].[2016-06-20].http://tools.niehs.nih.gov/polg/. |
| [10] | Naviaux RK, Nguyen KV. POLG mutations associated with Alpers syndrome and mitochondrial DNA depletion[J]. Ann Neurol, 2004, 55 (5): 706–712. DOI:10.1002/(ISSN)1531-8249 |
| [11] | Tzoulis C, Engelsen BA, Telstad W, et al. The spectrum of clinical disease caused by the A467T and W748S POLG mutations:A study of 26 eases[J]. Brain, 2006, 129 (Pt 7): 1685–1692. |
| [12] | 梁前进, 王鹏程, 白燕荣. 蛋白质磷酸化修饰研究进展[J]. 科技导报, 2012, 30 (31): 73–79. DOI:10.3981/j.issn.1000-7857.2012.31.010 |
| [13] | Schwabe MJ, Dobyns WB, Burke B, et al. Valproate-induced liver failure in one of two siblings with Alpers disease[J]. Pediatr Neurol, 1997, 16 (4): 337–343. DOI:10.1016/S0887-8994(97)00030-1 |
| [14] | Li S, Guo J, Yang Z, et al. Valproic acid-induced hepatotoxicity in Alpers syndrome is associated with mitochondrial permeability transition pore opening-dependent apoptotic sensitivity in an induced pluripotent stem cell model[J]. Hepatology, 2015, 61 (5): 1730–1739. DOI:10.1002/hep.27712 |
| [15] | Enns GM, Kinsman SL, Perlman SL, et al. Initial experience in the treatment of inherited mitochondrial disease with EPI-743[J]. Mol Genet Metab, 2012, 105 (1): 91–102. DOI:10.1016/j.ymgme.2011.10.009 |
| [16] | Safdar A, Bourgeois JM, Ogborn DI, et al. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice[J]. Proc Natl Acad Sci U S A, 2011, 108 (10): 4135–4140. DOI:10.1073/pnas.1019581108 |
 2017, Vol. 19
2017, Vol. 19
