2. 南京医科大学第一附属医院感染科, 江苏 南京 210029;
3. 安徽医科大学附属省立医院儿科,安徽 合肥 230001
1983年Moran等[1]报道第1例儿童非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD),此后有关儿童NAFLD的临床研究越来越引进广大临床医师的重视。近年来随着肥胖儿童的日益增多,本病的发病率也趋于低龄化并在肥胖儿童中呈流行趋势,当前NAFLD已成为最常见的儿童慢性肝病。NAFLD定义为与胰岛素抵抗及遗传易感性密切相关的获得性代谢应激性肝损伤,并以肝细胞内脂肪过度沉积为主要特征,且排除酒精和其他明确的损肝因素的临床病理综合征。NAFLD包括单纯性脂肪肝(non-alcoholic simple fatty liver, NAFL)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)。NAFL存在肝细胞气球样变但无肝细胞损伤,大多为非进展性,而NASH存在肝细胞损伤和与炎症相关的肝脂肪变性,可进展为肝纤维化甚至肝硬化[2]。早期发现NASH并予以及时有效的临床治疗,能够显著降低该部分患儿发展为脂肪性肝硬化的风险[3]。研究报道复方甘草酸苷片安全性好,口服治疗6个月可有效改善NAFLD成人患者的肝功能指标[4]。然而对于NAFLD儿童患者,复方甘草酸苷片能否减轻肝脏炎症以及抑制疾病进展,目前尚不可知。本文将探讨复方甘草酸苷片对比常规保肝药物护肝片治疗儿童NAFLD的疗效,现报告如下。
1 资料与方法 1.1 研究对象选取2014年6月至2016年5月南京医科大学第一附属医院和安徽医科大学附属省立医院儿科门诊患者为研究对象。参考NAFLD诊疗指南[5],制定以下入选标准:(1)腹部B超检查提示肝区回声弥漫性增强、肝内管道结构显示不清和肝远场回声逐渐衰减等弥漫性脂肪肝特征;(2)近6个月血清丙氨酶氨基转移酶(ALT)、γ-谷氨酰转肽酶(γ-GT)持续升高;(3)经各项检查及病史询问排除了病毒性肝炎、酒精性肝病、药物性肝病和自身免疫性肝病。
共65例符合以上标准的患儿入选,采用随机数字表法分为复方甘草酸苷片治疗组(简称复方甘草酸苷片组)和护肝片对照治疗组(简称护肝片组)。复方甘草酸苷片组33例,其中男25例、女8例,平均年龄10.4±2.8岁;护肝片组32例,其中男24例、女8例,平均年龄10.3±2.4岁。两组患儿的年龄、性别、ALT值、γ-GT值和肝脏B超指数相比较差异均无统计学意义(P > 0.05),以上临床资料及治疗前的症状和体征均具有可比性。本研究获得医院伦理委员会批准及家属书面知情同意。
1.2 治疗方法复方甘草酸苷片组给予复方甘草酸苷片(日本米诺发源制药株式会社研发,成分为甘草酸苷、甘草酸单铵盐、甘氨酸、蛋氨酸)口服,治疗剂量为每天3次、每次1片,饭后服用,疗程24周;护肝片组给予护肝片(黑龙江葵花药业股份有限公司,成分为柴胡、茵陈、板蓝根、五味子、猪胆粉、绿豆)口服,治疗剂量为每天3次、每次2片,饭后服用,疗程24周。
1.3 疗效判断治疗24周后,根据以下标准判断疗效。显效:ALT和γ-GT指标恢复正常,临床症状消失;有效:ALT和γ-GT指标较治疗前改善但未恢复正常,临床症状好转;无效:ALT和γ-GT指标较治疗前升高,临床症状未缓解或加重。显效+有效患儿所占比例为总有效率。
1.4 检验指标及方法治疗前及治疗24周后分别检测ALT、γ-GT和肝纤维血清四项指标。其中ALT、γ-GT由南京医科大学第一附属医院检验科使用全自动生化分析仪测定。透明质酸(HA)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(CⅣ)和层黏连蛋白(LN)采用上海海军医学研究所生物技术中心及重庆肿瘤研究所提供的试剂盒检测,由实验室专业人员用放射免疫分析法统一测定[6]。
1.5 肝脏B超检查采用TOSHIBA公司SSA-660A彩超对以上入组患儿治疗前及治疗24周后进行空腹肝脏B超检查,参照NAFLD诊疗指南(2006年版)进行轻、中、重度评定[7]。其中无脂肪肝记0分,轻度脂肪肝记1分,中度脂肪肝记2分,重度脂肪肝记3分。
1.6 统计学分析采用SPSS 11.5统计软件对数据进行统计学分析,正态分布计量资料以均数±标准差(x±s)表示,两组间比较采用t检验。计数资料用百分率(%)表示,两组间比较采用χ2检验。P < 0.05为差异有统计学意义。
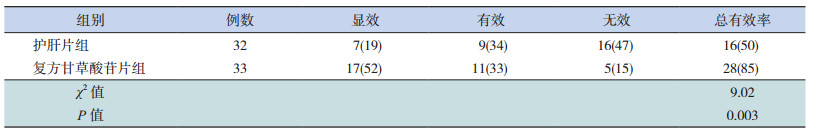
2 结果 2.1 两组治疗有效率比较治疗24周后,两组均无失访病例。复方甘草酸苷片组患儿总有效率为85%,而护肝片组总有效率为50%。两组相比较,复方甘草酸苷片组治疗24周后总有效率明显高于护肝片组(P < 0.05)。见表 1。
| 表 1 两组NAFLD患儿疗效比较 [例(%)] |
2.2 两组治疗前后血清ALT、γ-GT水平以及肝脏B超评分的变化
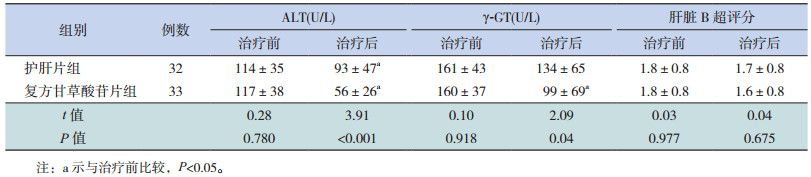
无论护肝片组还是复方甘草酸苷片组,治疗后ALT水平较治疗前均有显著降低(P < 0.05)。复方甘草酸苷片组γ-GT水平在治疗后显著下降(P < 0.05),而护肝片组γ-GT水平在治疗前后比较差异无统计学意义(P > 0.05)。另外复方甘草酸苷片组较护肝片组治疗后ALT及γ-GT水平下降更明显(P < 0.05)。复方甘草酸苷片组及护肝片组治疗前后肝脏B超评分比较差异均无统计学意义(P > 0.05)。见表 2。
| 表 2 两组NAFLD患儿治疗前后ALT、γ-GT水平及肝脏B超评分的变化比较 (x±s) |
2.3 两组治疗前后血清HA、PCⅢ、CⅣ、LN的变化
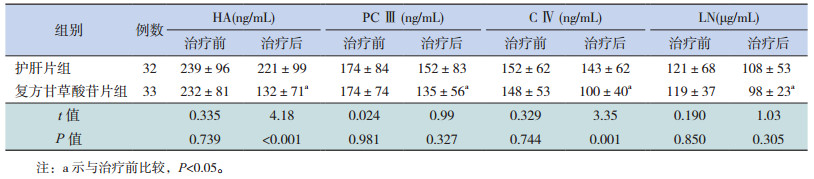
治疗前两组患儿血清HA、PCⅢ、CⅣ、LN水平比较差异均无统计学意义(P > 0.05)。复方甘草酸苷片组治疗24周后血清HA、PCⅢ、CⅣ、LN水平均较治疗前明显降低(P < 0.05),而以上4个指标在护肝片组治疗前后表达差异均无统计学意义(P > 0.05)。治疗24周后,复方甘草酸苷片组HA、CⅣ水平均显著低于护肝片组(P < 0.05),而PCⅢ、LN水平在两组之间比较差异无统计学意义(P > 0.05)。见表 3。
| 表 3 两组NAFLD患儿治疗前后血清HA、PCⅢ、CⅣ、LN水平的变化比较 (x±s) |
3 讨论
近年来,随着人们的生活方式和饮食结构的巨大变化,直接导致了儿童和青少年肥胖发病率的逐年上升。作为肥胖儿童或青少年中最常见的并发症之一NAFLD造成了该部分人群无症状性ALT或γ-GT的增高[8]。如果缺乏及时有效的干预或者治疗,部分NAFLD尤其是NASH患儿最终可发展为肝硬化,甚至肝癌[9]。NASH常继发于NAFL,是进展为肝纤维化和肝硬化的关键阶段,阻断其进展能够有效降低发展成肝硬化的风险。NASH的血清诊断标准目前还不确定,肝活检组织病理学检查仍被认为是诊断NASH的金标准[10]。NASH常见的组织学改变有:中重度大泡性脂肪变性、小叶肝炎伴有坏死或气球变性和(或)纤维化[11-12]。推荐参照美国NAFLD诊疗指南,依据病理检查结果评估NAFLD活动度积分(NAS)和肝纤维化分期,NAS > 4分者可诊断NASH[13]。对于NAFL患者目前治疗主要通过饮食和锻炼控制,而NASH需要消除肝组织炎症、保肝对症支持治疗[5, 14]。因此临床上诊断NAFL和NASH对于该病的预后尤其重要。对于大部分儿童患者来说,肝活检因其有创性很难开展,而肝功能和肝纤维化血清学指标可以作为NASH临床诊断的参考依据。本研究入组的NAFLD病例治疗依据为患者ALT、γ-GT血清水平持续异常超过半年。
NAFLD的发病机制复杂,由Day等[15]提出的“两次打击”学说是NAFLD目前最为经典的发病机制理论,且已经被广大学者接受。胰岛素抵抗引起肝细胞内脂质沉积是第一次打击;发生脂肪变的肝细胞对各类损害尤为敏感,由于氧化应激和脂质过氧化导致的肝脏炎性反应形成了第二次打击。肝脏炎症反应导致持续的脂肪性肝炎即NASH阶段,持续炎症细胞浸润、星状细胞活化可诱发细胞外基质的生成,最终导致脂肪性肝纤维化和/或肝硬化的发生[16]。
本文所研究的主要药物为复方甘草酸苷片,其主要成分为甘草酸苷。已有较多文献报道,复方甘草酸苷片能明显改善NASH成人患者肝损伤以及减轻肝纤维化程度[17-18]。然而该药是否能够有效阻止NAFLD患儿疾病的进展迄今为止罕见报道。根据孙晓红等[4]发表的复方甘草酸苷片治疗NASH的Meta分析,大部分临床研究采用24或12周疗程。本研究在以往学者研究基础上增加了肝纤维化指标的检测。由于肝纤维化指标的改善要滞后于肝功能,12周治疗较难产生显著变化,因而我们将疗程延长至24周。另外,本研究过程中,复方甘草酸苷片组、护肝片组在治疗12周时监测肝功能及肝纤维化等指标时发现,两组患儿仅有血清ALT水平下降,而血清γ-GT水平、肝纤维化指标均无明显改变,进一步证实NAFLD患儿12周疗程不足以改善肝脏纤维化病情。最后将治疗24周后各指标与治疗前进行比较分析,结果显示:复方甘草酸苷片组患儿血清ALT、γ-GT水平以及肝纤维化指标均有显著下降,而护肝片组仅有血清ALT水平显著降低,说明复方甘草酸苷片治疗能更好地改善肝功能,并可以抑制NAFLD患儿肝纤维化病程的进展。此外,本研究对两组患者治疗前后的肝脏B超指数进行对比,研究发现无论复方甘草酸苷片还是护肝片均不能显著改善脂肪肝程度,说明两种药物对肝脏脂肪的沉积干预效果不佳,控制肝脏脂肪含量主要依赖于合理的饮食、积极锻炼以及体重的控制。
根据文献报道,复方甘草酸苷片的主要成分甘草酸苷具有以下生物学活性[19]:(1)抗炎作用,抑制花生四烯酸代谢酶的活性,从而使得前列腺素和白三烯等炎性介质无法产生;(2)类固醇样作用,甘草酸苷体内代谢产物与类固醇相似,竞争性抑制类固醇激素的灭活并减缓其代谢,从而发挥其类固醇样作用;(3)通过抑制磷脂酶A2和前列腺素E2的形成发挥保护肝细胞膜作用;(4)其代谢产物可以选择性地抑制补体系统的激活途径,降低循环免疫复合物水平,从而发挥抗补体活性的作用。由于以上存在的生物学活性,甘草酸苷能够减轻氧化应激及脂质过氧化诱导的肝细胞损伤和炎症因子的释放,最终避免了肝脏炎症后的肝纤维化的发生。邱惠萍等[20]在CC14诱导的急性肝损伤动物模型中证实,甘草酸苷可以通过调节NF-κB通路来保护肝细胞,并抑制急性肝衰竭的发生。另有研究发现,在D-氨基半乳糖诱导的肝损伤动物模型中,甘草酸苷可以通过降低肿瘤坏死因子α(TNF-α)的释放发挥其保肝作用[21],以上研究结果均为甘草酸苷具有抑制肝损伤的分子机制。对于该药是否具有逆转肝纤维化作用以及相关的分子机理还需要进一步研究证实。
总之,与护肝片相比,复方甘草酸苷片可以更好地改善NAFLD患儿的肝损伤,以及减轻肝纤维化程度。另外该药口服方便、使用安全,更适合门诊NAFLD患儿的临床治疗。当然本研究还存在一定的缺陷,例如临床观察时间尚短、研究例数有限,以及停药后肝功能和肝纤维化血清学指标是否会反弹等问题。因此,今后可联合多家医院开展多中心随机双盲研究,并延长疗效观察时间,进一步明确复方甘草酸苷片治疗NAFLD患儿的长期疗效。
| [1] | Moran JR, Gishan FK, Halter SA, et al. Steatohepatitis in obese children:a cause of chronic liver dysfunction[J]. Am J Gastroenterol, 1983, 78 (6): 374–377. |
| [2] | Schwimmer JB. Clinical advances in pediatric nonalcoholic fatty liver disease[J]. Hepatology, 2016, 63 (5): 1718–1725. DOI:10.1002/hep.v63.5 |
| [3] | Noureddin M, Anstee QM, Loomba R. Review article:emerging anti-fibrotic therapies in the treatment of non-alcoholic steatohepatitis[J]. Aliment Pharmacol Ther, 2016, 43 (11): 1109–1123. DOI:10.1111/apt.2016.43.issue-11 |
| [4] | 孙晓红, 张良登, 魏玮, 等. 甘草酸苷治疗非酒精性脂肪性肝炎的系统评价与Meta分析[J]. 世界中西医结合杂志, 2015, 10 (2): 265–271. |
| [5] | 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南 (2010年修订版)[J]. 中华肝脏病杂志, 2010, 18 (3): 163–166. |
| [6] | 李毓雯, 朱传龙, 储安贞, 等. 非酒精性脂肪性肝病儿童血清人尾肢同源蛋白水平检测的临床意义[J]. 医学研究生学报, 2017, 30 (1): 48–51. |
| [7] | 中华医学会肝脏病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南[J]. 中华肝脏病杂志, 2006, 14 (3): 161–163. |
| [8] | 田江宣, 留佩宁, 郑超, 等. 温州超重肥胖少年儿童临床表型分析[J]. 中华全科医学, 2016, 14 (5): 790–792. |
| [9] | Feldstein AE, Charatcharoenwitthaya P, Treeprasertsuk S, et al. The natural history of non-alcoholic fatty liver disease in children:a follow-up study for up to 20 years[J]. Gut, 2009, 58 (11): 1538–1544. DOI:10.1136/gut.2008.171280 |
| [10] | Kobyliak N, Abenavoli L. The role of liver biopsy to assess non-alcoholic fatty liver disease[J]. Rev Recent Clin Trials, 2014, 9 (3): 159–169. |
| [11] | Ciocca M, Ramonet M, Álvarez F. Non-alcoholic fatty liver disease:a new epidemic in children[J]. Arch Argent Pediatr, 2016, 114 (6): 563–569. |
| [12] | 邱平, 唐明薇, 梅希, 等. 病理学诊断的非酒精性脂肪性肝病患者的临床特点分析[J]. 川北医学院学报, 2015, 30 (2): 182–186. |
| [13] | Chalasani N, Younossi Z, Lavine JE, et al. The diagnosis and management of non-alcoholic fatty liver disease:practice guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association[J]. Hepatology, 2012, 55 (6): 2005–2023. DOI:10.1002/hep.25762 |
| [14] | Nguyen V, George J. Nonalcoholic fatty liver disease management:dietary and lifestyle modifications[J]. Semin Liver Dis, 2015, 35 (3): 318–337. DOI:10.1055/s-00000069 |
| [15] | Day CP, James OF. Steatohepatitis:a tale of two "hits"[J]. Gastroenterology, 1998, 114 (4): 842–845. DOI:10.1016/S0016-5085(98)70599-2 |
| [16] | Stojsavljević S, Gomerčić Palčić M, Virović Jukić L, et al. Adipokines and proinflammatory cytokines, the key mediators in the pathogenesis of nonalcoholic fatty liver disease[J]. World J Gastroenterol, 2014, 20 (48): 18070–18091. DOI:10.3748/wjg.v20.i48.18070 |
| [17] | 赵海明. 复方甘草酸苷片治疗非酒精性脂肪性肝炎临床研究[J]. 西部医学, 2010, 22 (7): 1196–1197, 1200. |
| [18] | 吕永丰, 叶琳, 陈清霞, 等. 复方甘草酸苷用于治疗非酒精性脂肪肝炎的临床观察[J]. 中国实用医药, 2010, 5 (29): 23–24. DOI:10.3969/j.issn.1673-7555.2010.29.015 |
| [19] | Wang C, Duan X, Sun X, et al. Protective effects of glycyrrhizic acid from edible botanical glycyrrhiza glabra against non-alcoholic steatohepatitis in mice[J]. Food Funct, 2016, 7 (9): 3716–3723. DOI:10.1039/C6FO00773B |
| [20] | 邱惠萍, 李小六, 饶和平. 甘草酸苷通过NF-κB通路影响小鼠急性肝损伤机制的研究[J]. 重庆医学, 2016, 45 (30): 4211–4213. DOI:10.3969/j.issn.1671-8348.2016.30.011 |
| [21] | 黄以群, 林珍辉, 王崇国. 甘利欣在实验性肝损伤中的保护作用[J]. 中华肝脏病杂志, 2000, 8 (3): 186. |
 2017, Vol. 19
2017, Vol. 19