2. 华中科技大学同济医学院附属武汉儿童医院内分泌科, 湖北 武汉 430016
儿童肥胖是指过多脂肪在体内聚集,从而危害儿童身心健康的一种不良状态。儿童代谢综合征(metabolic syndrome, MS)是以肥胖、血脂、血糖及血压异常为特征的一组临床症候群,随着全球肥胖儿童的日益增多,MS的发病率也在逐渐增加[1]。6~10岁儿童的生理特征不稳定,不可轻易诊断为MS,但随着年龄的增长,若不对其异常指标进行干预,就极易发展成为MS[2]。另有研究显示,成人肥胖会导致心脏自主神经功能受损[3]。迄今为止国内外尚未见对肥胖儿童心脏自主神经功能进行分析的报道。本研究旨在对学龄期肥胖儿童及其中合并脂代谢异常者的心率减速力(deceleration capacity of heart rate, DC)、心率加速力(acceleration capacity of heart rate, AC)和心率变异性(heat rate variability, HRV)进行分析,了解其自主神经功能状态,为儿科临床诊疗工作提供参考。
1 资料与方法 1.1 研究对象以2014年1月至2016年10月来我院就诊的肥胖儿童作为研究对象。研究对象入选标准:(1)年龄6岁至不满10岁;(2)体重指数(BMI)≥同年龄同性别儿童肥胖筛查BMI界值点(28 kg/m2)[4]。肥胖儿童中血脂异常组入选标准(6~10岁儿童)[2]:低高密度脂蛋白胆固醇(HDL-C < 1.03 mmol/L)或高非高密度脂蛋白胆固醇(non-HDL-C≥3.76 mmol/L)或高甘油三酯(TG≥1.47 mmol/L)。
排除标准:(1)近1个月服用过影响血脂的药物;(2)血压、血糖异常者;(3)器质性心脏病;(4)由代谢性疾病、先天性遗传疾病及神经内分泌疾病等引起的继发性肥胖;(5)24 h动态心电图诊断异常者(各类期前收缩、房室传导阻滞、房扑、房颤等心律失常)。
共入选肥胖儿童108例(男75例,女33例),年龄7.9±1.1岁,其中血脂正常组75例(男52例,女23例),年龄7.9±1.1岁;血脂异常组33例(男23例,女10例),年龄7.9±1.2岁。另选取同期来我院体检的与入选肥胖儿童年龄、性别相匹配的健康儿童103例为对照组,其中男66例,女37例,年龄7.8±1.1岁(6岁至不满10岁)。
1.2 体格检测由专人测量身高和体重。(1)身高:采用立式身高计测量,标尺刻度精确到0.01 m。(2)体重:采用电子秤测量,受检者身穿一件轻质衣裤及袜子进行测量,电子秤刻度精确到0.1 kg。根据身高体重计算BMI [体重/身高2(kg/m2)]。
1.3 动态心电图检查采用美国DMS公司生产的Version12.5十二导同步动态心电图分析系统,连续记录24 h动态心电图。计算机自动算出DC、AC值和HRV各项指标的值。
1.4 DC值测定及计算(1)使用500 Hz数字化自动处理系统将24 h动态心电图转化为以心动周期RR值为纵坐标的序列图;(2)将每一个心动周期的RR值与前一心动周期进行比较,较前一个心动周期延长者,称为减速周期(当实测的RR值比前一心动周期值延长后缩短超过5%时,该周期则被自动剔除);(3)以每一个减速点为心率段的中心,依次取其两侧的20个心动周期组成一个心率段,进行不同心率段的有序排列;(4)经位相整序后,分别计算对应周期的平均值X(i),即对应序号的周期进行信号平均(phase-rectified signal averaging, PRSA),再将结果代入公式计算DC值。公式为:DC=[X (0)+X (1)-X (-1)-X (-2)]×1/4。X (0) 为所有中心点RR间期的平均值;X (1) 为中心点右侧紧邻的第1个心动周期的平均值;X (-1) 为中心点左侧紧邻的第1个心动周期的平均值;X (-2) 为中心点左侧相邻的第2个所有心动周期的平均值;(5)DC值的单位为ms。
1.5 HRV检测HRV即窦性心律中逐次心动周期之间的时间变异数。HRV时域指标包括:RR间期总体标准差(standard deviation of normal-to-normal R-R intervals, SDNN)、RR间期平均值的标准差(standard deviation of the average normal-to-normal intervals, SDANN)、相邻RR间期差值的均方根(root mean square of successive differences, RMSSD)。HRV频域指标包括低频功率(low-frequency power, LF),其频段为0.04~0.15 Hz,以及高频功率(high-frequency power, HF),其频段为0.15~0.40 Hz。
1.6 统计学分析应用SPSS 17.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验。相关性检验采用Pearson相关分析。P < 0.05表示差异有统计学意义。
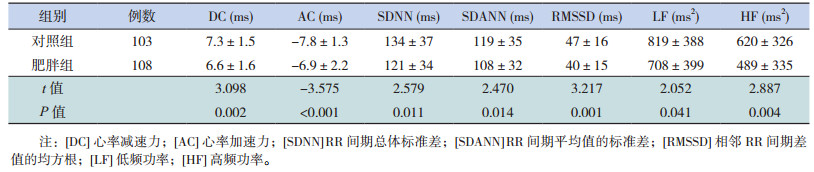
2 结果 2.1 肥胖组与对照组DC、AC、HRV各指标比较肥胖组的DC、SDNN、SDANN、RMSSD、LF、HF均低于对照组,AC高于对照组,差异有统计学意义(P < 0.05),见表 1。
| 表 1 肥胖组与对照组DC、AC、HRV各指标的比较(x±s) |
2.2 肥胖儿童中血脂异常与血脂正常组BMI、DC、AC、HRV各指标的比较
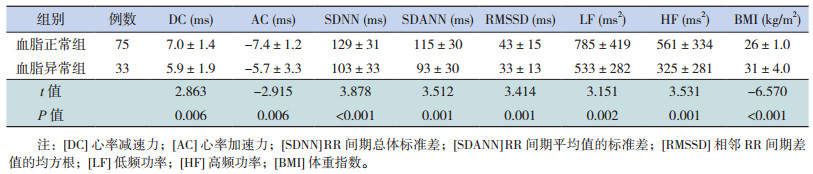
肥胖儿童中血脂异常组的DC、SDNN、SDANN、RMSSD、LF、HF均低于血脂正常组,AC、BMI高于血脂正常组,差异有统计学意义(P < 0.05),见表 2。
| 表 2 肥胖儿童中血脂异常与血脂正常组BMI、DC、AC、HRV各指标的比较(x±s) |
2.3 肥胖儿童BMI与DC、AC、HRV各指标的相关性分析
肥胖儿童BMI与DC、SDNN、SDANN、RMSSD及HF均呈显著负相关,r值分别为-0.208、-0.306、-0.318、-0.219、-0.198,均P < 0.05,而与AC呈显著正相关(r=0.265,P < 0.05),见图 1。
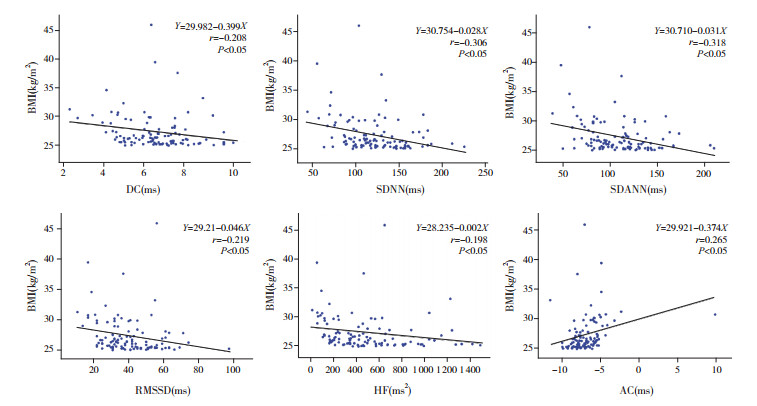
|
图 1 肥胖儿童BMI与DC、AC、HRV各指标的相关性 注:[DC]心率减速力;[AC]心率加速力;[SDNN]RR间期总体标准差;[SDANN] RR间期平均值的标准差;[RMSSD]相邻RR间期差值的均方根;[HF]高频功率;[BMI]体重指数。 |
3 讨论
DC是德国慕尼黑心脏中心Georg Schmidt发现并提出的通过分析24 h心率的整体趋向性,并测定减速能力,定量评估迷走神经张力高低的程度,进而筛选和预警猝死高危患者的一项新的无创检测指标[5]。2009年郭继鸿[5]将DC概念引入国内,随后在成人冠心病、高血压等疾病中得到了广泛运用。还有部分学者将DC运用于儿科领域,以评价儿童青少年的自主神经功能[6-7]。心脏自主神经功能包括交感神经和迷走神经,交感神经是心脏的加速神经,其张力增加时心率加快,AC增强。反之,迷走神经是心脏的减速神经,其张力增加时心率变慢,DC增强。DC降低提示迷走神经张力降低,其对人体的保护性下降,患者发生猝死的风险增加[5]。HRV包括时域指标(SDNN、SDANN、RMSSD)和频域指标(LF、HF)。SDNN反映交感和迷走神经总的活性,RMSSD和HF反映迷走神经活性,SDANN和LF反映交感神经活性。HRV作为判断心脏自主神经功能的一项无创检查指标亦在临床上得到了广泛应用。
儿童肥胖已经成为全球日益严重的健康问题[8]。截至2015年底,全球肥胖儿童已达所有适龄儿童的1/10,且严重肥胖占1/4[9]。本研究对学龄期肥胖儿童的DC、AC和HRV进行分析,发现肥胖儿童的DC及HRV各指标均明显低于对照组,AC明显高于对照组,说明肥胖儿童的自主神经功能受损,迷走神经张力减低。2002年中国居民营养与健康调查显示,96%的肥胖儿童有1项MS组分异常[10]。故本研究将肥胖儿童中血脂异常者DC、AC和HRV进行了分析,发现血脂异常组的DC及HRV均明显低于血脂正常组,AC明显高于血脂正常组,说明肥胖儿童中合并血脂异常者的自主神经功能受损更为严重。本研究还显示,肥胖儿童BMI与DC、SDNN、SDANN、RMSSD、HF呈明显负相关,与AC呈明显正相关,说明肥胖程度越高,自主神经功能紊乱情况越严重,表现为迷走神经张力降低,交感神经张力增高。交感与迷走神经失衡,导致机体儿茶酚胺增高,引起心肌细胞钙通道形态改变,4相除极幅度、0相上升速度、超射高度增加,致使心肌复极不均匀,造成心室肌电活动不稳定,心室颤动的阈值降低,易形成恶性心律失常及心源性猝死等心血管事件[11]。导致肥胖儿童自主神经功能紊乱的原因可能有:(1)胰岛素抵抗:有研究显示肥胖患儿中约有52%的儿童存在胰岛素抵抗[12]。胰岛素抵抗时,会使血清胰岛素水平增高,从而影响下丘脑腹内侧核,进而使交感神经活性增高[13]。(2)精神心理因素:不健康的精神心理因素及社会行为方式可引起神经内分泌系统、肾上腺轴功能紊乱而导致自主神经系统受损[14]。(3)高脂血症:高脂血症可使血管内皮细胞功能紊乱,内皮细胞分泌内皮素-1和血栓素A2明显增加,前者能上调交感神经活性,增加儿茶酚胺水平,后者激活自身受体后,可通过中枢及外周途径使交感神经活性上升,迷走神经活性相对下降,导致交感与迷走神经失衡[15]。
综上,肥胖儿童存在心脏自主神经功能紊乱,在监测其体格指标及生化指标的同时,还应进行动态心电图检查,分析DC、AC及HRV各项指标,了解自主神经功能状态,以便在临床上对肥胖儿童,特别是合并代谢异常者的心血管疾病发生风险进行综合评估。
| [1] | Schwandt P, Bertsch T, Liepold E, et al. Age-and gender-specific components of the metabolic syndrome in 2228 first graders:the PEP family heart study[J]. Scientifica (Cairo), 2013, 2013 : 394807. |
| [2] | 中华医学会儿科学分会内分泌遗传代谢学组, 中华医学会儿科学分会心血管学组, 中华医学会儿科学分会儿童保健学组. 中国儿童青少年代谢综合征定义和防治建议[J]. 中华儿科杂志, 2012, 50 (6): 420–422. |
| [3] | 王小凤, 张巍, 杨建国, 等. 高血压伴肥胖患者心率变异性和超敏C反应蛋白的分析[J]. 临床荟萃, 2014, 29 (4): 442–445. |
| [4] | 李辉, 宗心南, 季成叶, 等. 中国2-18岁儿童青少年超重和肥胖筛查体重指数界值点的研究[J]. 中华流行病学杂志, 2010, 31 (6): 616–620. |
| [5] | 郭继鸿. 心率减速力检测[J]. 临床心电学杂志, 2009, 18 (1): 59–68. |
| [6] | 易兰芬, 文红霞, 曹晓晓, 等. 不明原因心前区不适患儿心率减速力及心率变异性分析[J]. 临床儿科杂志, 2014, 32 (10): 951–955. DOI:10.3969/j.issn.1000-3606.2014.10.20 |
| [7] | 易兰芬, 文红霞, 黄穗, 等. 婴幼儿血管瘤患者口服小剂量普萘洛尔前后动态心电图的比较[J]. 中国当代儿科杂志, 2016, 18 (4): 345–349. DOI:10.7499/j.issn.1008-8830.2016.04.013 |
| [8] | 陈联辉, 朱伟芬, 梁黎, 等. 非高密度脂蛋白胆固醇对肥胖儿童非脂性心血管疾病危险因素的预测作用[J]. 中国当代儿科杂志, 2013, 15 (5): 356–360. DOI:10.7499/j.issn.1008-8830.2013.05.009 |
| [9] | 于梦潇, 刘煜. 儿童肥胖与代谢综合征相关性的研究进展[J]. 中国妇幼保健, 2015, 30 (2): 325–326. |
| [10] | Li Y, Yang X, Zhai F, et al. Prevalence of the metabolic syndrome in Chinese adolescents[J]. Br J Nutr, 2008, 99 (3): 565–570. |
| [11] | 曲秀芬, 刘莹, 黄永麟, 等. 急性心肌梗死的心室复极时间变异性研究[J]. 中国循环杂志, 2001, 16 (5): 351–353. |
| [12] | 董瑾, 赵彦, 黄乐. 胰岛素不同给药方法治疗儿童1型糖尿病的效果观察[J]. 天津医药, 2015, 57 (8): 889–891. DOI:10.11958/j.issn.0253-9896.2015.08.016 |
| [13] | Landsberg L, Young JB. Insulin-mediated glucose metabolism in the relationship between dietary intake and sympathetic nervous system activity[J]. Int J Obes, 1985, 9 (Suppl 2): 63–68. |
| [14] | Brunner EJ, Hemingway H, Walker BR, et al. Adrenocortical, autonomic, and inflammatory causes of the metabolic syndrome:nested case-control study[J]. Circulation, 2002, 106 (21): 2659–2665. DOI:10.1161/01.CIR.0000038364.26310.BD |
| [15] | Dowell FJ, Hamilton CA, Reid JL. Effects of manipulation of dietary cholesterol on the function of the thoracic aorta from New Zealand white rabbits[J]. J Cardiovasc Pharmacol, 1996, 27 (2): 235–239. DOI:10.1097/00005344-199602000-00009 |
 2017, Vol. 19
2017, Vol. 19