2. 湖北省新华医院神经内科, 湖北 武汉 430000
慢性炎性脱髓鞘性多发性神经根神经病(chronic inflammatory demyelinating polyneuropathy, CIDP)是一类由免疫介导的运动感觉周围神经病,运动症状表现为四肢进行性无力;感觉纤维主要是与关节位置觉有关的粗纤维受影响,表现为步态不稳;多有脑脊液蛋白-细胞分离,周围神经传导速度减慢、传导阻滞及异常波形离散;病理显示有髓纤维多灶性脱髓鞘、神经内膜水肿、炎细胞浸润等特点[1-4]。CIDP按照受累的神经种类分为运动、感觉神经均受累型,运动神经受累型,感觉神经受累型;按照神经电生理结果,分为脱髓鞘型和轴突损害为主型。继发轴突变性或纯感觉受累CIDP患儿的运动神经传导检测常常不能提示脱髓鞘。短潜伏期体感诱发电位(short-lantency somatosensory evoked potentials, SSEP)主要探测感觉纤维至大脑皮质的传导通路,还可探测近端神经脱髓鞘或轴突变性[5-6]。但它对于纯感觉型CIDP和轴突损害为主CIDP的诊断作用研究甚少。本研究旨在评估SSEP对运动感觉神经脱髓鞘型,纯感觉神经脱髓鞘型或轴突损害为主型CIDP的诊断作用。
1 资料与方法 1.1 研究对象以2012年7月至2015年6月期间48例确诊或者可能CIDP患儿为研究对象。年龄3~10岁,平均80±22个月,男27例、女21例,平均身高138±24厘米。确诊或者可能CIDP诊断参照Nevo等[7]研究。确诊CIDP的诊断标准:上下肢远近端缓慢进展的肌无力、持续1个月,脑脊液蛋白增高,符合CIDP电生理标准;可能CIDP:上下肢远近端缓慢进展的肌无力、持续1个月,脑脊液蛋白增高。排除标准[8]:包柔螺旋体感染(Lyme病)、白喉、药物或毒物所致的周围神经病;遗传性脱髓鞘性神经病;明显的括约肌障碍;已诊断多灶性运动神经病;伴有高滴度抗髓鞘相关糖蛋白抗体的IgM型单克隆丙球蛋白病;其他脱髓鞘性神经病,包括POEMS病、骨硬化性骨髓瘤、糖尿病性或非糖尿病性腰骶神经丛病变;周围神经淋巴瘤和淀粉样变(偶尔亦可有脱髓鞘样改变)。选择同期40例健康儿童为对照组,年龄3~10岁,平均86±37个月,男22例、女18例,平均身高138±19厘米。所有入组患儿及健康对照均进行肌电图神经传导和/或SSEP检查,健康对照仅行SSEP检查(无创,免费)。
本研究获得医院医学伦理委员会批准及研究对象监护人的知情同意。
1.2 神经电生理检查应用丹麦Dantec公司4道肌电图仪进行神经传导检查,包括至少4条运动神经和2条感觉神经,在放松、平卧,室温20~22℃,检测对象肢体温度32~34℃的条件下进行。神经传导采用表面电极进行上下肢运动、感觉的神经传导检测,包括正中神经、尺神经、腓总神经和胫神经等运动神经传导速度,末端潜伏期,复合肌肉动作电位,以及正中神经、尺神经和腓肠神经的感觉神经传导速度及波幅。感觉传导均采用反向记录法。
SSEP安装参考Cruccu等[9]文献标准,电极置于腕部正中神经或踝部胫神经部位。正中神经SEP包括N6(肘部电位),N13(颈髓电位),N20(皮质电位)。胫神经SEP包括N8(腘窝电位),N22(腰髓电位),P39(皮质电位)。
1.3 神经电生理检查的判定神经传导的判定参考Cornblath等[10]文献标准。脱髓鞘表现为神经传导减慢,波形离散或传导阻滞。轴突变性表现为运动神经传导动作电位波幅降低。运动和感觉神经传导速度均减慢,波形离散或传导阻滞提示运动和感觉神经均脱髓鞘;仅有感觉神经传导速度减慢,波形离散或传导阻滞,而运动神经传导大致正常提示纯感觉型脱髓鞘病变。SSEP的正中神经和胫神经潜伏期检测根据文献[11]分为正常SSEP、SSEP辅助诊断CIDP、SSEP无意义3类,正常即CIDP患儿周围神经传导和后根神经正常;SSEP辅助诊断CIDP:正中神经SSEP中N6存在,N13潜伏期延长或缺失,提示臂丛神经干和/或后根水平传导异常;胫神经SSEPs表现为N8存在,N22潜伏期延长或缺失,提示腰骶丛和/或后根损害;SSEP无意义即N6或N8不能引出,不能探测N13、N22。
1.4 统计学分析运用SPSS 17.0统计软件进行数据处理。计量资料以均数±标准差(x±s)表示,组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果根据肌电图神经传导结果,48例CIDP患儿中运动、感觉神经均脱髓鞘的35例,符合确诊CIDP诊断标准;感觉型脱髓鞘8例,运动、感觉神经轴突变性5例。CIDP组与健康对照组年龄、身高(SSEP潜伏期与身高呈正相关)的差异无统计学意义(P > 0.05)。
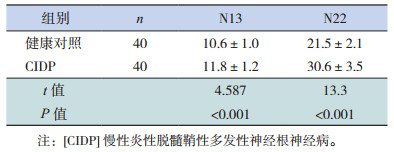
根据SSEP检查结果,SSEP辅助诊断CIDP 40例(未符合CIDP确诊标准的8例感觉受累及5例继发轴突变性患儿的SSEP均异常),其中7例可见臂丛神经干和/或后根水平传导异常,33例患儿同时有臂丛神经干和/或后根水平传导异常腰骶丛和/或后根损害;SSEP无意义8例。与健康对照相比,CIDP患儿N13、N22波幅潜伏期明显延长(P < 0.05),见表 1。
| 表 1 CIDP和健康对照组短潜伏期体感诱发电位N13,N22波幅潜伏期的比较(x±s,ms) |
3 讨论
CIDP是免疫介导的周围神经病,发病率低(2.8/100 000),分型复杂,诊断困难。SSEP通过刺激上肢正中神经和下肢胫神经,在大脑皮质激活一级感觉中枢的皮质神经元,并激活周围神经近端和远端以产生电活动。在SSEP中,N6和N8反映周围神经功能,N13反映臂丛近端神经根功能状态,N22反映腰骶丛神经功能状态;N13和N22还可反映后角神经元至后根传入纤维的功能状态,N13和N22缺失或潜伏期延长提示后角神经元至后根的传入感觉纤维脱髓鞘或轴突变性[9]。SSEP对于近端神经根功能的评估有重要意义,早期亚临床吉兰-巴雷综合征的典型特征就是神经传导正常但有上下肢SSEP异常[6]。目前仅少量研究评估了SSEP对于CIDP的诊断价值,证明83%~100%的脱髓鞘型CIDP患儿有感觉神经近端神经根异常[6, 12]。但对于SSEP在纯感觉型CIDP和轴突损害为主CIDP中的特点研究甚少。本研究CIDP患儿SSEP的N13,N22波幅潜伏期长于健康对照,提示臂丛神经干和/或后根水平传导异常,以及腰骶丛和/或后根损害,而且经肌电图神经传导检测不符合CIDP确诊标准的8例感觉受累及5例继发轴突变性患儿的SSEP均异常,提示SSEP可为CIDP诊断提供辅助诊断依据。
需要注意的是,对于颈椎关节和腰椎关节强直的患儿,神经传导在臂丛神经干和腰骶丛不易引出,SSEP不易获得,因此SSEP不能作为这部分患儿的CIDP补充诊断手段。SSEP的N6或N8不能引出时,也不具有辅助诊断价值。
综上,SSEP可探测臂丛神经干和/或后根水平,以及腰骶丛和/或后根传导功能状态,对于神经传导检测不能提供运动神经脱髓鞘证据的CIDP,可作为辅助诊断手段。
| [1] | Eftimov F, van SI. Chronic inflammatory demyelinating polyradiculoneuropathy:update on clinical features, phenotypes and treatment options[J]. Curr Opin Neurol, 2013, 26 (5): 496–502. DOI:10.1097/WCO.0b013e328363bfa4 |
| [2] | Bromberg MB. Review of the evolution of electrodiagnostic criteria for chronic inflammatory demyelinating polyradicoloneuropathy[J]. Muscle Nerve, 2011, 43 (6): 780–794. DOI:10.1002/mus.22038 |
| [3] | Mahdi-Rogers M, Hughes RA. Epidemiology of chronic inflammatory neuropathies in southeast England[J]. Eur J Neurol, 2014, 21 (1): 28–33. DOI:10.1111/ene.2013.21.issue-1 |
| [4] | Latov N. Diagnosis and treatment of chronic acquired demyelinating polyneuropathies[J]. Nat Rev Neurol, 2014, 10 (8): 435–446. DOI:10.1038/nrneurol.2014.117 |
| [5] | Devic P, Petiot P, Mauguiere F. Diagnostic utility of somatosensory evoked potentials in chronic polyradiculopathy without electrodiagnostic signs of peripheral demyelination[J]. Muscle Nerve, 2016, 53 (1): 78–83. DOI:10.1002/mus.24693 |
| [6] | Yiannikas C, Vucic S. Utility of somatosensory evoked potentials in chronic acquired demyelinating neuropathy[J]. Muscle Nerve, 2008, 38 (5): 1447–1454. DOI:10.1002/mus.v38:5 |
| [7] | Nevo Y, Topaloglu H. 88th ENMC international work-shop:childhood chronic inflammatory demyelinating polyneu-ropathy (including revised diagnostic criteria), Naarden, The Netherlands, December 8-10, 2000[J]. Neuromuscul Disord, 2002, 12 (2): 195–200. DOI:10.1016/S0960-8966(01)00286-3 |
| [8] | 李海峰. 欧洲神经病学会联盟和周围神经病学会对慢性炎性脱髓鞘性多神经根神经病 (CIDP) 诊治的联合建议[J]. 中国神经免疫学和神经病学杂志, 2012, 19 (2): 147–148. |
| [9] | Cruccu G, Aminoff MJ, Curio G, et al. Recommendations for the clinical use of somatosensory evoked potentials[J]. Clin Neurophysiol, 2008, 119 (8): 1705–1719. DOI:10.1016/j.clinph.2008.03.016 |
| [10] | Cornblath DR. Electrophysiology in Guillain-Barré syndrome[J]. Ann Neurol, 1990, 27 (Suppl): S17–20. |
| [11] | 田悦. 诱发电位在儿科的应用[M]//潘映辐. 临床诱发电位学. 第2版. 北京: 人民卫生出版社, 1999: 633-634. |
| [12] | Tsukamoto H, Sonoo M, Shimizu T. Segmental evaluation of the peripheral nerve using tibial nerve SSEPs for the diagnosis of CIDP[J]. Clin Neurophysiol, 2010, 121 (1): 77–84. DOI:10.1016/j.clinph.2009.09.019 |
 2017, Vol. 19
2017, Vol. 19