2. 长春市第六医院儿童青少年科, 吉林 长春 130052
孤独症谱系障碍(autism spectrum disorder, ASD)是一个复杂的神经发展性疾患,它的主要标志性特征是社会交往障碍、沟通障碍和重复刻板行为[1]。在近年来对ASD所做的大量研究中,对于大多数的患病人群来说其基因及环境影响因素都尚未明确[2]。ASD对儿童青少年的影响尤为广泛,儿童心理理论(theory of mind)指出了ASD儿童在社会互动和交流方面的行为缺陷,同时也部分解释了ASD儿童的认知和情感功能的受损情况[3],但对于儿童ASD的具体患病因素以及对儿童的行为反应危害情况还没有准确论断。
有研究显示,ASD儿童往往伴随着更高水平的焦虑症状,如表现焦虑、不确定性、焦虑唤醒和分离焦虑等[4],同时可能伴有呼吸困难、心跳加快和手掌潮湿等症状,且悲观主义、快感缺失、主动性缺乏等心理困扰十分普遍[5]。有国外研究证实,特异恐怖、强迫症和注意缺陷多动障碍等疾病在ASD患儿中的患病率明显更高,可导致患儿出现各种严重的功能损害[6]。除此之外,儿童共患病不仅存在于患儿的心理疾患方面,还会以睡眠障碍、精神机能障碍、肠道疾病和癫癎等躯体疾病的形式体现出来[7]。有调查显示,中国ASD患儿的睡眠障碍的患病较美国更加典型,并且往往与不良的亲社会行为相联系[8]。
虽然国内外关于ASD共患病的研究不在少数,但对于癫癎与儿童ASD各行为反应能力的确切关系还有待深入探讨。可以推测,从癫癎患病情况早期发现ASD患儿对儿童ASD的筛查、诊治有重要意义,同时,提早对ASD患儿进行癫癎共患病的确诊及治疗也会对ASD患儿行为能力及某些症状起到改善的作用。本研究对患癫癎的ASD儿童的身体机能状况展开调查,并对患儿癫癎患病情况与其行为反应能力的关系进行分析。
1 资料与方法 1.1 研究对象研究对象为2015~2016年长春市第六医院就诊的190例ASD儿童,均符合美国精神疾病诊断和统计手册第4版(DSM-IV)诊断标准[9]。
190例患儿中,男性患儿153例(80.5%),女性患儿37例(19.5%);汉族172例(90.5%),少数民族18例(9.5%);年龄4~17岁,平均年龄为7.43±0.27岁;平均身高122.5±1.4 cm;头围51.20±0.18 cm;患儿母亲平均妊娠年龄为27.3±0.4岁。
190例ASD患儿中,20例(10.5%)在无发烧的情况下出现过癫癎发作,均为多次发作,其中1岁以内发作18例(9.5%),1岁以上发作2例(1.1%)。被诊断为癫癎的患儿有12例(6.3%),正在接受癫癎治疗的患儿有11例(5.8%),家人(指三代以内亲属)有过癫癎发作的患儿5例(2.6%)。
由于存在儿童孤独症评定量表和孤独症行为量表访问时的缺失值问题,因此在涉及到这两个量表的数据分析时,仅纳入83例ASD儿童进行分析评价。
1.2 问卷调查由研究人员对入组ASD儿童的家长发放调查问卷,指导其填写并核对信息,并当场收回所有问卷。该问卷的内容为:(1)ASD儿童的基本情况,如患儿的年龄、性别、民族、身高、体重、头围、母亲妊娠年龄等;(2)ASD儿童的癫癎患病情况,具体包括以下问题:是否曾经在无发烧的情况下出现癫癎发作,是否曾经有过多次癫癎发作,第1次癫癎发作的年龄是否在1岁以内,是否经正规医院确诊为癫癎,是否现在正接受癫癎治疗,家人是否有过癫癎发作等;(3)ASD儿童的生长发育情况,包括1岁前是否有肌肉过度紧张,1岁前有何体格发育问题,1岁前是否有听力问题等。
1.3 孤独症评定量表儿童孤独症评定量表(CARS量表)[10]适用于儿童、少年和成人孤独症的辅助诊断。该量表共包含15个评分项目,分别为人际关系、模仿、情感反应、躯体运动能力、与非生物体的关系、与环境变换的适应、视觉反应、听觉反应、近处感觉反应、焦虑反应、语言交流、非语言交流、活动、智力功能及总的印象。该量表按照等级评分,1分表示“与年龄相当的行为表现”,2分表示“轻度异常”,3分表示“中度异常”,4分表示“重度异常”。量表总分低于30分可排除孤独症;总分在30~36分之间评定为轻至中度孤独症;总分为37~60分评定为重度孤独症。
1.4 孤独症行为评定量表孤独症行为评定量表(ABC量表)是Krug等[11]于1978年编制的孤独症筛查量表,后来经过国内专家引进并修改用于评估中国孤独症人群的行为特征。此量表由57个项目组成,可分为感觉能力、交往能力、运动能力、语言能力和生活自理能力5个维度,其筛查分为57分,诊断分为67分,所有项目得分相加可得评定总分,得分越高表明症状越严重。
1.5 统计学分析使用Epidata 3.0建立数据库,用SPSS 18.0对数据进行统计学处理与分析。计量资料采用均数±标准差(x±s)表示,计数资料采用例数和百分率(%)表示。采用χ2检验/Fisher精确概率法、独立样本t检验等单因素分析方法比较数据的组间差异,采用线性回归分析儿童孤独症行为的危险因素,当P < 0.05时认为差异有统计学意义。
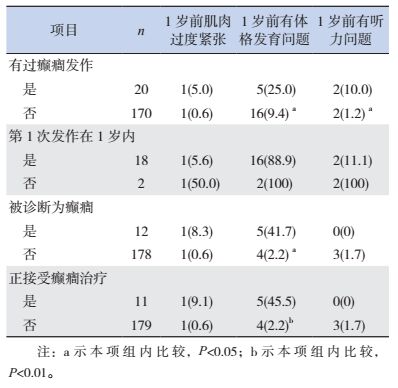
2 结果 2.1 ASD儿童癫癎患病与生长发育状况的关系有过癫癎发作的ASD儿童1岁前出现体格发育问题及听力问题的比例显著增高(P < 0.05);被诊断为癫癎的患儿及正在接受癫癎治疗的患儿1岁前出现体格发育问题的比例显著增高(P < 0.05)。但ASD儿童癫癎患病情况与1岁前肌肉过度紧张问题无明显关系(P > 0.05)。见表 1。
| 表 1 ASD儿童癫癎患病与生长发育的关系[n(%)] |
2.2 孤独症行为反应能力与癫癎患病的关系
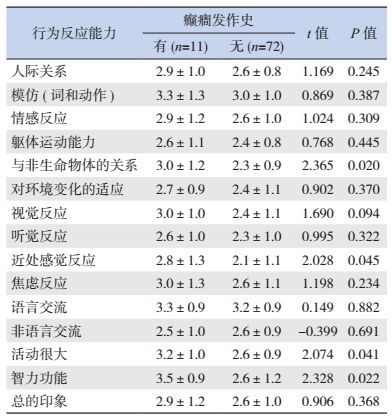
CARS量表评分显示,与无癫癎发作的ASD儿童比较,有过癫癎发作的ASD儿童与非生命物体的关系、近处感觉反应、活动很大以及智力功能的得分显著增高(P < 0.05),见表 2。
| 表 2 孤独症行为反应能力得分与癫癎患病的关系(分) |
2.3 孤独症行为能力与癫癎患病的关系
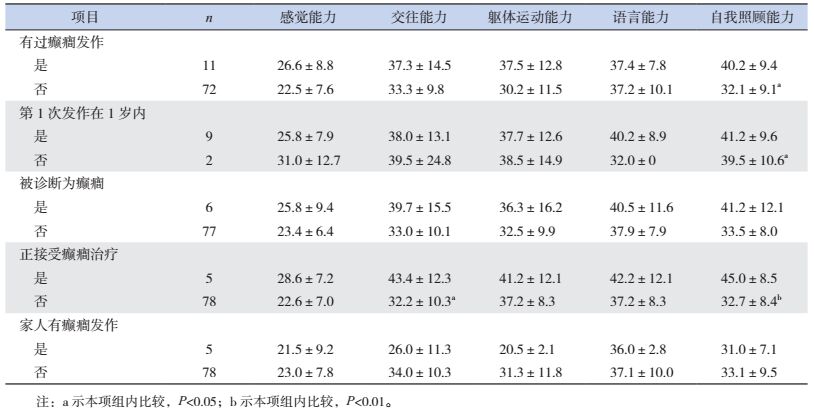
以ABC量表5个维度为因变量,分别以各类癫癎发病状况行独立样本t检验可知,有过癫癎发作的ASD患儿和第1次癫癎发作在1岁以内的ASD患儿其自我照顾能力得分显著增高(P < 0.05);正在接受癫癎治疗的患儿的交往能力和自我照顾能力得分显著增高(P < 0.05),见表 3。
| 表 3 孤独症行为能力得分与癫癎患病的关系(分) |
2.4 癫癎对孤独症行为影响的线性回归分析
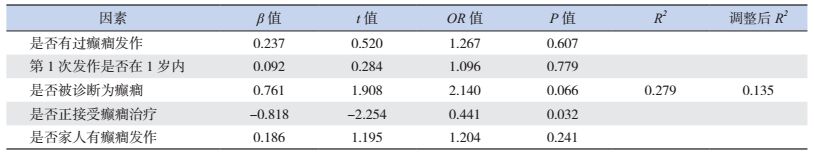
以ABC量表总分为因变量,将是否有过癫癎发作、第1次癫癎发作是否在1岁以内、是否被诊断为癫癎以及是否正接受癫癎治疗、家人是否有过癫癎发作等项目纳入回归方程得到结果见表 4。结果显示,正在接受癫癎治疗对儿童孤独症行为有显著正向影响(OR=0.441,P < 0.05)。
| 表 4 癫癎患病对孤独症行为影响的线性回归分析 |
3 讨论
癫癎与孤独症共患并不罕见,既往文献显示,两者共患率为30%左右[12]。本组病例中,有10.5%的ASD患儿在无发烧的情况下有过癫癎多次发作,其中第1次癫癎发作在1岁以内的患儿占大多数,6.3%的ASD患儿被诊断为癫癎,证明儿童ASD和癫癎患病之间存在关联[13-14]。该研究结果一方面提示家长要提高对ASD儿童癫癎共患病的重视程度,另一方面可以从癫癎的患病情况推断儿童尤其是1岁以内的儿童是否可能患有ASD,为早期确诊ASD提供依据,有助于ASD的早期诊断和治疗。有研究证实,ASD儿童年龄越小,治疗效果越好[15]。因此,通过早期儿童癫癎的患病情况辅助推断儿童ASD患病的可能性具有重要意义。
有国外研究表明,轻度到中度听力丧失的ASD儿童占总体患儿的7.9%[16],而约有四分之一有听力障碍的儿童超过4年以上才被诊断患ASD[17],此外,ASD还与肌肉紧张及超重肥胖等儿童的生长发育有密切关联[18],但对于此类生长发育问题与有癫癎发作的ASD儿童之间的具体关联尚未明确,本研究结果也未表明ASD患儿的肌肉紧张问题与癫癎发作有显著关系。但本研究结果显示,有过癫癎发作的患儿1岁前出现体格发育问题及听力问题的比例更高,即有癫癎发作的ASD儿童较无癫癎发作的患儿生长发育问题更为显著;被诊断为癫癎及正接受癫癎治疗的ASD患儿1岁前出现体格生长发育问题的比例亦更高。因此,对于有癫癎发作的ASD儿童应尤为重视其各类生长发育的不利情况,将ASD患儿的癫癎共患病与生长发育问题相关联看待,做到及早诊断治疗,可从改善患儿体格发育水平,以及入手治疗听力障碍等方面尝试减轻癫癎症状。
普遍认为,儿童癫癎发作与大脑的异常放电有密切联系,与正常儿童相比,ASD儿童的脑电图癫癎样活动率显著增高[19]。有研究指出,低龄儿童的癫癎发作与大龄儿童及成人脑放电模式差别很大,低龄儿童的局灶性癫癎发作普遍较轻微以致难以识别,很难做到早期筛查诊治,常表现为广泛性脑放电模式,常见病因是病理类型的皮质发育不良[20]。患儿父母因缺少相关医学知识,通常仅从肢体躯干等发育程度进行判断儿童在1岁前表现出的生长发育问题,大脑组织的皮质发育不良往往容易被忽视,但发育不良的组织会更易将异常放电较快传导到远端脑区,造成早期ASD儿童反复癫癎发作[21]。
本研究经CARS量表及ABC量表各项目独立样本t检验的结果表明,与未伴发癫癎发作的ASD患儿比较,伴发癫癎发作的ASD患儿在一些行为反应及行为能力上存在显著差异:有过癫癎发作的ASD儿童在与非生命物体的关系、近处感觉反应、活动很大及智力功能上的得分显著高于无癫癎发作的患儿,其自我照顾能力也较差。以上结果说明伴发癫癎发作的患儿多表现出更严重的对物体缺乏兴趣或异样反应、对疼痛或意外伤害缺乏相应反应、活动异常多难以控制、某些技能更加迟钝等情况。正在接受癫癎治疗的患儿在交往能力和自我照顾能力水平上明显较差,推断这一类患儿的癫癎症状更加严重不得不接受治疗,他们在社交方面的能力受损也更加严重,同时在饮食和日常生活方面更需要监护者的照顾。
本研究证实,儿童ASD与癫癎患病存在显著关联,与既往报道一致[22]。有部分研究认为癫癎发作是由大脑皮层神经元结构的变化导致的孤独症伴发的一种躯体性疾患[23],也有研究表明ASD与癫癎共同发生归因于发展的遗传性和病理生理机制,但其作用机制还尚不明确[24]。本研究线性回归分析结果表明,正接受癫癎治疗可能是孤独症行为问题的保护因素,提示在ASD儿童中有癫癎发作现象者应尽早明确诊断,以便尽快实施康复治疗。
此外,有国外研究显示,10岁及以上ASD儿童患癫癎的危险性是低龄儿童的2.35倍,癫癎发作通常与较大年龄、较低的认知水平和较差的适应性及语言机能相关联[25],但本研究发现患儿首次癫癎发作多发生于1岁前,这可能与病例样本的纳入与排除标准相关,比如国外研究习惯性纳入更高身体机能的ASD儿童,并排除有特定缺陷及含特定共患病的ASD儿童,研究对象在一定程度上排除了1岁前已经呈现各类身体发育缺陷的患儿。目前对易患癫癎的ASD患儿的年龄尚无明确界定。有研究表明,2~3岁的ASD儿童多显现出语言和行为退化,同时伴有癫癎样发作[26]。另有病例对照研究显示,ASD儿童癫癎的发病年龄并不存在特异性[27]。因此,对于已经有癫癎发作的患儿开展全方位的诊治和评估,结合其生长发育状况和各类行为问题综合判断,有利于早期发现ASD儿童。
综上,建议在儿童早期ASD临床筛查诊治的过程中,可以通过ASD患儿是否在1岁前出现体格发育问题及听力障碍等身体发育情况推测患儿共患癫癎的可能性。此外,对于交往能力、自我照顾能力及躯体运动能力显著较低的ASD患儿应更加注重早期监测癫癎的患病情况,如果发现ASD患儿出现了抽搐发作等症状,应及时将患儿送到专业的医疗机构确诊是否共患癫癎。一经确诊应尽快着手进行治疗,从而间接改善ASD患儿的患病程度、提高其交往、运动及自我照顾等行为能力水平。同时,鉴于ASD儿童癫癎多次发作会直接与对物体及疼痛的反应能力缺失、较多难以控制的异常活动及较低的智力水平相联系,在有过癫癎发作及正在接受癫癎治疗的普通患儿群体中,家长及医师应对出现以上行为表现及异常反应的患儿及时加以关注,提早对其进行专业的临床ASD的筛查与评估,从ASD患病与否的角度对儿童癫癎发作的原因进行重新界定,结合ASD诊治机构的干预措施调整癫癎治疗方案,以实现临床上早期诊断ASD的同时,达到儿童尤其是1岁前的儿童ASD与癫癎共患病早期筛查与治疗的目的,以获得更好的康复效果。
| [1] | Chugani DC, Chugani HT, Wiznitzer M, et al. Efficacy of low-dose buspirone for restricted and repetitive behavior in young children with autism spectrum disorder:a randomized trial[J]. J Pediatr, 2015, 170 : 45–53. |
| [2] | Bock I, Németh K, Pentelényi K, et al. Targeted next generation sequencing of a panel of autism-related genes identifies an EHMT1 mutation in a Kleefstra syndrome patient with autism and normal intellectual performance[J]. Gene, 2016, 595 (2): 131–141. DOI:10.1016/j.gene.2016.09.027 |
| [3] | Kim E, Kyeong S, Cheon KA, et al. Neural responses to affective and cognitive theory of mind in children and adolescents with autism spectrum disorder[J]. Neurosci Lett, 2016, 621 : 117–125. DOI:10.1016/j.neulet.2016.04.026 |
| [4] | Rodgers J, Wigham S, Mcconachie H, et al. Development of the anxiety scale for children with autism spectrum disorder (ASC-ASD)[J]. Autism Res, 2016, 9 (11): 1205–1215. DOI:10.1002/aur.2016.9.issue-11 |
| [5] | Al-Farsi OA, Al-Farsi YM, Al-Sharbati MM, et al. Stress, anxiety, and depression among parents of children with autism spectrum disorder in Oman:a case-control study[J]. Neuropsychiatr Dis Treat, 2016, 12 : 1943–1951. DOI:10.2147/NDT |
| [6] | Leyfer OT, Folstein SE, Bacalman S, et al. Comorbid psychiatric disorders in children with autism:interview development and rates of disorders[J]. J Autism Dev Disord, 2006, 36 (7): 849–861. DOI:10.1007/s10803-006-0123-0 |
| [7] | Wang G, Liu Z, Xu G, et al. Sleep disturbances and associated factors in Chinese children with autism spectrum disorder:a retrospective and cross-sectional study[J]. Child Psychiatry Hum Dev, 2016, 47 (2): 248–258. DOI:10.1007/s10578-015-0561-z |
| [8] | Mannion A, Leader G, Healy O. An investigation of comorbid psychological disorders, sleep problems, gastrointestinal symptoms and epilepsy in children and adolescents with autism spectrum disorder[J]. Res Autism Spectr Disord, 2013, 7 (1): 35–42. DOI:10.1016/j.rasd.2012.05.002 |
| [9] | Poling A, Methot LL, Lesage MG. Diagnostic and Statistical Manual of Mental Disorders (DSM-IV)[M]. Washington, D.C: American Psychiatric Association, 2013: 4189. |
| [10] | Schopler E, Reichler R, Devellis RF, et al. Toward objective classification of childhood autism:Childhood Autism Rating Scale (CARS)[J]. J Autism Dev Disord, 1980, 10 (10): 91–103. |
| [11] | Krug DA, Arick J, Almond P. Behavior checklist for identifying severely handicapped individuals with high levels of autistic behavior[J]. J Child Psychol Psychiatry, 1980, 21 (3): 221–229. DOI:10.1111/jcpp.1980.21.issue-3 |
| [12] | 秦炯, 韩颖. 儿童神经科临床应关注精神行为问题[J]. 北京大学学报 (医学版), 2013, 45 (2): 174–176. |
| [13] | Deonna T, Roulet E. Autistic spectrum disorder:evaluating a possible contributing or causal role of epilepsy[J]. Epilepsia, 2006, 47 (Suppl): 79–82. |
| [14] | Clarke DF, Roberts W, Daraksan M, et al. The prevalence of autistic spectrum disorder in children surveyed in a tertiary care epilepsy clinic[J]. Epilepsia, 2005, 46 (12): 1970–1977. DOI:10.1111/epi.2005.46.issue-12 |
| [15] | 邹小兵. 孤独症的治疗[J]. 中国实用儿科杂志, 2008, 23 (3): 170–172. |
| [16] | Rosenhall U, Nordin V, Sandström M, et al. Autism and hearing loss[J]. J Autism Dev Disord, 1999, 29 (5): 349–357. DOI:10.1023/A:1023022709710 |
| [17] | Jure R, Rapin I, Tuchman RF. Hearing-impaired autistic children[J]. Dev Med Child Neurol, 1991, 33 (12): 1062–1072. |
| [18] | Barnhill K, Gutierrez A, Ghossainy M, et al. Growth status of children with autism spectrum disorder:a case-control study[J]. J Hum Nutr Diet, 2017, 30 (1): 59–65. DOI:10.1111/jhn.2017.30.issue-1 |
| [19] | Buckley AW, Holmes GL. Epilepsy and autism[J]. Cold Spring Harb Perspect Med, 2016, 6 (4): a022749. DOI:10.1101/cshperspect.a022749 |
| [20] | 邵晓秋. 儿童癫痫发作的电-临床特征及其诊断定位价值[J]. 中国实用儿科杂志, 2016, 31 (1): 26–31. |
| [21] | Turkdogan D, Duchowny M, Resnick T, et al. Subdural EEG patterns in children with taylor-type cortical dysplasia:comparison with nondysplastic lesions[J]. J Clin Neurophysiol, 2005, 22 (1): 37–42. DOI:10.1097/01.WNP.0000150887.61562.26 |
| [22] | 李碧清, 袁萍. 孤独症与癫痫的相关性[J]. 中国保健营养 (中旬刊), 2012, 23 (12): 263–264. |
| [23] | Oblak AL, Rosene DL, Kemper TL, et al. Altered posterior cingulate cortical cyctoarchitecture, but normal density of neurons and interneurons in the posterior cingulate cortex and fusiform gyrus in autism[J]. Autism Res, 2011, 4 (3): 200–211. DOI:10.1002/aur.188 |
| [24] | Tuchman R, Cuccaro M, Alessandri M. Autism and epilepsy:historical perspective[J]. Brain Dev, 2010, 32 (9): 709–718. DOI:10.1016/j.braindev.2010.04.008 |
| [25] | Viscidi EW, Triche EW, Pescosolido MF, et al. Clinical characteristics of children with autism spectrum disorder and co-occurring epilepsy[J]. PLoS One, 2013, 8 (7): e67797. DOI:10.1371/journal.pone.0067797 |
| [26] | Canitano R, Luchetti A, Zappella M. Epilepsy, electroencephalographic abnormalities, and regression in children with autism[J]. J Child Neurol, 2005, 20 (1): 27–31. DOI:10.1177/08830738050200010401 |
| [27] | Jokiranta E, Sourander A, Suominen A, et al. Epilepsy among children and adolescents with autism spectrum disorders:a population-based study[J]. J Autism Dev Disord, 2014, 44 (10): 2547–2557. DOI:10.1007/s10803-014-2126-6 |
 2017, Vol. 19
2017, Vol. 19