2. 中国医科大学附属盛京医院检验科, 辽宁 沈阳 110004
发热是被感染患者最常见的一种临床症状,是人体对于炎症刺激的一种正常反应。发热会造成患者基础代谢率上升,呼吸及心率加快,消化功能减弱,高热也会对神经系统造成一定的不良影响[1]。对于低龄儿童,高热易引起抽搐,这可能与小儿中枢神经系统尚未发育成熟有关。因此,退热疗法广泛应用于危重症感染患者,尤其是儿童危重症患者[2]。然而,发热也是机体对抗感染的一种自我保护机制,发热会抑制细菌生长,促进抗体及细胞因子的合成,激活T细胞、中性粒细胞及巨噬细胞,有助于感染的控制[1]。有研究表明,对于感染或非感染因素所致的成人发热患者,住院期间盲目给予退热处理,会增加患者病死率[3-4]。
目前关于发热对儿童细菌性血流感染患者影响的报道很少。本研究回顾性地选取了我院儿科重症监护病房 (PICU) 近8年的病例,筛选出符合细菌性血流感染的病例,研究患儿入院时的体温情况与其预后的关系,希望能对此类患儿的治疗及预后评估起到一定的帮助。
1 资料与方法 1.1 研究对象回顾性统计2008年9月至2016年9月间入住中国医科大学盛京医院PICU所有诊断为脓毒症的病例资料。脓毒症诊断标准参照2012年国际脓毒症诊疗指南[5]和2006年国际儿科脓毒症会议标准[6]。筛选出符合纳入标准的细菌性血流感染患儿作为研究对象:入院48 h内血细菌培养至少1次提示结果阳性,伴有或不伴有病灶部位体液培养阳性,且培养致病菌为细菌。有以下情况之一者被排除:(1) 近1个月有住院手术史;(2) 外伤患儿;(3) 颅脑手术患儿及其他颅脑损伤患儿;(4) 需透析或需长期在护理单元内监护的患儿;(5) 长期留置静脉导管或其他经皮置管患儿。
1.2 细菌培养及药敏试验采用法国生物梅里埃API系统、VITEK 2 Compact系统 (BioMérieux, 法国) 进行菌株鉴定。采用琼脂纸片扩散法 (K-B法) 进行体外药敏试验,并严格按照美国临床和实验室标准化研究所 (Clinical and Laboratory Standard Institute, CLSI) 推荐的方法操作[7]。质控菌株为PAATCC27853。药敏试验结果的判断分为3级:敏感、中介、耐药。
1.3 体温资料收集及分组对于纳入研究的病例,回顾性分析其体温单记录。体温测量采用肛温测量方法,每4 h记录1次,由PICU重症专科护士负责记录。正常肛温温度范围设定为36.5~37.5℃。根据入院48 h内患儿的最高体温情况,将纳入病例分为5组,分别为 < 36.5℃组,36.5℃~组,37.5℃~组,38.5℃~组和39.5℃~组。统计各组病例的一般资料,包括性别、年龄、血培养结果、住院时间及预后等资料。并选取36.5℃~组作为正常对照组,与各组进行比较,分析患儿入院48 h内的发热程度与其预后有无相关性。
1.4 统计学分析采用SAS 9.3统计学软件,非正态分布的计量资料以中位数 (四分位数间距)[P50(P25,P75)]表示,组间比较采用Kruskal-Wallis H检验。计数资料采用百分率 (%) 表示,组间比较采用卡方检验或Fisher确切概率检验。P < 0.05为差异有统计学意义。多组间率的两两比较采用卡方分割检验,调整检验水准为0.00625。
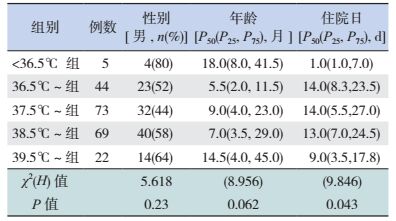
2 结果 2.1 各组病例一般资料的比较根据纳入标准,共计213例患儿纳入研究。其中男性113例 (53.1%),女性100例 (46.9%);中位年龄为7个月 (范围3~26.5个月)。平均住院日17.9 d。死亡48例 (22.5%)。213例患儿中,体温正常组 (36.5℃~组)44例 (20.7%),体温降低组 ( < 36.5℃组)5例 (2.3%),体温升高组 (37.5℃~组,38.5℃~组和39.5℃~组)164例 (77.0%)。5组间性别及年龄的比较差异无统计学意义,住院日比较差异有统计学意义 (P < 0.05),见表 1。
| 表 1 各组病例一般资料 |
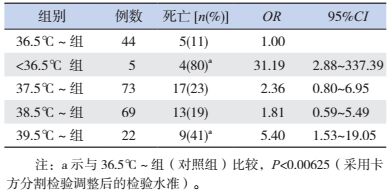
2.2 各组病死率的比较
213例患儿中,居细菌性血流感染病原前5位的病原体分别是肺炎链球菌 (46例,21.6%)、大肠埃希菌 (33例,15.5%)、化脓性链球菌 (27例,12.7%)、绿脓杆菌 (23例,10.8%)、金黄色葡萄球菌 (21例,9.9%)。病死率最高的为绿脓杆菌感染者,共死亡12例,主要集中于38.5℃~组及39.5℃~组。
Fisher确切概率法检验显示,5组病死率比较差异有统计学意义 (P=0.0031),其中与36.5℃~组相比, < 36.5℃组及39.5℃~组病死率显著增高,差异有统计学意义 (P < 0.00625;OR分别为31.19和5.40),而其他两组 (37.5℃~组和38.5℃~组) 与对照组比较差异无统计学意义,见表 2。
| 表 2 各组病死率的比较 |
3 讨论
目前儿童脓毒症诊断标准中,体温是其中一项重要诊断依据[6]。细菌性血流感染患儿在PICU占有较大比例,其绝大部分入院时均伴有发热,但低体温或发热程度对于细菌性血流感染患儿的预后有无影响并无太多系统研究。本研究回顾性分析了近8年我院PICU诊断为脓毒症的患儿资料,结合细菌培养阳性结果及其他排除条件,筛选出符合细菌性血流感染诊断标准的病例进行研究。由于入院48 h后的发热可能与院内获得性感染相关[8],故本研究中患儿最高体温的选取及血细菌培养的阳性结果都必须是在入院48 h内。并根据入院48 h内最高体温将病例分为5组,每组体温跨度为1℃,且将肛温测量温度在36.5~37.5℃间的病例作为对照组,将其他各组的病死率与之比较。
在所有213例病例中,发现造成PICU儿童血流感染的主要致病菌仍然是肺炎链球菌、大肠埃希菌、化脓性链球菌、金黄色葡萄球菌等儿童社区获得性肺炎中的常见致病菌[9]。但本组病例中,除检出以上常见致病菌外,还检出绿脓杆菌23例,主要集中于38.5℃~组及39.5℃~组,这可能与PICU收治危重患儿的倾向性有关,也说明绿脓杆菌感染所致脓毒症患儿通常会出现高热症状。23例绿脓杆菌感染患儿中,死亡12例,病死率为52%,其在PICU的常见性及高病死率需引起临床关注[10-11]。
Lee等[4]在2012年发表了一篇成人ICU发热程度以及退热药物使用与患者预后关系的多中心前瞻性观察研究,发现非脓毒症所致发热患者中,高热 (体温≥39.5℃) 与病死率上升有关,但在脓毒症所致发热患者中,发热程度与病死率的升高无统计学意义。与成人不同,高热更容易造成儿童心肺功能及神经系统损伤或衰竭。在细菌性血流感染儿童患者中,发热作为机体感染后的一种正常反应,有助于抑制细菌生长,但高热可能预示着更为严重的感染和更加不良的预后。本研究中,39.5℃~组患儿的病死率为41%,远高于对照组 (OR=5.40),提示入院48 h内高热 ( > 39.5℃) 患儿死亡的风险会增加。因此,高热应作为临床中细菌性血流感染患儿预后的一个不良因素加以重视。在低体温组的5例病例中,4例死亡,该组病例病死率高达80%(OR=31.19),提示入院48 h内低体温会显著增加患儿死亡的危险。有报道显示,在细菌性血流感染患儿中,低体温往往预示着循环功能或脑功能衰竭,预后较差[12]。
虽然发热有助于感染病原的清除和机体抗体的合成,但本研究中体温介于37.5~39.5℃的发热组与体温正常组间的病死率比较差异无统计学意义,不能证明发热对细菌性血流感染儿童有保护作用。国外研究关于发热对成人患者预后的影响存在一些争议。Laupland等[12-13]于2008年及2012年发表的两篇文章均未发现发热与成人ICU患者的病死率有明显相关性。但Young等[14]于2012年发表的文章发现发热对于非感染患者有增加病死率的风险,而对于感染患者却有降低病死率的作用。由于病死率受多种因素影响,故发热在细菌性血流感染儿童中的利弊,仍需要大样本、多中心及前瞻性的研究加以论证。
国外在进行发热对成人重症患者预后影响研究的同时,也对于合理使用退热药物进行了一些系统研究,并提出了一些观点。Lee等[4]的研究表明非甾体抗炎药及扑热息痛的使用对于脓毒症患者有增加病死率的风险,而对于非感染所致发热患者,则可能降低病死率。然而,一些研究却没有得出类似结论[15-16]。临床工作中,因发热就诊的患儿占绝大多数,由于儿童群体的特殊性,退热药物也有一定的不良反应,如何更为合理、安全地使用退热药物,既能有效地发挥发热的积极作用,又能尽可能避免长期高热所导致的不良风险,需要更多的基础和临床研究给予支持及指导。
综上,本研究显示,儿童细菌性血流感染患者绝大部分均有发热症状,入院48 h内肛温最高温度低于36.5℃或高于39.5℃的患儿病死率会明显升高,而肛温介于36.5℃~39.5℃之间者病死率与体温正常者比较无明显差异。
| [1] | 张伟华. 发热[M]//金惠铭, 王建枝, 殷莲华, 等. 病理生理学. 北京: 人民卫生出版社, 2013: 103-113. |
| [2] | Young P, Saxena M, Eastwood GM, et al. Fever and fever management among intensive care patients with known or suspected infection:a multicentre prospective cohort study[J]. Crit Care Resusc, 2011, 13 (2): 97–102. |
| [3] | Eyers S, Weatherall M, Shirtcliffe P, et al. The effect on mortality of antipyretics in the treatment of influenza infection:systematic review and meta-analysis[J]. J R Soc Med, 2010, 103 (10): 403–411. DOI:10.1258/jrsm.2010.090441 |
| [4] | Lee BH, Inui D, Suh GY, et al. Association of body temperature and antipyretic treatments with mortality of critically ill patients with and without sepsis:multi-centered prospective observational study[J]. Crit Care, 2012, 16 (1): 450. |
| [5] | Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock:2012[J]. Crit Care Med, 2013, 41 (2): 580–637. DOI:10.1097/CCM.0b013e31827e83af |
| [6] | Goldstein B, Giroir B, Randolph A. International pediatric sepsis consensus conference:definitions for sepsis and organ dysfunction in pediatrics[J]. Pediatr Crit Care Med, 2005, 6 (1): 2–8. DOI:10.1097/01.PCC.0000149131.72248.E6 |
| [7] | Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Twenty-Third Informational Supplement[M]. Washington, DC: Clinical & Laboratory Standards Institute, 2013: M02-A10. |
| [8] | American Thoracic Society; Infectious Diseases Society of America. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia[J]. Am J Respir Crit Care, 2005, 171 (4): 388–416. DOI:10.1164/rccm.200405-644ST |
| [9] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南 (2013修订)[J]. 中华儿科杂志, 2013, 51 (10): 745–747. DOI:10.3760/cma.j.issn.0578-1310.2013.10.006 |
| [10] | Yang MA, Lee J, Choi EH, et al. Pseudomonas aeruginosa bacteremia in children over ten consecutive years:analysis of clinical characteristics, risk factors of multi-drug resistance and clinical outcomes[J]. J Korean Med Sci, 2011, 26 (5): 612–618. DOI:10.3346/jkms.2011.26.5.612 |
| [11] | Huang YC, Lin TY, Wang CH. Community-acquired Pseudomonas aeruginosa sepsis in previously healthy infants and children:analysis of forty-three episodes[J]. Pediatr Infect Dis J, 2002, 21 (11): 1049–1052. DOI:10.1097/00006454-200211000-00015 |
| [12] | Laupland KB, Zahar JR, Adrie C, et al. Determinants of temperature abnormalities and influence on outcome of critical illness[J]. Crit Care Med, 2012, 40 (1): 145–151. DOI:10.1097/CCM.0b013e31822f061d |
| [13] | Laupland KB, Shahpori R, Kirkpatrick AW, et al. Occurrence and outcome of fever in critically ill adults[J]. Crit Care Med, 2008, 36 (5): 1531–1535. DOI:10.1097/CCM.0b013e318170efd3 |
| [14] | Young PJ, Saxena M, Beasley R, et al. Early peak temperature and mortality in critically ill patients with or without infection[J]. Intensive Care Med, 2012, 38 (3): 437–444. DOI:10.1007/s00134-012-2478-3 |
| [15] | Morris PE, Promes JT, Guntupalli KK, et al. A multi-center, randomized, double-blind, parallel, placebo-controlled trial to evaluate the efficacy, safety, and pharmacokinetics of intravenous ibuprofen for the treatment of fever in critically ill and non-critically ill adults[J]. Crit Care, 2010, 14 (3): R125. DOI:10.1186/cc9089 |
| [16] | Niven DJ, Stelfox HT, Leger C, et al. Assessment of the safety and feasibility of administering antipyretic therapy in critically ill adults:a pilot randomized clinical trial[J]. J Crit Care, 2013, 28 (3): 296–302. DOI:10.1016/j.jcrc.2012.08.015 |
 2017, Vol. 19
2017, Vol. 19