晚期早产儿(late preterm infant, LPI)是指胎龄34~36+6周的早产儿,占早产儿总数的70%[1],是早产儿中胎龄相对较大、发育相对较成熟的部分,但各类疾病的发病率仍明显高于足月儿[2-6],研究表明LPI发生脑瘫的可能性是足月儿的3倍[7]。Talge等[8]发现LPI 6岁时智商较足月儿略低。Moster等[9]发现挪威LPI发生脑瘫和精神发育迟滞的概率分别是足月儿的2.7倍和1.6倍。
早产儿脑病(encephalopathy of prematurity, EOP)是指以脑白质损伤为主的一类早产儿脑损伤,是导致早产儿智能损伤和远期运动功能障碍的主要原因。一直以来,EOP研究重点集中于胎龄 < 32周的早产儿,对LPI发生脑病的研究比较少,本文主要以磁共振影像(MRI)为依据研究高危LPI脑病发生情况,并评价磁共振影像学特点。
1 资料与方法 1.1 研究对象2009年1月至2012年12月在本院新生儿科住院治疗的LPI,因存在脑损伤高危因素(高危LPI),需要做头颅MRI检查。所有研究对象均完成头颅MRI检查,共1 007例,其中男612例,女395例。胎龄34~34+6周360例(35.7%),35~35+6周310例(30.8%),36~36+6周337例(33.5%),平均胎龄35.0±0.8周。出生体重分布于10 25~4 980 g之间,平均2 335±557 g。
根据本院新生儿科诊疗常规确定,LPI有下列脑损伤高危因素之一者需检查头颅MRI:① 有宫内窘迫,复苏抢救史,生后1 min或5 min Apgar评分≤5分;② 临床拟诊宫内感染;③ 需要机械通气和/或经鼻持续气道正压通气(nCPAP)使用 > 72 h;④ 各类休克;⑤ 血流动力学紊乱的动脉导管未闭(PDA)发生心功能不全;⑥ 有神经系统表现,如意识改变、抽搐、颅高压征、眼征、肌力和肌张力异常、神经反射异常等;⑦ 发生败血症、坏死性小肠结肠炎(NEC)或化脓性脑膜炎;⑧ 低血糖;⑨ 有胆红素脑病征象者或总胆红素峰值 > 400 μmol/L;⑩ 头颅超声或CT检查发现异常。
1.2 研究方法(1) MRI检查方法:在纠正胎龄足月时完成颅脑MRI检查,经监护人知情同意,病情平稳,镇静后完成检查。MRI机型为西门子AVANTO1.5T超导型MR扫描系统。检查前15~30 min镇静(鲁米那5~10 mg/kg静注或水合氯醛30 mg/kg口服或灌肠)所有患儿都进行了常规MRI(T1WD和T2WD)序列和弥散加权成像(DWI)检查。MRI影像片由2名中级以上儿科影像科医师进行分析,对不同结果再进行复读讨论后统一诊断。
(2) 病史收集:对于所有病例采集临床信息,主要包括:① 产前产时病史:胎数、胎次、妊娠疾病(妊娠高血压,妊娠糖尿病)、宫内窘迫、产前激素使用、孕周、出生体重、性别、Apgar评分、出生方式、胎膜、羊水、脐带等情况、生后窒息复苏病史(正压通气、气管插管、胸外按压、肾上腺素应用);② 产后新生儿期疾病:呼吸、循环、消化、泌尿、神经、内分泌、感染等系统疾病(败血症,呼吸衰竭,NEC等)和相应治疗情况(呼吸支持的使用及持续时间)。
(3) EOP的MRI诊断标准:① 脑白质软化后囊腔形成;② 脑白质、丘脑、基底节、胼胝体等部位信号改变:表现为T1WI高信号,T2WI低信号或等信号,DWI高信号或正常信号;③ 侧脑室不规则扩大、白质容积减少或胼胝体变薄;④ 内囊后肢未髓鞘化或髓鞘化不明显;以上几项单独存在或多个同时存在;除外脑室内或脑实质出血、脑梗塞、脑畸形、核黄疸等病例[10-11]。
1.3 统计学分析应用SPSS 22.0软件包进行统计学分析,计量资料采用均数±标准差(x±s)表示,组间比较采用t检验。计数资料以率(%)表示,组间比较采用χ2检验。危险因素分析采用Logistic回归分析,P < 0.05为差异有统计学意义。
2 结果 2.1 LPI脑病检出率完成头颅MR检查的高危LPI共1007例,其中313例(31.1%)显示EOP影像表现,其中男性患儿EOP检出率为30.7%(188/612),女性患儿EOP检出率为31.6%(125/395),性别差异无统计学意义(P > 0.05)。EOP患儿平均出生体重2 385±575 g(1 045~4 415 g),平均胎龄35.0±2.8周。非EOP组平均出生体重2 304±567 g(1 025~4 980 g),平均胎龄34.9±0.1周,两组差异无统计学意义。高危LPI患儿MRI检查时间95%集中于4~44 d,平均15 d,其中检出EOP患儿MRI检查平均日龄14 d(纠正胎龄37周)。
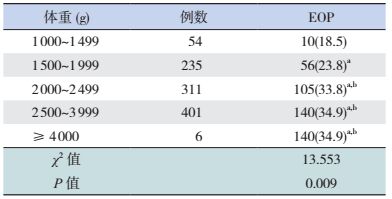
不同胎龄EOP的检出率差异无统计学意义。随着出生体重的增加,EOP检出率呈增高趋势,其中出生体重≥2 000 g的高危LPI患儿EOP检出率明显高于体重 < 2 000 g的高危患儿(P < 0.05)。见表 1,2。
| 表 1 不同胎龄高危LPI患儿EOP检出率 [n(%)] |
| 表 2 不同出生体重高危LPI患儿EOP检出率 [n(%)] |
2.2 EOP患儿MRI表现
本研究中,EOP的MRI表现以脑白质损伤为主(76.7%,240/313),其中脑室周围白质损伤112例次(35.8%),双侧脑室周围白质损伤57例次(18.2%)。皮层下白质损伤174例次(55.6%),其中,顶叶83例次(26.5%),枕叶21例次(6.7%),额叶53例次(16.9%),颞叶17例次(5.4%)。另外基底节损伤81例次(25.9%),小脑8例次(2.6%),丘脑6例次(1.9%),胼胝体9例次(2.9%)。52例(16.6%)白质损伤同时合并神经元/轴突病变(基底节、尾状核、小脑、丘脑等部位),或出血性脑损伤。LPI脑病中,明显囊性改变56例次(17.9%)。
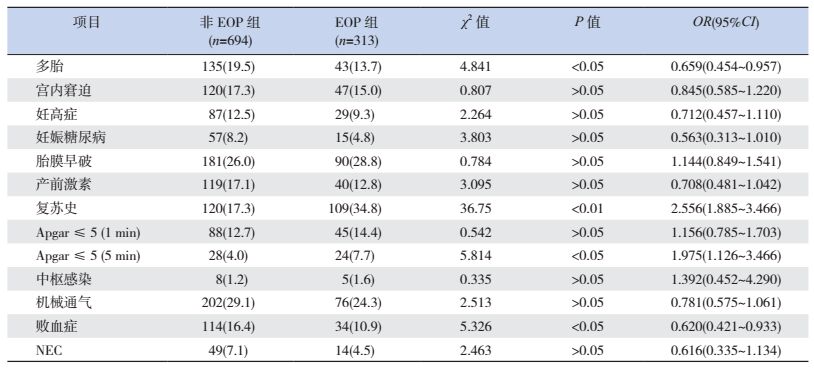
2.3 高危LPI患儿发生EOP的危险因素分析将LPI患儿MRI检查结果分为EOP组与非EOP组,EOP组313例,非EOP组694例。单因素分析显示,复苏史及5 min Apgar评分≤5分是LPI EOP的危险因素。Logistic回归分析显示:复苏史是EOP发生的独立危险因素(RR=2.482, 95%CI=1.806~3.412),P < 0.001)。而5 min Apgar评分≤5分并非LPI脑病的独立危险因素(P=0.533)。见表 3。
| 表 3 高危LPI患儿EOP单因素分析 [n(%)] |
|
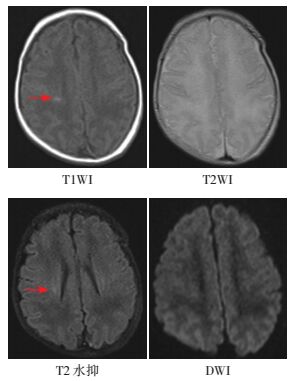
图 1 脑室周围白质损伤病例T1、T2、T2水抑、DWI表现 患儿胎龄36+2周,宫内窘迫,紧急剖宫产,1 min Apgar评分4分,5 min Apgar评分8分,气管插管,加压给氧。生后11 d(纠正胎龄37+6周)头部MRI提示脑室周围白质损伤,右半卵圆中心小片状T1WI高信号,T2水抑制信号隐约可见,T2,DWI不明显(箭头所示)。 |
|
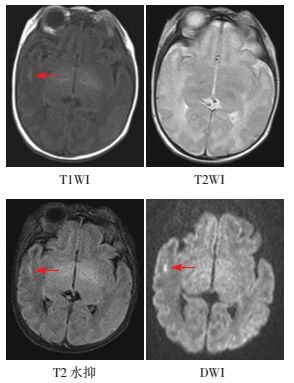
图 2 皮层下白质损伤病例T1、T2、T2水抑、DWI表现 患儿胎龄35+6周,无明确高危因素。生后5 d(纠正胎龄36+4周)头部MRI提示:皮层下白质损伤,右侧颞叶条状T1WI,DWI高信号,T2水抑制信号隐约可见(箭头所示)。 |
3 讨论
国外研究显示LPI已占据了早产儿总数的72%[12-13],国内研究显示LPI占早产儿的60.1%[14]。作为早产儿群体中比重最大,发生率逐年上升的群体,近些年来LPI脑损伤引起了越来越多的关注。
本研究发现高危LPI患儿中EOP检出率为31.1%,与国内外文献报道相似。Petrini等[15]研究显示32至36周早产儿,EOP发生率为16%~20%,LPI发生脑瘫的概率是足月儿的3倍。国内研究发现LPI患儿EOP发生率明显高于足月儿[14]。陈丹等[16]研究发现277例LPI中42.6%存在脑白质损害。本研究发现LPI脑病的发生与胎龄无明确的相关性,但随着出生体重增加,脑病检出率增高,分析原因可能与脑病高危因素的叠加有关。
本研究发现高危LPI患儿的EOP类型以脑白质病变为主,双侧脑室周围白质损伤占18.2%,囊性损伤占17.9%,与既往研究相符[17]。陈丹等[16]发现LPI患儿脑白质损害占脑损伤的71.9%,脑室周围白质损伤双侧较多。
缺血缺氧对神经系统的损伤易导致早产儿脑病的发生。复苏史与Apgar评分两者均为缺血缺氧的指标。本研究发现复苏史是EOP的独立危险因素,因此病史中详细询问复苏措施,对于神经系统预后的判断很重要。
LPI脑病临床症状多不明显。如何识别和确诊早产儿脑病,对早期治疗干预较为重要。MRI无创无辐射,对于发现点状损伤及脑损伤的程度更精确,更具优势。国内目前缺少统一的脑损伤的MRI诊断标准,陈丹等[16]根据病理损伤特点,将DWI与T1、T2综合后分为:局灶性、广泛性与弥漫性。2003年Inder等[18]通过对脑白质异常信号的性质和程度,脑室周围白质萎缩程度,囊腔数量,脑室扩张程度及胼胝体缩小,内囊后肢等处髓鞘化程度共5个方面进行定量分析,评估早产儿脑白质损伤的程度及预后。
本研究中,所有患儿均在纠正胎龄至足月时完善头颅MRI检查,平均检查时间在患儿生后2周。陈丹等[16]曾建议选择在生后2周完善扩散加权成像DWI及常规MRI检查,以早期发现病变。动物研究显示DWI能及时反映细胞内水分子的运动状态,尤其是早期细胞内毒性水肿,损伤12~24 h即出现高信号[20]。
本研究尚存在不足,如对于不符合MRI检查规定的LPI并未进行完善MRI,未能涵盖所有早产儿进行危险因素分析。此外高危因素的叠加也使得危险因素分析显得较为困难,可能出现数据的偏倚,使得部分分组EOP检出率增高。
综上,本研究发现LPI发生EOP的概率并不低,这是造成神经系统相关伤残的主要原因。头颅MRI检查对LPI脑病的诊断有较大价值[21-22]。接诊LPI时,详细询问客观的复苏史尤为重要。
| [1] | Martin JA, Hamilton BE, Osterman MJ, et al. Births:Final Data for 2015[J]. Natl Vital Stat Rep, 2017, 66 (1): 1. |
| [2] | Harijan P, Boyle EM. Health outcomes in infancy and childhood of moderate and late preterm infants[J]. Semin Fetal Neonatal Med, 2012, 17 (3): 159–162. DOI:10.1016/j.siny.2012.02.002 |
| [3] | Mercuri E, Ricci D, Romeo DM. Neurological and visual assessments in very and late low-risk preterm infants[J]. Early Hum Dev, 2012, 88 (Suppl 1): S31–S33. |
| [4] | Teune MJ, Bakhuizen S, Gyamfi Bannerman C, et al. A systematic review of severe morbidity in infants born late preterm[J]. Am J Obstet Gynecol, 2011, 205 (4): 374. |
| [5] | McGowan JE, Alderdice FA, Holmes VA, et al. Early childhood development of late-preterm infants:a systematic review[J]. Pediatrics, 2011, 127 (6): 1111–1124. DOI:10.1542/peds.2010-2257 |
| [6] | 殷张华, 钱继红, 王蓓, 等. 晚期早产儿近期并发症及智能发育前瞻性研究[J]. 中国新生儿科杂志, 2015, 30 (2): 112–116. |
| [7] | Shapiro-Mendoza CK, Tomashek KM, Kotelchuck M, et al. Risk factors for neonatal morbidity and mortality among "healthy, " late preterm newborns[J]. Semin Perinatol, 2006, 30 (2): 54–60. DOI:10.1053/j.semperi.2006.02.002 |
| [8] | Talge NM, Holzman C, Wang J, et al. Late-preterm birth and its association with cognitive and socioemotional outcomes at 6 years of age[J]. Pediatrics, 2010, 126 (6): 1124–1131. DOI:10.1542/peds.2010-1536 |
| [9] | Moster D, Lie RT, Markestad T. Long-term medical and social consequences of preterm birth[J]. N Engl J Med, 2008, 359 (3): 262–273. DOI:10.1056/NEJMoa0706475 |
| [10] | 《新生儿神经病学论坛》专家组. 早产儿脑白质损伤诊断、防治与综合管理的专家组意见[J]. 中国新生儿科杂志, 2015, 30 (3): 175–177. |
| [11] | Woodward LJ, Anderson PJ, Austin NC, et al. Neonatal MRI to predict neurodevelopmental outcomes in preterm infants[J]. N Engl J Med, 2006, 355 (7): 685–694. DOI:10.1056/NEJMoa053792 |
| [12] | Shapiro-Mendoza CK, Lackritz EM. Epidemiology of late and moderate preterm birth[J]. Semin Fetal Neonatal Med, 2012, 17 (3): 120–125. DOI:10.1016/j.siny.2012.01.007 |
| [13] | Martin JA, Hamilton BE, Sutton PD, et al. Births:final data for 2008[J]. Natl Vital Stat Rep, 2010, 59 (1): 1, 3–71. |
| [14] | 张莹, 赫英东, 陈倩. 晚期早产的危险因素及围产期并发症分析[J]. 中华围产医学杂志, 2014 (6): 379–383. |
| [15] | Petrini JR, Dias T, McCormick MC, et al. Increased risk of adverse neurological development for late preterm infants[J]. J Pediatr, 2009, 154 (2): 169–176. DOI:10.1016/j.jpeds.2008.08.020 |
| [16] | 陈丹, 毛健, 李娟, 等. 晚期早产儿脑白质损伤临床特点及磁共振影像学发现[J]. 中国当代儿科杂志, 2010, 12 (5): 321–326. |
| [17] | Woodward LJ, Clark CA, Bora S, et al. Neonatal white matter abnormalities an important predictor of neurocognitive outcome for very preterm children[J]. PLoS One, 2012, 7 (12): e51879. DOI:10.1371/journal.pone.0051879 |
| [18] | Inder TE, Wells SJ, Mogridge NB, et al. Defining the nature of the cerebral abnormalities in the premature infant:a qualitative magnetic resonance imaging study[J]. J Pediatr, 2003, 143 (2): 171–179. DOI:10.1067/S0022-3476(03)00357-3 |
| [19] | Roelants-van RAM, Groenendaal F, Beek FJ, et al. Parenchymal brain injury in the preterm infant:comparison of cranial ultrasound, MRI and neurodevelopmental outcome[J]. Neuropediatrics, 2001, 32 (2): 80–89. DOI:10.1055/s-2001-13875 |
| [20] | Sie LT, Hart AA, van Hof J, et al. Predictive value of neonatal MRI with respect to late MRI findings and clinical outcome. A study in infants with periventricular densities on neonatal ultrasoun[J]. Neuropediatrics, 2005, 36 (2): 78–89. DOI:10.1055/s-2005-837574 |
| [21] | 鲁利群, 母得志. 晚期早产儿的神经发育[J]. 中华实用儿科临床杂志, 2014, 29 (2): 144–146. |
| [22] | Romeo DM, Luciano R, Corsello M, et al. Neonatal neurological examination of late preterm babies[J]. Early Hum Dev, 2013, 89 (8): 537–545. DOI:10.1016/j.earlhumdev.2013.01.002 |
 2017, Vol. 19
2017, Vol. 19