黄芩为唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根,在中国拥有数千年的药用植物历史。在传统中药理论中,黄芩是清热燥湿药的代表药,药性苦寒,主归肺、胆、脾、胃、大肠经,具有清热燥湿、泻火解毒、止血、安胎之功效,也因此在临床中广泛应用于炎症性疾病、发热、肝炎、黄疸及高血压等的治疗[1-3],在数千年的临床应用中显示了可靠的安全性和稳定的临床疗效。黄芩苷(baicalin)为黄酮类化合物,是中药黄芩的主要有效成分,为淡黄色粉末,无臭,味苦。在现代药物研究中,黄芩苷具有抗癌、抗炎、抗氧化的作用,而黄芩苷对神经系统疾病的影响尚未见报道。
注意缺陷多动障碍(attention deficit hyperactivity disorder, ADHD)又称儿童多动症,是儿童时期常见的精神神经异常性疾病,全球发病率约为5.9%,且有不断上升的趋势[4]。本病的发病机制尚未明确,多巴胺(dopamine, DA)缺陷理论当前在国际学术界认可度最高[5]。关于DA缺陷的形成原因,脑内DA转运体(dopamine transporter, DAT)功能的异常在学界已基本形成共识[6],而近来的研究中发现,腺苷酸环化酶(AC)/环磷酸腺苷(cAMP)/蛋白激酶A(PKA)通路在脑内DA缺陷的形成及ADHD的发病过程中地位特殊[7]。研究表明,D2RS被突触间隙DA激活后,能够通过抑制AC/cAMP/PKA通路反馈性地抑制DA合成[8-9],使DA的合成速度降低,最终导致脑内DA缺陷状态的形成。AC/cAMP/PKA信号通路的活化情况成为研究DA缺陷及ADHD发病机制的另一重要方向[10-11]。在DA神经元中,AC/cAMP/PKA通路广泛分布于DA神经元突触体内,同时,作为单胺类递质的DA,其合成、释放及清除的整个过程也需在突触体内完成[12],因此,若要精确研究AC/cAMP/PKA信号通路及ADHD发病机制,突触体是不可忽视的一个关键环节[13]。近期研究发现,黄芩苷能够迅速通过血脑屏障(blood-brain barrier, BBB)且在纹状体、海马内聚集[14-15],发挥对DA神经元的保护作用,并能够治疗与DA功能异常相关的神经退行性疾病[16]。有学者提出DA系统可能是黄芩苷的“脑内靶系统”[17]。基于以上的研究结论,我们大胆推测黄芩苷可能存在调控脑内DA系统而治疗ADHD的功能,相关假说已在SCI核心期刊发表[18]。为验证黄芩苷对脑内DA系统的影响及对ADHD治疗作用的假说,作者从AC/cAMP/PKA信号通路着手,在国际公认的ADHD模型自发性高血压大鼠(spontaneously hypertensive rats, SHR)突触体内进行相关实验研究[19]。通过提取SHR大鼠前额叶、纹状体的突触体,检测突触体的酶活性及突触体内AC、cAMP、PKA的含量,试图从突触水平初步探讨黄芩苷对脑内DA系统的影响及对ADHD的治疗作用,主要实验内容如下。
1 材料与方法 1.1 动物分组SHR大鼠用于ADHD动物模型的建议目前已被国际上公认,是国际上应用最为广泛、研究最多的ADHD动物模型[20-21]。SHR大鼠起源于东京远交系Wistar大鼠,是Okamoto等[22]于1963年用Wistar Kyoto(WKY)大鼠经过数代交叉培育出的一个新品种。SHR大鼠起初主要用于高血压病的研究,但在之后的研究中发现SHR大鼠在10周龄之前基本不表现高血压症状,4~10周龄SHR大鼠几乎符合儿童多动症所有临床特征,且该模型易于获得,无需任何人工诱发,且具有天然对照组WKY大鼠,因此4~10周龄SHR大鼠成为目前国际认可度最高的ADHD模型[23]。
SPF级4周龄雄性SHR大鼠40只,体重73±6 g;SPF级4周龄雄性WKY大鼠8只,体重74±6 g,均购自北京维通利华实验动物技术有限公司,许可证编号SCXK(京)2012-0001。所有动物均饲养于南京中医药大学SPF级动物房,使用许可证号:SYXK(苏)2014-0001。按照随机数字表法将SHR大鼠随机分为模型组、盐酸哌甲酯组、黄芩苷低、中、高剂量组,每组8只,WKY大鼠8只设为正常对照组。
1.2 药品准备盐酸哌甲酯(专注达,36 mg/片),Janssen Cilag Manufacturing LLC生产,西安杨森制药有限公司分装,进口药品注册证号H20120111,进口准许证号TP120120504。将药品加生理盐水配制成0.07 mg/mL混合液,4℃保存,灌胃前按需取出,复温至室温后灌胃给药。
黄芩苷购自成都菲普斯生物技术有限公司,药物纯度 > 95%(高效液相色谱法,检测波长280 nm)。将药品加生理盐水分别配制成3.33mg/mL(低剂量)、6.67 mg/mL(中剂量)及10 mg/mL(高剂量)的混合液,4℃保存,灌胃前按需取出,复温至室温后灌胃给药,每次灌胃前摇匀。
1.3 动物给药大鼠灌胃量根据9岁(体重26 kg)儿童体表面积和4周龄(体重60 g)SHR大鼠体表面积进行转换得出[24]。各组大鼠适应性喂养3~5 d,然后持续4周灌胃,每日两次(上午8 : 00~9 : 00、下午13 : 30~14 : 30)。每日上午8 : 00灌胃前称量大鼠体重,灌胃量为1.5 mL/100 g。盐酸哌甲酯组及黄芩苷低、中、高剂量组分别按体重给予对应药物灌胃,正常对照组、模型组给予等量生理盐水灌胃。为避免药物颜色不同对动物的影响,所有透明灌胃容器均用白色医用胶带包裹。
1.4 动物取材末次给药24 h后断头处死大鼠,冰上迅速分离大鼠前额叶、纹状体,置于冻存管中液氮保存,取材结束后转移至-80℃超低温冰箱保存备用。
1.5 主要实验设备Sartorius PB-10 pH调定器(德国Sartorius公司);Beckman coulter Allegra 64R离心机(美国Beckman coulter公司),F0650 50 mL固定角度转头及RUBBER ADAPTEK TUBES 15 mL橡胶适配套(美国Beckman coulter公司);Retsch MM400球磨仪(德国Retsch公司);Eppendorf 5427R离心机(德国Eppendorf公司);Infinite M200 PRO多功能酶标仪(瑞士TECAN Infinite公司);日立S-3000N型透射电镜(日本Hitachi公司)。
1.6 突触体提取取待检测组大鼠前额叶、纹状体,用大量冰点的均质缓冲液洗去血液等杂质,滤纸吸干后称重,将组织剪碎放入研磨管中研磨,采用Percoll密度梯度离心法制备突触体备用,详细操作步骤参考课题组前期相关实验技术[25]。
1.7 突触体结构电镜观察将提取的突触体,用2.5%戊二醛4℃条件下固定2 h,0.2 mol/L磷酸盐缓冲液(PBS)洗3次,每次10 min,然后换用1%锇酸后固定1 h。按透射电镜常规超薄切片制作方法,进行乙醇梯度脱水、渗透、包埋、聚合、醋酸铀染色、硝酸铅染色,详细步骤按照日立S-3000N型透射电镜切片要求进行操作,观察突触体的结构。
1.8 检测方法突触体腺苷三磷酸(ATP)酶、乳酸脱氢酶(LDH)活性检测采用比色法进行,相关试剂盒均购自南京建成生物工程研究所,比色测定波长分别为636 nm、440 nm,具体操作步骤严格按照试剂盒说明书进行。突触体中AC、cAMP、PKA含量检测均采用ABC-ELISA法,试剂盒由南京金益柏生物科技有限公司提供,实验步骤按试剂盒操作说明书进行。
1.9 统计学分析采用SPSS 19.0统计软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
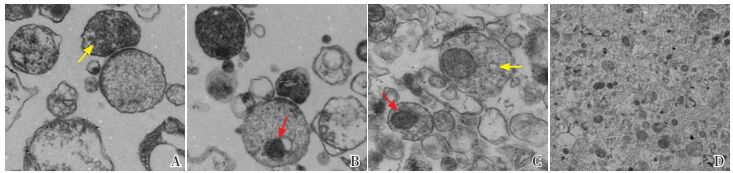
2 结果 2.1 突触体结构电镜观察完整的突触体结构为圆型或椭圆形,外膜完整呈连续封闭状,内含线粒体及大量突触小泡[26-27]。本实验所获取的突触体形态上呈连续膜封闭的椭圆结构,周围有完整的膜包围;突触前膜可见一个或多个线粒体和大量颗粒状突触小囊泡;突触间隙清晰可见,且突触后膜可见电密度增高影,结构完整,形态清晰,颜色较深。突触体突触前膜、突触间隙、突触后膜保存完好,突触体分布密度较高,具有典型的突触体形态结构特征,如图 1。
|
图 1 电镜下观察突触体形态结构(图A~C×40 000,图D×20 000) 突触体呈椭圆形,分布密度较高,结构完整,可见线粒体(红色箭头所示)及突触小泡(黄色箭头所示),符合相关实验标准要求。 |
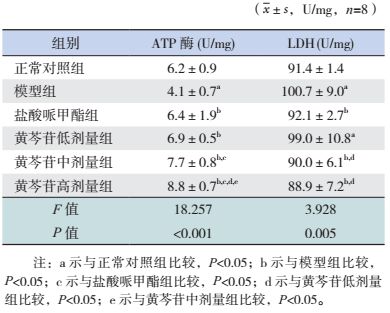
2.2 突触体内ATP酶、LDH活性测定
与正常对照组相比,模型组大鼠脑突触体ATP酶活性显著降低(P < 0.05),LDH活性显著升高(P < 0.05);与模型组相比,经给药治疗后,盐酸哌甲酯组及黄芩苷低、中、高剂量组ATP酶活性均显著升高(P < 0.05),除黄芩苷低剂量组外,LDH活性均显著降低(P < 0.05);与盐酸哌甲酯组比较,黄芩苷中、高剂量组ATP酶活性显著升高(P < 0.05);与黄芩苷低剂量组比较,黄芩苷高剂量组ATP酶活性显著升高(P < 0.05),黄芩苷中、高剂量组LDH活性显著降低(P < 0.05);与黄芩苷中剂量组比较,黄芩苷高剂量组ATP酶活性显著升高(P < 0.05)。见表 1。
| 表 1 突触体内ATP酶、LDH活性测定 |
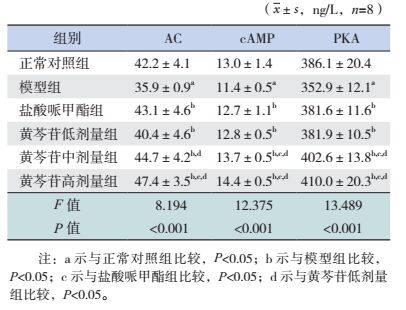
2.3 突触体内AC、cAMP、PKA含量检测
与正常对照组相比,模型组大鼠脑突触体内AC、cAMP、PKA含量均显著降低(P < 0.05);经治疗4周后,与模型组相比,盐酸哌甲酯组及黄芩苷低、中、高剂量组大鼠脑突触体内AC、cAMP、PKA含量均显著升高(P < 0.05);与盐酸哌甲酯组比较,黄芩苷高剂量组AC含量及黄芩苷中、高剂量组cAMP、PKA含量均显著升高(P < 0.05);与黄芩苷低剂量组比较,黄芩苷中、高剂量组AC、cAMP、PKA含量均显著升高(P < 0.05)。见表 2。
| 表 2 突触体内AC、cAMP、PKA含量检测 |
3 讨论
突触是脑内基本信息加工的节点部位,突触的功能失调应该是许多脑部疾病的基础;突触的功能和分子机制研究或是解开众多脑部疾病复杂原因的途径[28]。突触体是进行脑部疾病研究的良好标本,保证突触体结构完整性且具有较高的酶活性是进行研究的基础。在实验初始阶段,课题组成员在已经熟练掌握相关实验技术的基础上[25],再次进行实验前突触体结构的观察,保证本次实验所用突触体符合严格的实验要求。之后,课题组进行了ATP酶、LDH活性的检测。ATP酶存在于组织细胞及细胞器的膜上,是生物膜的一种蛋白酶,它在物质运送、能量转换以及信息传递方面具有重要的作用。ATP酶存在Na+-K+-ATP酶及Ca2+-ATP酶两种主要功能形式,前者主要通过Na+-K+泵的作用来维持细胞内外Na+、K+的平衡;后者则主要通过将细胞内Ca2+泵向细胞外及内质网,来维持细胞内Ca2+的浓度[29]。此外,除了细胞内的ATP,在中枢神经系统中存在大量的细胞外ATP,细胞外ATP在中枢神经系统的主要功能不是直接的信息传递,而是间接的调控作用[30-31]。对于突触体而言,突触体调控DA合成、释放及清除的功能既需要Na+-K+-ATP酶及Ca2+-ATP酶的作用[12],也需要细胞外ATP酶的间接调控作用,因此,突触体ATP酶的活性是突触体离子通道活性及间接调控功能强弱的表现,一定程度上代表了突触体的活性。通过实验我们发现,相比正常对照组,模型组大鼠脑突触体ATP酶活性显著降低,表明该模型制备成功;经治疗4周后,与模型组相比,盐酸哌甲酯组及黄芩苷低、中、高剂量组ATP酶活性均显著增高。本实验结果表明,所提取的突触体不仅能够应用于实验研究,且黄芩苷低、中、高剂量均能显著升高ATP酶的活性并具有量效相关性,这提示黄芩苷在提高ATP酶活性上效果明显。
LDH存在于人体各组织器官中,是机体能量代谢中的一种重要酶,LDH质与量的改变,直接影响到机体的能量代谢。在神经药理学研究中,LDH常作为评价脑功能的一项重要指标[32]。LDH是细胞内酶,少量漏出即提示细胞膜通透性增高,漏出的多少反映细胞膜的受损程度[33]。LDH广泛存在于脑细胞中,当脑组织缺血、缺氧时,受损脑细胞释放出LDH,导致脑内LDH含量及活性增高[34]。因此,LDH活性可侧面评价突触体结构完整性及活性[35]。在本次实验中,模型组及黄芩苷低剂量组大鼠脑突触体LDH活性有所升高,与模型组相比,LDH活性在盐酸哌甲酯组及黄芩苷中、高剂量组中有所降低。这一实验结果表明,ADHD模型大鼠可能存在突触体及脑功能的损伤,而黄芩苷具有改善这一损伤的作用,而这一损伤是否与脑内DA含量的异常及ADHD症状的产生存在关联尚需更深入的实验研究。
黄芩苷虽广泛应用于炎症性疾病、消化系统疾病的临床治疗,但有关黄芩苷对ADHD的临床及实验研究国内外均未见报道。DA神经元主要分布在中脑的红核后区、黑质区及腹侧被盖区,前额叶及纹状体是DA神经元的主要分布区域和功能区域,研究黄芩苷对DA系统的调控作用,前额叶、纹状体的突触体是最好的实验标本。相关研究表明黄芩苷能够迅速通过BBB,进入中枢神经系统,调控前额叶、纹状体的DA含量,改善因DA含量异常而导致的一系列神经系统疾病,如帕金森、老年痴呆等[36-38]。良好的BBB通透性及迅速的DA调控作用使黄芩苷治疗ADHD成为可能。基于此,作者提取前额叶、纹状体的突触体,测定突触体ATP、LDH的活性,保证了运用突触体进行实验的可行性,并初步检测了具有代表性意义的、由DA自身受体D2RS调控的G蛋白偶联受体信号通路AC/cAMP/PKA。
概括而论,细胞内的信号转导通路主要分为两类,一类是受G蛋白受体偶联第二信使调节的信号通路,另一类则是受到受体偶联调节的信号通路[39]。多巴胺受体属于G蛋白偶联受体,其受体分为D1样及D2样受体两类,D1R与D2R均为G蛋白偶联受体,具有该受体的基本特征,为7次跨膜的多肽链,氨基端在细胞外,羧基端在细胞内,其主要信号转导机制是通过G蛋白受体偶联第二信使调节细胞内信号转导[40]。其中,D1R通过G蛋白α亚基的两个亚型Gαs、Gαolf来激活AC,进而引起细胞内cAMP含量上升,cAMP含量的升高,导致依赖性蛋白激酶PKA的进一步活化,从而发挥相应功能;而D2R则与D1R相反,研究表明,D2R短链部分D2RS能够特异性的与G蛋白α亚基抑制性亚基Gαi/o相结合,产生抑制性效应,抑制AC/cAMP/PKA信号通路的表达,降低DA合成限速酶—酪氨酸羟化酶的合成速度,从而降低脑内DA的含量[41]。故AC的活性及cAMP的表达水平由D1R与D2R共同维持,其中,能否降低D2RS的抑制作用,是调节DA的合成速度,提高脑内DA含量的重要途径。本次研究表明,黄芩苷能够显著增加突触体内AC、cAMP及PKA的含量,且较盐酸哌甲酯组升高更为明显,同时存在量效相关性,进而反馈性的促进DA的合成,降低D2RS的抑制作用。
本次研究是对前期有关黄芩苷治疗ADHD疗效的求证性研究,通过实验研究我们发现,黄芩苷确实存在提高突触体活性,改善突触体功能的作用,并且显著增加突触体内AC、cAMP及PKA的含量,通过降低D2RS对AC/cAMP/PKA信号通路的抑制作用而发挥疗效。且黄芩苷的药效较盐酸哌甲酯组升高更为明显,同时存在量效相关性,这充分说明黄芩苷在和治疗ADHD一线进口药品的比较中具有优势,值得我们深入研究。同时,本次研究也存在一定的不足之处,如黄芩苷治疗是否显著增加了SHR大鼠脑内DA的含量,增加效果是否也存在量效相关性,黄芩苷对DA系统释放、清除信号通路的影响如何,以及黄芩苷对SHR大鼠ADHD核心症状多动、冲动、注意力不集中等问题的改善情况等尚未进行研究,这些诸多问题仍需进一步的解决,本课题组将会针对此次研究发现的问题,在接下来的实验中联合运用行为学方法、质谱、液相及分子生物学方法等进行更深入的研究,以期为ADHD的研究提供参考,造福广大儿童。
| [1] | Tsai CC, Lin MT, Wang JJ, et al. The antipyretic effects of baicalin in lipopolysaccharide-evoked fever in rabbits[J]. Neuropharmacology, 2006, 51 (4): 709–717. DOI:10.1016/j.neuropharm.2006.05.010 |
| [2] | Kang MJ, Ko GS, Oh DG, et al. Role of metabolism by intestinal microbiota in pharmacokinetics of oral baicalin[J]. Arch Pharm Res, 2014, 37 (3): 371–378. DOI:10.1007/s12272-013-0179-2 |
| [3] | Zeng L, Wang M, Yuan Y, et al. Simultaneous multi-component quantitation of Chinese herbal injection Yin-zhi-huang in rat plasma by using a single-tube extraction procedure for mass spectrometry-based pharmacokinetic measurement[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2014, 967 : 245–254. DOI:10.1016/j.jchromb.2014.07.037 |
| [4] | Polanczyk G, de Lima MS, Horta BL, et al. The worldwide prevalence of ADHD:a systematic review and metaregression analysis[J]. Am J Psychiatry, 2007, 164 (6): 942–948. DOI:10.1176/ajp.2007.164.6.942 |
| [5] | Swanson JM, Kinsbourne M, Nigg J, et al. Etiologic subtypes of attention deficit/hyperactivity disorder:brain imaging, molecular genetic and environmental factors and the dopamine hypothesis[J]. Neuropsychol Rev, 2007, 17 (1): 39–59. DOI:10.1007/s11065-007-9019-9 |
| [6] | Harvey RC, Sen S, Deaciuc A, et al. Methylphenidate treatment in adolescent rats with an attention deficit/hyperactivity disorder phenotype:cocaine addiction vulnerability and dopamine transporter function[J]. Neuropsychopharmacology, 2011, 36 (4): 837–847. DOI:10.1038/npp.2010.223 |
| [7] | Napolitano F, Bonito-Oliva A, Federici M, et al. Role of aberrant striatal dopamine D1 receptor/cAMP/protein kinase A/DARPP32 signaling in the paradoxical calming effect of amphetamine[J]. J Neurosci, 2010, 30 (33): 11043–11056. DOI:10.1523/JNEUROSCI.1682-10.2010 |
| [8] | Kitagishi Y, Minami A, Nakanishi A, et al. Neuron membrane trafficking and protein kinases involved in autism and ADHD[J]. Int J Mol Sci, 2015, 16 (2): 3095–3115. DOI:10.3390/ijms16023095 |
| [9] | Baca M, Allan AM, Partridge LD, et al. Gene-environment interactions affect long-term depression (LTD) through changes in dopamine receptor affinity in Snap25 deficient mice[J]. Brain Res, 2013, 1532 : 85–98. DOI:10.1016/j.brainres.2013.08.012 |
| [10] | Zheng R, Yang L, Sikorski MA, et al. Deficiency of the RIIβ subunit of PKA affects locomotor activity and energy homeostasis in distinct neuronal populations[J]. Proc Natl Acad Sci U S A, 2013, 110 (17): E1631–E1640. DOI:10.1073/pnas.1219542110 |
| [11] | Few WP, Scheuer T, Catterall WA. Dopamine modulation of neuronal Na (+) channels requires binding of A kinase-anchoring protein 15 and PKA by a modified leucine zipper motif[J]. Proc Natl Acad Sci U S A, 2007, 104 (12): 5187–5192. DOI:10.1073/pnas.0611619104 |
| [12] | 金国章. 多巴胺的神经化学[M]//金国章. 脑内多巴胺. 第2版. 上海: 上海科技出版社, 2010: 69-77. |
| [13] | Somkuwar SS, Darna M, Kantak KM, et al. Adolescence methylphenidate treatment in a rodent model of attention deficit/hyperactivity disorder:dopamine transporter function and cellular distribution in adulthood[J]. Biochem Pharmacol, 2013, 86 (2): 309–316. DOI:10.1016/j.bcp.2013.04.013 |
| [14] | Wang X, Zhang L, Hua L, et al. Effect of flavonoids in scutellariae radix on depression-like behavior and brain rewards:possible in dopamine system[J]. Tsinghua Sci Technol, 2010, 15 (4): 460–466. DOI:10.1016/S1007-0214(10)70088-2 |
| [15] | Im HI, Joo WS, Nam E, et al. Baicalein prevents 6-hydroxydopamine-induced dopaminergic dysfunction and lipid peroxidation in mice[J]. J Pharmacol Sci, 2005, 98 (2): 185–189. DOI:10.1254/jphs.SC0050014 |
| [16] | Mu X, He G, Cheng Y, et al. Baicalein exerts neuroprotective effects in 6-hydroxydopamine-induced experimental parkinsonism in vivo and in vitro[J]. Pharmacol Biochem Behav, 2009, 92 (4): 642–648. DOI:10.1016/j.pbb.2009.03.008 |
| [17] | Chen L, Zhang L, Wang X. Determination of dopamine and its relativity of baicalin in rat nuclei after intravenous administration of flavonoids from Scutellariae radix[J]. Biomed Chromatogr, 2007, 21 (1): 84–88. DOI:10.1002/(ISSN)1099-0801 |
| [18] | Zhou R, Han X, Wang J, et al. Baicalin may have a therapeutic effect in attention deficit hyperactivity disorder[J]. Med Hypotheses, 2015, 85 (6): 761–764. DOI:10.1016/j.mehy.2015.10.012 |
| [19] | Sagvolden T, Johansen EB, Wøien G, et al. The spontaneously hypertensive rat model of ADHD-the importance of selecting the appropriate reference strain[J]. Neuropharmacology, 2009, 57 (7-8): 619–626. DOI:10.1016/j.neuropharm.2009.08.004 |
| [20] | Cao AH, Yu L, Wang YW, et al. Effects of methylphenidate on attentional set-shifting in a genetic model of attention-deficit/hyperactivity disorder[J]. Behav Brain Funct, 2012, 8 (1): 10. DOI:10.1186/1744-9081-8-10 |
| [21] | Davids E, Zhang K, Tarazi FI, et al. Animal models of attention-deficit hyperactivity disorder[J]. Brain Res Rev, 2003, 42 (1): 1–21. DOI:10.1016/S0165-0173(02)00274-6 |
| [22] | Okamoto K, Aoki K. Development of a strain of spontaneously hypertensive rats[J]. Jpn Circ J, 1963, 27 : 282–293. DOI:10.1253/jcj.27.282 |
| [23] | 周荣易, 王娇娇, 韩新民. ADHD实验动物模型比较研究[J]. 中国比较医学杂志, 2016, 26 (9): 88–92. |
| [24] | Reagan-Shaw S, Nihal M, Ahmad N. Dose translation from animal to human studies revisited[J]. FASEB J, 2008, 22 (3): 659–661. |
| [25] | 周荣易, 韩新民, 王娇娇, 等. SHR大鼠前额叶、纹状体突触体的提取方法[J]. 中国比较医学杂志, 2015, 25 (12): 59–64. DOI:10.3969/j.issn.1671-7856.2015.12.012 |
| [26] | 肖忠新, 魏守刚, 云少君, 等. 小鼠脑突触体制备方法的改进[J]. 中国康复理论与实践, 2010, 16 (10): 937–938. DOI:10.3969/j.issn.1006-9771.2010.10.013 |
| [27] | Dunkley PR, Jarvie PE, Robinson PJ. A rapid Percoll gradient procedure for preparation of synaptosomes[J]. Nat Protoc, 2008, 3 (11): 1718–1728. DOI:10.1038/nprot.2008.171 |
| [28] | 陈宜张. 突触的化学传递[M]//陈宜张. 突触. 上海: 上海科学技术出版社, 2014: 17-27. |
| [29] | 王昱. 盐酸克伦特罗对小鼠大脑皮层ATP、SDH、ADA和LDH活性的影响[J]. 甘肃农业大学学报, 2013, 48 (2): 21–25. |
| [30] | Hugel S, Schlichter R. Presynaptic P2X receptors facilitate inhibitory GABAergic transmission between cultured rat spinal cord dorsal horn neurons[J]. J Neurosci, 2000, 20 (6): 2121–2130. |
| [31] | Pankratov Y, Lalo U, Krishtal O, et al. Ionotropic P2X purinoreceptors mediate synaptic transmission in rat pyramidal neurones of layer II/III of somato-sensory cortex[J]. J Physiol, 2002, 542 (Pt 2): 529–536. |
| [32] | 陈志武, 赵维中, 宋必卫, 等. 芸香甙对脑缺血再灌损伤的保护作用[J]. 中国药理学通报, 1998, 14 (1): 81–83. |
| [33] | 苗明三, 陈元朋, 吴巍. 姜黄素对大鼠血瘀性脑缺血模型血液流变学及脑匀浆LD、LDH和TchE水平的影响[J]. 中药药理与临床, 2010, 26 (1): 29–31. |
| [34] | 刘亮, 吕国蔚. 缺氧预适应小鼠脑匀浆去蛋白液对缺氧突触体膜的保护作用[J]. 中国神经科学杂志, 2001, 17 (4): 373–375. |
| [35] | 董志, 曾凡新, 周岐新, 等. 脑细胞缺血离体模型-缺血突触体模型的建立与评价[J]. 中国临床神经科学, 2002, 10 (2): 192–194. |
| [36] | Zhang DM, Liu HY, Xie L, et al. Effect of baicalin and berberine on transport of nimodipine on primary-cultured, rat brain microvascular endothelial cells[J]. Acta Pharmacol Sin, 2007, 28 (4): 573–578. DOI:10.1111/aphs.2007.28.issue-4 |
| [37] | Kwak S, Ku SK, Han MS, et al. Vascular barrier protective effects of baicalin, baicalein and wogonin in vitro and in vivo[J]. Toxicol Appl Pharmacol, 2014, 281 (1): 30–38. DOI:10.1016/j.taap.2014.09.003 |
| [38] | Liu XM, Feng Y, Li AM. Nerve protective effect of Baicalin on newborn HIBD rats[J]. Asia Pac J Trop Med, 2014, 7 (10): 806–810. DOI:10.1016/S1995-7645(14)60141-3 |
| [39] | 孙健, 刘健华, 王谦, 等. 电针对抑郁症大鼠海马组织AC-cAMP-PKA信号通路的影响[J]. 中国老年学杂志, 2010, 30 (24): 3672–3674. DOI:10.3969/j.issn.1005-9202.2010.24.025 |
| [40] | 孙继超, 周荣易, 雷爽, 等. 安神定志灵对ADHD模型大鼠前额叶、纹状体AC、cAMP的影响[J]. 中成药, 2016, 38 (7): 1605–1607. |
| [41] | Loos M, Pattij T, Janssen MC, et al. Dopamine receptor D1/D5 gene expression in the medial prefrontal cortex predicts impulsive choice in rats[J]. Cereb Cortex, 2010, 20 (5): 1064–1070. DOI:10.1093/cercor/bhp167 |
 2017, Vol. 19
2017, Vol. 19