肺炎链球菌是定植于人类鼻咽部及上呼吸道黏膜表面,引起如肺炎、中耳炎、脑膜炎和败血症等感染性疾病的革兰阳性菌,主要感染两岁以下儿童、老年人及免疫缺陷患者。肺炎链球菌感染是引起儿童死亡的最主要原因,肺炎链球菌也是导致儿童致死性肺炎感染的最主要细菌。每年约有160万人死于肺炎链球菌感染引起的疾病[1],在全世界范围内约有11%的5岁以下儿童死于肺炎链球菌感染相关疾病[2]。随着抗生素的应用肺炎链球菌耐药株不断出现,近年来,多重耐药局势也日趋严峻,因此,采用有效的肺炎链球菌疫苗抵抗肺炎链球菌感染显得越来越重要[3]。
肺炎链球菌蛋白疫苗的主要成分是在肺炎链球菌表面以分泌形式表达的蛋白,肺炎链球菌有多种蛋白可以作为蛋白疫苗的候选分子,包括:肺炎链球菌表面蛋白A和C(PspA、PspC)[4-5]、肺炎链球菌表面黏附素A(pneumococcal surface adhesin A, PsaA)[6]、肺炎链球菌溶血素(Ply)[7]、神经氨酸酶A(NanA)[8]、肺炎链球菌菌毛亚单位(RrgA、RrgB、RrgC)[9-10]、热休克蛋白(DnaJ)[11-12]等。这些蛋白对肺炎链球菌引起的感染都能产生有效保护作用。但单一组分的蛋白疫苗保护效果不是很理想,因此,继续寻找新的、高度保守的肺炎链球菌疫苗候选蛋白抗原仍然迫在眉睫,以助于筛选保护效果优良的联合蛋白疫苗。
肺炎链球菌内肽酶O(pneumococcal endo-peptidase O, PepO)是肺炎链球菌的重要毒力因子[13],它是一种金属内肽酶,与M13肽酶家族具有同源性,参与调节多种生理、病理过程。在肺炎链球菌基因水平及蛋白水平均有广泛表达,PepO可以与上皮细胞和内皮细胞相互作用促进肺炎链球菌黏附、定植于宿主黏膜,并可与宿主蛋白相互作用进而躲避宿主细胞的天然免疫而侵袭宿主。此外,PepO蛋白可与纤溶酶原及纤维连接蛋白结合,经尿激酶型纤溶酶原激活物(u-PA)激活与PepO结合的纤溶酶原,产生的纤溶酶将裂解补体C3b进而辅助补体调节蛋白发挥作用[14-16]。
PsaA是各血清型肺炎链球菌共有的种特异性表面结合脂蛋白,具有较好的免疫原性,PsaA为金属结合脂蛋白家族成员,是ABC转运蛋白复合体的一部分,参与Mn+转运到肺炎链球菌的过程[17-19],在肺炎链球菌黏附于呼吸道黏膜的过程中起关键作用,是肺炎链球菌主要的毒力因子之一[20]。
本研究将对PepO作为疫苗候选蛋白的免疫保护效果及PepO、PsaA联合疫苗对不同肺炎链球菌感染模型的保护效果进行评价,为肺炎链球菌蛋白疫苗的研发提供一定理论基础,并进一步为联合蛋白疫苗的开发提供有价值的参考依据。
1 材料与方法 1.1 实验动物6~8周龄SPF级健康雌性BALB/c小鼠,体重18~22 g,购自四川大学动物中心。所有实验动物的研究均按照四川大学实验中心规范和守则进行。
1.2 主要菌株及抗原肺炎链球菌D39(NCTC7466, serotype 2)购自美国菌种保存中心;肺炎链球菌CMCC31436(serotype 3)、CMCC31207(serotype 6B)、CMCC31614(serotype 14)、CMCC31693(serotype 19F)均购自中国医学细菌保藏管理中心。大肠埃希菌BL21(DE3)、大肠埃希菌DH5α和pET28a (+) 载体由本实验室保存。
1.3 主要试剂DNA纯化试剂盒,PrimeStar高保真DNA聚合酶,蛋白Marker,BamH Ⅰ、Xho Ⅰ、Hind Ⅲ限制性内切酶,T4-DNA连接酶购自大连TaKaRa公司;细菌基因组DNA提取试剂盒,质粒提取试剂盒购自北京天根生化科技有限公司;Ni-NTA层析柱购自上海生工生物工程有限公司;CT佐剂、Alum佐剂购自美国Sigma公司;血平板购自成都生物制品研究所有限责任公司;HRP标记的羊抗鼠IgA或IgG,ELISA试剂盒购自美国Santa Cruz公司。
1.4 目的蛋白的制备提取肺炎链球菌标准菌株D39基因组DNA;PCR扩增目的基因(pepO、psaA)片段;同时小量提取质粒pET-28a (+),将目的基因片段和提取的质粒进行酶切与纯化,再用酶切后产物构建重组质粒pET-28a (+)-pepO、pET-28a (+)-psaA连接产物;然后制备大肠埃希菌DH5α感受态细胞,将重组质粒转化感受态细胞,培养过夜,挑取3~5棵单个菌落,进行增菌培养,再采用菌落PCR及双向测序对重组质粒进行筛选及鉴定,最后将筛选出的重组质粒pET-28a (+)-pepO、pET-28a (+)-psaA转化入大肠埃希菌BL21(DE3)中用IPTG进行诱导表达及通过Ni-NTA柱纯化。
1.5 目的蛋白特异性抗血清的制备免疫前取小鼠尾静脉血,分离血清作为阴性对照,于-20℃保存。每只小鼠经腹腔接种抗原(20 µg目的蛋白和100 µL Alum佐剂),每隔14 d进行加强免疫,共免疫3次。末次免疫后7 d取小鼠尾静脉血检测抗体滴度,达到要求时对小鼠进行眼眶取血,分离抗血清,-20℃保存备用。
1.6 Western blot鉴定目的蛋白特异性抗血清培养肺炎链球菌D39、CMCC31436、CMCC 31207、CMCC31614、CMCC31693。无菌PBS收集并洗涤上述培养的肺炎链球菌,1×上样buffer重悬菌体沉淀,100℃水浴煮沸10 min裂解细菌。全菌裂解物经SDS-PAGE电泳分离后转膜。以目的蛋白特异性抗血清为一抗(1 : 1 000),羊抗鼠HRP-IgG为二抗(1 : 5 000),化学发光试剂盒检测目的条带,待显色后用QUANTITY ONE软件照相保存图片,检测目的蛋白抗血清的特异性。
1.7 目的蛋白黏膜免疫BALB/c小鼠将小鼠随机分为阴性对照组、PepO组、PsaA组、PepO+PsaA联合组,每组18只。将PepO组、PsaA组、PepO+PsaA联合组小鼠经乙醚麻醉后,每只小鼠经鼻腔滴入30 µL抗原,其中包含5 µL CT佐剂(1 mg/mL)、10 µg PepO或(和)10 µg PsaA,不足量部分用无菌PBS补足,保持小鼠直立仰头状态直至完全吸入,共免疫4周,每周1次。阴性对照组仅注射CT佐剂,共免疫4周,每周1次。
1.8 免疫小鼠血清及唾液中抗体的检测(1) 小鼠血清的收集:末次免疫结束第7天,采集小鼠眼眶血,分离血清-20℃保存待用。(2)小鼠唾液的收集:末次免疫结束第7天,取卡巴胆碱30 µL经腹腔注入小鼠体内,待小鼠产生唾液后,收集小鼠唾液约50 µL,离心后收集上清-20℃保存备用。(3)抗体滴度检测:间接ELISA法测定血清中IgG以及唾液中IgA水平。
1.9 目的蛋白对肺炎链球菌不同感染模型保护效果的评估(1) 鼻腔感染模型:每组选取12只小鼠,调整肺炎链球菌D39、CMCC31436的浓度均为1.5×107 CFU,用乙醚麻醉黏膜末次免疫2周后的小鼠,经鼻腔滴注30 µL/只菌液,连续21 d观察各组小鼠的生存状态,计算小鼠的生存率。
(2) 定植感染模型:每组选取6只小鼠,肺炎链球菌CMCC31693、CMCC31207过夜培养,用无菌PBS调整细菌浓度至1.0×107 CFU/30 µL,黏膜末次免疫2周后,用乙醚麻醉小鼠,经鼻腔滴注30 µL/只菌液,攻毒后第5天,处死实验用鼠,缓慢灌注300 µL无菌PBS,收集全部灌注液体。取小鼠肺组织进行匀浆,经离心沉淀细菌,用无菌PBS将沉淀细菌做梯度倍比稀释,37℃过夜培养,铺板计数定植的细菌数量。
1.10 统计学分析采用SPSS 19.0和Graphpad Prism 5软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用One-Way ANOVA方法分析,组间两两比较采用SNK-q方法;计数资料用百分率(%)表示,各组小鼠的生存率用log-rank检验进行分析,P < 0.05为差异有统计学意义。
2 结果 2.1 pepO、psaA基因的PCR扩增以肺炎链球菌D39基因组DNA作为模板,扩增pepO、psaA基因全长,经琼脂糖凝胶电泳后,可见大小约1 893 bp、930 bp的特异性条带,其大小与预期值相符,见图 1。
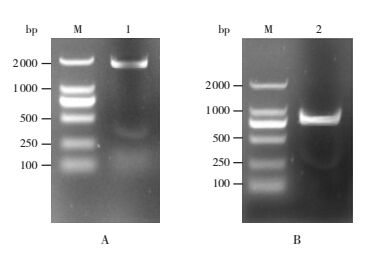
|
图 1 pepO、psaA基因PCR扩增产物 M:DNA Marker;1:pepO基因产物(A);2:psaA基因产物(B)。 |
2.2 重组质粒pET-28a (+)-pepO、pET-28a (+)-psaA的鉴定
重组质粒pET-28a (+)-pepO、pET-28a (+)-psaA的菌液,经菌落PCR鉴定,均可见大小约1 893 bp、930 bp的特异性条带。且重组质粒双向测序结果与基因库中肺炎链球菌pepO、psaA基因序列一致。见图 2。
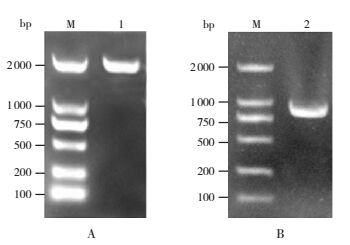
|
图 2 重组表达质粒菌落PCR M:DNA Marker;1:pET-28a (+)-pepO(A);2:pET-28a (+)-psaA(B)。 |
2.3 目的蛋白的诱导表达及纯化
纯化的重组蛋白PepO、PsaA经15% SDS-PAGE分析,可见目的蛋白条带,凝胶扫描显示,纯度达90%以上,见图 3。
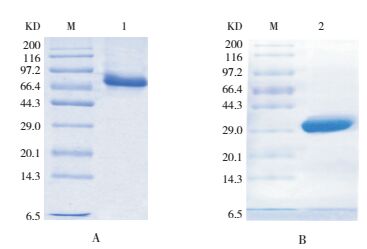
|
图 3 PepO、PsaA纯化的SDS-PAGE分析 M:Protein Marker;1:PepO(A);2:PsaA(B)。 |
2.4 Western blot分析目的蛋白抗血清的特异性
PepO、PsaA蛋白抗血清不仅能特异性识别重组PepO、PsaA蛋白,而且还能特异性识别不同血清型肺炎链球菌中的PepO蛋白,见图 4。
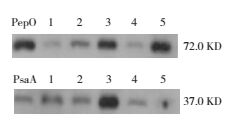
|
图 4 Western blot分析PepO、PsaA抗血清的特异性 肺炎链球菌1:D39;2:CMCC31436;3:CMCC31207;4:CMCC31614;5:CMCC31693。 |
2.5 免疫小鼠血清及唾液中抗体效价的检测
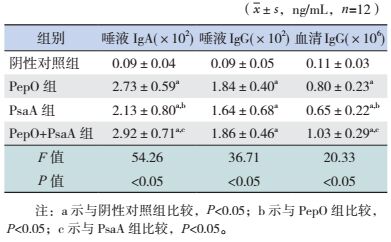
PepO组、PsaA组及PepO+PsaA组小鼠唾液中IgA、IgG,血清中IgG水平均高于阴性对照组(P < 0.05);与PepO组比较,PsaA组唾液中IgA和血清中IgG水平降低(P < 0.05);与PsaA组比较,PepO+PsaA组唾液中IgA和血清中IgG水平显著升高(P < 0.05)。结果提示PepO、PsaA重组蛋白均能有效地激发小鼠产生较强免疫反应,但PepO+PsaA联合蛋白免疫小鼠后产生的保护效应并不一定强于单独免疫组效应。见表 1。
| 表 1 黏膜免疫1周后各组小鼠血清及唾液中抗体水平比较 |
2.6 黏膜免疫目的蛋白对肺炎链球菌致死性感染的影响
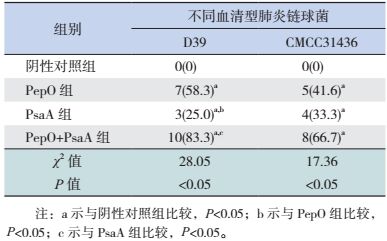
黏膜免疫BALB/c小鼠后,经鼻腔感染肺炎链球菌D39,PepO组、PsaA组及PepO+PsaA组小鼠生存率均高于阴性对照组(P < 0.05);与PepO组相比,PsaA组小鼠生存率降低(P < 0.05);与PsaA组相比,PepO+PsaA组小鼠生存率显著增高(P < 0.05)。提示PepO、PsaA黏膜免疫小鼠后对肺炎链球菌D39的致死性感染有较好的保护作用,PepO+PsaA组与PepO组保护效果相当,且优于PsaA组。经鼻腔感染肺炎链球菌CMCC31436,PepO组、PsaA组、PepO+PsaA组小鼠生存率均高于阴性对照组(P < 0.05);而上述各组间小鼠生存率比较差异无统计学意义(P > 0.05)。提示PepO、PsaA黏膜免疫小鼠后对肺炎链球菌CMCC31436的致死性感染有一定的保护作用,但联合免疫保护效果并不强于单个蛋白免疫组。见表 2。
| 表 2 黏膜免疫2周后BALB/c小鼠感染不同血清型肺炎链球菌的生存率比较 [例(%),n=12] |
2.7 黏膜免疫目的蛋白对肺炎链球菌在宿主鼻咽部及肺部定植的影响
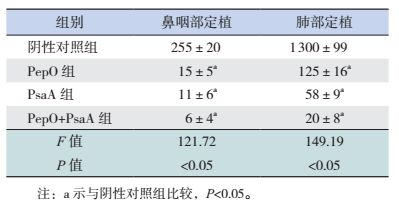
黏膜免疫BALB/c小鼠后,经鼻腔感染肺炎链球菌CMCC31693,构建定植感染模型,结果显示:PepO组、PsaA组及PepO+PsaA组鼻咽部、肺部细菌定植量均低于阴性对照组(P < 0.05),但上述各组间比较鼻咽部、肺部细菌定植量差异均无统计学意义(P > 0.05)。提示PepO、PsaA及PepO+PsaA联合免疫可以有效抵抗肺炎链球菌CMCC31693在小鼠鼻咽部、肺部的定植;而PepO+PsaA联合免疫与PepO、PsaA单独免疫的抗定植作用相当。见表 3。
| 表 3 各组小鼠经肺炎链球菌CMCC31693感染后鼻咽部及肺部细菌定植量比较(x±s,CFU/×103,n=6) |
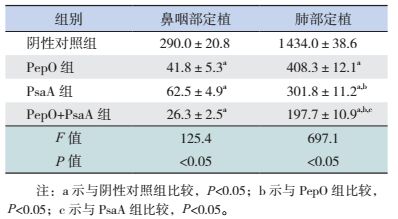
黏膜免疫BALB/c小鼠后,经鼻腔感染肺炎链球菌CMCC31207,构建定植感染模型,结果显示:PepO组、PsaA组及PepO+PsaA组鼻咽部、肺部细菌定植量均低于阴性对照组(P < 0.05);上述各组间比较鼻咽部细菌定植量差异无统计学意义(P > 0.05),而PepO+PsaA组肺部细菌定植量低于PepO、PsaA组(P < 0.05)。提示PepO、PsaA及PepO+PsaA联合免疫可以有效抵抗肺炎链球菌CMCC31207在小鼠鼻咽部、肺部的定植;PepO+PsaA联合免疫对肺部该细菌定植保护效果更好,而对鼻咽部该细菌定植的保护效果与单独免疫无差异。见表 4。
| 表 4 各组小鼠经肺炎链球菌CMCC31207感染后鼻咽部及肺部细菌定植量比较 (x±s,CFU/×103,n=6) |
3 讨论
肺炎链球菌毒力因子在肺炎链球菌定植以及侵袭宿主引起感染的过程中发挥了重要作用,肺炎链球菌PepO、PsaA蛋白在肺炎链球菌对宿主的识别、黏附、定植和侵袭过程中都扮演了重要角色,是肺炎链球菌蛋白疫苗的重要候选疫苗因子。单一组分的蛋白疫苗保护效果不是很理想,因此,本研究将PepO与PsaA进行联合免疫,以助于筛选保护效果更优良的联合蛋白疫苗。
肺炎链球菌是呼吸道感染细菌,宿主黏膜是其入侵的第一道屏障,黏膜免疫可以同时刺激宿主的局部免疫反应和系统免疫反应,对许多感染性疾病的防御起着重要作用。研究表明,疫苗给予途径能够对抵抗致病菌定植和感染产生不同程度的影响。传统的疫苗免疫方式主要是肌肉注射,但这种方式成本高,风险大,往往存在血源性病原体如HIV、HBV等传播的风险,有创,不易被儿童接受, 此外,这种免疫方式在仪器和专业人员方面的花费往往大于疫苗本身。与非消化道免疫途径相比,黏膜免疫操作简单易行,无需昂贵的仪器和专业人员,无创,易被广大人群接受。同时,黏膜免疫可以刺激机体产生局部免疫反应和系统性免疫反应,不仅可以刺激产生分泌性抗体IgA,还可以激发全身免疫系统,刺激产生血清抗体和细胞免疫反应[21]。WHO已经将儿科疫苗进行黏膜免疫列为疫苗免疫途径的发展方向。因此,无论从经济方面,伦理方面,还是安全性方面考虑,黏膜免疫途径都比传统的免疫途径有优势[22]。黏膜免疫途径是肺炎链球菌疫苗一种比较理想的免疫途径[23-24]。因此,本研究选用了黏膜免疫途径进行蛋白免疫。重组蛋白经黏膜途径免疫小鼠后,小鼠唾液和血清中均可产生高效价的PepO、PsaA特异性IgG和IgA,结果提示,重组蛋白均能有效地激发免疫小鼠产生较强的免疫反应,且PepO与PsaA蛋白联合后免疫小鼠产生的效应强于单独PsaA的免疫效应,与PepO的免疫效应相当。
肺炎链球菌有90多种血清型,由于工作难度太大,本研究无法对所有血清型肺炎链球菌的感染进行探索。因此,本研究选择了毒力作用较强的标准菌株D39和在中国普遍流行的CMCC31436、CMCC31693及CMCC31207临床分离菌株[25]。目的蛋白的抗血清可以识别5种不同血清型肺炎链球菌中的天然PepO、PsaA蛋白,为了评估重组蛋白保护效果的血清型非依赖性,本研究选用了不同血清型的肺炎链球菌在BALB/c小鼠动物实验模型上进行保护率和定植研究。结果提示PepO、PsaA免疫组小鼠黏膜表面的IgA,IgG,血清IgG水平与对照组相比显著增加。经黏膜免疫能诱导小鼠体内产生免疫保护反应,有效抵抗各种血清型肺炎链球菌的感染,且对D39、CMCC31436肺炎链球菌引起的致死性感染有较好的保护效果。
本研究成功构建了最常见的肺炎链球菌CMCC31693及CMCC31207定植感染模型,结果表明,重组蛋白可以显著降低CMCC31693及CMCC31207肺炎链球菌在鼻咽部和肺部的定植。与单个蛋白抗原免疫相比,联合蛋白免疫能显著提高肺炎链球菌对肺部定植的保护作用。
本研究首次报道将PepO和PsaA蛋白进行联合免疫,观察其对小鼠感染肺炎链球菌的保护作用,这对肺炎链球菌蛋白疫苗的研发具有重要意义。本研究成功构建了不同血清型肺炎链球菌感染的模型,结果提示:PepO、PsaA联合免疫小鼠可以有效抵抗肺炎链球菌的感染,为今后肺炎链球菌疫苗的研制提供了研究依据。
| [1] | World Health Organization. Estimates of disease burden and cost effectiveness[EB/OL]. (2016-11-11)[2016-11-22]. http://www.who.int/immunization/monitoring_surveillance/burden/estimates/en/. |
| [2] | O'Brien KL, Wolfson LJ, Watt JP, et al. Burden of disease caused by Streptococcus pneumoniae in children younger than 5 years:global estimates[J]. Lancet, 2009, 374 (9693): 893–902. DOI:10.1016/S0140-6736(09)61204-6 |
| [3] | Braido F, Bellotti M, De Maria A, et al. The role of Pneumococcal vaccine[J]. Pulm Pharmacol Ther, 2008, 21 (4): 608–615. DOI:10.1016/j.pupt.2008.04.001 |
| [4] | Kristian SA, Ota T, Bubeck SS, et al. Generation and improvement of effector function of a novel broadly reactive and protective monoclonal antibody against pneumococcal surface protein A of Streptococcus pneumoniae[J]. PLoS One, 2016, 11 (5): e0154616. DOI:10.1371/journal.pone.0154616 |
| [5] | Balachandran P, Brooks-Walter A, Virolainen-Julkunen A, et al. Role of pneumococcal surface protein C in nasopharyngeal carriage and pneumonia and its ability to elicit protection against carriage of Streptococcus pneumoniae[J]. Infect Immun, 2002, 70 (5): 2526–2534. DOI:10.1128/IAI.70.5.2526-2534.2002 |
| [6] | Tai SS. Streptococcus pneumoniae protein vaccine candidates:properties, activities and animal studies[J]. Crit Rev Microbiol, 2006, 32 (3): 139–153. DOI:10.1080/10408410600822942 |
| [7] | Salha D, Szeto J, Myers L, et al. Neutralizing antibodies elicited by a novel detoxified pneumolysin derivative, PlyD1, provide protection against both pneumococcal infection and lung injury[J]. Infect Immun, 2012, 80 (6): 2212–2220. DOI:10.1128/IAI.06348-11 |
| [8] | Manco S, Hernon F, Yesilkaya H, et al. Pneumococcal neuraminidases A and B both have essential roles during infection of the respiratory tract and sepsis[J]. Infect Immun, 2006, 74 (7): 4014–4020. DOI:10.1128/IAI.01237-05 |
| [9] | Shaik MM, Maccagni A, Tourcier G, et al. Structural basis of pilus anchoring by the ancillary pilin RrgC of Streptococcus pneumoniae[J]. J Biol Chem, 2014, 289 (24): 16988–16997. DOI:10.1074/jbc.M114.555854 |
| [10] | Harfouche C, Filippini S, Gianfaldoni C, et al. RrgB321, a fusion protein of the three variants of the pneumococcal pilus backbone RrgB, is protective in vivo and elicits opsonic antibodies[J]. Infect Immun, 2012, 80 (1): 451–460. DOI:10.1128/IAI.05780-11 |
| [11] | Cui Y, Zhang X, Gong Y, et al. Immunization with DnaJ (hsp40) could elicit protection against nasopharyngeal colonization and invasive infection caused by different strains of Streptococcus pneumonia[J]. Vaccine, 2011, 29 (9): 1736–1744. DOI:10.1016/j.vaccine.2010.12.126 |
| [12] | Liu Y, Wang H, Zhang S, et al. Mucosal immunization with recombinant fusion protein DnaJ-ΔA146Ply enhances cross-protective immunity against Streptococcus pneumoniae infection in mice via interleukin 17A[J]. Infect Immun, 2014, 82 (4): 1666–1675. DOI:10.1128/IAI.01391-13 |
| [13] | Agarwal V, Kuchipudi A, Fulde M, et al. Streptococcus pneumoniae endopeptidase O (PepO) is a multifunctional plasminogen-and fibronectin-binding protein, facilitating evasion of innate immunity and invasion of host cells[J]. J Biol Chem, 2013, 288 (10): 6849–6863. DOI:10.1074/jbc.M112.405530 |
| [14] | Singh P, Carraher C, Schwarzbauer JE. Assembly of fibronectin extracellular matrix[J]. Annu Rev Cell Dev Biol, 2010, 26 : 397–419. DOI:10.1146/annurev-cellbio-100109-104020 |
| [15] | Schwarz-Linek U, Höök M, Potts JR. The molecular basis of fibronectin-mediated bacterial adherence to host cells[J]. Mol Microbiol, 2004, 52 (3): 631–641. DOI:10.1111/j.1365-2958.2004.04027.x |
| [16] | Collen D, Verstraete M. Molecular biology of human plasminogen. II. Metabolism in physiological and some pathological conditions in man[J]. Thromb Diath Haemorrh, 1975, 34 (2): 403–408. |
| [17] | Novak R, Braun JS, Charpentier E, et al. Penicillin tolerance genes of Streptococcus pneumoniae:the ABC-type manganese permease complex Psa[J]. Mol Microbiol, 1998, 29 (5): 1285–1296. DOI:10.1046/j.1365-2958.1998.01016.x |
| [18] | Johnston JW, Myers LE, Ochs MM, et al. Lipoprotein PsaA in virulence of Streptococcus pneumoniae:surface accessibility and role in protection from superoxide[J]. Infect Immun, 2004, 72 (10): 5858–5867. DOI:10.1128/IAI.72.10.5858-5867.2004 |
| [19] | McAllister LJ, Tseng HJ, Ogunniyi AD, et al. Molecular analysis of the psa permease complex of Streptococcus pneumoniae[J]. Mol Microbiol, 2004, 53 (3): 889–901. DOI:10.1111/j.1365-2958.2004.04164.x |
| [20] | Singh R, Gupta P, Sharma PK, et al. Prediction and characterization of helper T-cell epitopes from pneumococcal surface adhesin A[J]. Immunology, 2014, 141 (4): 514–530. DOI:10.1111/imm.2014.141.issue-4 |
| [21] | De Magistris MT. Mucosal delivery of vaccine antigens and its advantages in pediatrics[J]. Adv Drug Deliv Rev, 2006, 58 (1): 52–67. DOI:10.1016/j.addr.2006.01.002 |
| [22] | Ferreira DM, Darrieux M, Silva DA, et al. Characterization of protective mucosal and systemic immune responses elicited by pneumococcal surface protein PspA and PspC nasal vaccines against a respiratory pneumococcal challenge in mice[J]. Clin Vaccine Immunol, 2009, 16 (5): 636–645. DOI:10.1128/CVI.00395-08 |
| [23] | Zygmunt BM, Rharbaoui F, Groebe L, et al. Intranasal immunization promotes Th17 immune responses[J]. J Immunol, 2009, 183 (11): 6933–6938. DOI:10.4049/jimmunol.0901144 |
| [24] | Neutra MR, Kozlowski PA. Mucosal vaccines:the promise and the challenge[J]. Nat Rev Immunol, 2006, 6 (2): 148–158. DOI:10.1038/nri1777 |
| [25] | Liu Y, Wang H, Chen M, et al. Serotype distribution and antimicrobial resistance patterns of Streptococcus pneumoniae isolated from children in China younger than 5 years[J]. Diagn Microbiol Infect Dis, 2008, 61 (3): 256–263. DOI:10.1016/j.diagmicrobio.2008.02.004 |
 2017, Vol. 19
2017, Vol. 19