2. 解放军306医院儿科, 北京 100101
食物过敏(food allergy, FA)是指机体被某种食物致敏后,再次接触该食物,所产生的异常免疫反应。流行病学调查显示,儿童FA的发病率约为4%~7%,并以较高的速度逐年增长,严重影响了儿童的健康成长和生命安全。部分患儿在FA后能产生免疫耐受,但目前免疫耐受的机制尚不清楚。
免疫系统拥有对过敏原产生免疫耐受的外周机制,调节性T细胞(regulatory T cell, Treg)发育发展是微生物清除减弱、保持微生物持续存在和限制相应组织损伤的结果[1]。根据表面标志、产生细胞因子和作用机制的不同,可将Treg分为CD4+CD25+Treg、Th1、Th3、自然杀伤T细胞等。CD4+CD25+Treg是日本学者Sakaguchi等[2]于1995年首次报道。其中CD4+CD25+Treg是一群具有免疫抑制功能的细胞亚群,可通过直接接触和/或分泌抑制性细胞因子来下调机体免疫系统对抗原的免疫反应性,在机体免疫系统中执行负向调节免疫反应的功能,对维持免疫自稳起到至关重要的作用。本实验通过建立FA模型,观察非甲基化胞嘧啶鸟嘌呤核苷酸(CpG-ODN)及脂肪间充质干细胞(adipose-derived stem cell, ADSC)对FA小鼠干预治疗后CD4+CD25+Treg表达水平的影响,探讨其在FA发病机制中的免疫调节作用。
1 材料与方法 1.1 实验动物取10只SPF级6~8周龄BALB/c雌性小鼠,用于ADSC的分离、培养与诱导[3];另取40只SPF级2~3周龄BALB/c雌性小鼠,随机分为对照组、过敏组、ADSC治疗组(简称ADSC组)、非甲基化CpG-ODN治疗组(简称CpG-ODN组),每组10只。所有小鼠均购买并饲养于中国科学院动物研究所SPF级动物房,在实验前均给予适应性饲养2 d,给予不含卵清蛋白(OVA)饲料饲养,自由进食、饮水。
1.2 试剂及药品胎牛血清(德国Biochrom AG公司)、DME/F12培养基(美国Hyclone公司)、Ⅰ型胶原酶(美国Sigma公司)、0.25%胰蛋白酶、10×磷酸缓冲盐溶液(PBS)(北京雷根生物技术有限公司)、0.9%氯化钠注射液(中国大冢制药有限公司)、OVA(V级,美国Sigma公司)、非甲基化CpG-ODN1826(上海生工生物股份有限公司)、CD4-FITC、CD25-PE、Rat IgM-PE(德国Miltenyi公司)。
1.3 ADSC分离培养后成脂及成骨诱导鉴定参照文献[3],将小鼠颈椎脱臼,取腹股沟处脂肪,消化、离心、接种、培养。取第3代ADSC,给予成脂诱导培养基诱导分化,2周后进行油红O染色鉴定。染色鉴定步骤:取出细胞培养板,每孔均加入4%多聚甲醛固定15 min后,自来水洗板2次,每次2 min;再用超纯水洗板2次,每次2 min;每孔再加入60%的异丙醇溶液,放置约30 s,加入油红O染液染色20 min后,放入75%的酒精进行分色,再用蒸馏水清洗;然后加入Mayer苏木素染液,复染3 min;再加入ORO Buffer放置1 min;流水冲洗,晾干,倒置显微镜下观察,拍照。
取第3代ADSC,给予成骨诱导培养基诱导分化,3周后进行茜素红染色鉴定。染色鉴定步骤:取出细胞培养板,PBS洗板3次,每孔均加入4%多聚甲醛固定10 min后,超纯水清洗3遍,加入2%茜素红染液染色30 min,蒸馏水洗板3次,晾干,倒置显微镜下观察,拍照。
1.4 FA模型建立FA模型建立参照文献[3-5]。基础致敏:实验第0、14天,过敏组、ADSC组、CpG-ODN组腹腔注射OVA致敏液0.2 mL/只(250 μg/mL)。激发致敏:实验第17、20、23、26、29天,过敏组、ADSC组、CpG-ODN组以OVA致敏液0.3 mL/只(2 mg/mL)灌胃;其中CpG-ODN组在每次灌胃激发前1 h,给予腹腔注射非甲基化CpG-ODN溶液0.08 mL/只(约40 μg)。ADSC组在实验第15、30天给予腹腔注射ADSC细胞悬液0.2 mL/只(细胞数约为1×106个)。对照组在基础致敏和激发致敏阶段均用0.9%氯化钠注射液代替。观察各组小鼠致敏前后过敏症状,并给予评分。
1.5 过敏症状评分过敏症状评分标准参照文献[3-5]。0分:无明显症状;1分:抓耳挠腮,抓挠身体其他部位;2分:口周红、腹泻、易激惹、呼吸急促;3分:眼睛嘴巴浮肿、尾巴紫绀、呼吸浅慢;4分:活动低下或无活动;5分:死亡。
1.6 CD4+CD25+Treg及OVA-IgE检测FA模型建立后4~6 h,各组小鼠摘除眼球取血,每只小鼠取0.2 mL血置于抗凝管中,而后置于流式管中,采用流式细胞仪检测外周血中CD4+CD25+Treg的含量,具体步骤参照说明书;另取0.6 mL血置于EP管中,离心后取血清,采用酶联免疫吸附法(ELISA)检测血清中OVA-IgE的含量,具体步骤参照说明书。
1.7 小肠病理切片制备取各组小鼠空肠置于中性福尔马林中固定,脱水、包埋、切片,苏木素-伊红(HE)染色,显微镜下观察。
1.8 统计学分析采用SPSS 17.0统计学软件对数据进行统计学分析,正态分布计量资料采用均数±标准差(x±s)表示,多组间的比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
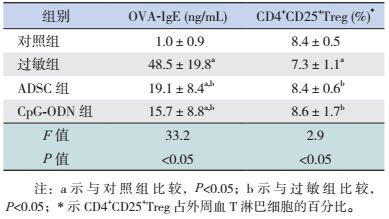
2 结果 2.1 ADSC成脂及成骨诱导鉴定取第3代ADSC,给予成脂诱导5~6 d后,发现细胞内出现小脂滴,继续诱导脂滴逐渐增大并且融合,诱导2周后给予油红O染色可见大量脂质,见图 1。
|
图 1 成脂诱导2周鉴定结果(油红O染色,×400) 脂滴形成,呈现红色(箭头所示)。 |
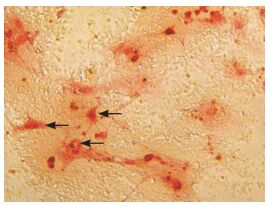
取第3代ADSC,给予成骨诱导约1周,细胞形状呈现为多角形,胞质内可见少许颗粒;约2周时细胞呈现出集落样生长,有钙质沉积;3周时细胞呈融合状态,出现明显的钙结节,给予茜素红染色呈现为红色,见图 2。
|
图 2 成骨诱导3周鉴定结果(茜素红染色,×200) 可见红色的钙结节堆积成片(箭头所示)。 |
2.2 各组小鼠过敏症状评分情况
建模完成后,各组小鼠过敏症状评分比较差异有统计学意义(F=98.0,P < 0.001)。其中过敏组过敏症状评分(6.5±0.7)分别高于对照组(0.2±0.4)、ADSC组(4.1±1.1)和CpG-ODN组(4.5±1.0)(P < 0.01);ADSC组与CpG-ODN组间过敏症状评分比较差异无统计学意义(P > 0.05),但均高于对照组(P < 0.05)。
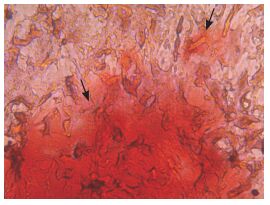
2.3 各组小鼠空肠黏膜病理变化过敏组小鼠黏膜层绒毛结构破坏,顶部可见水肿,大量的嗜酸性粒细胞及淋巴细胞浸润,符合Ⅰ型变态反应的特点;对照组小鼠黏膜层绒毛结构完整,未见水肿,无嗜酸性粒细胞及淋巴细胞浸润;ADSC组小鼠黏膜层绒毛结构部分破坏,无明显水肿,有少量嗜酸性粒细胞及淋巴细胞浸润;CpG-ODN组小鼠黏膜层绒毛结构部分破坏,无水肿,有少量嗜酸性粒细胞及淋巴细胞浸润(图 3)。
|
图 3 各组小鼠空肠黏膜形态及结构(苏木精-伊红染色,×400) A:对照组小鼠空肠黏膜层绒毛(黑色箭头所示)结构完整,无水肿及炎性细胞浸润;B:过敏组小鼠空肠黏膜层绒毛结构破坏(黄色箭头所示),顶部可见水肿,大量的嗜酸性粒细胞(绿色箭头所示)及淋巴细胞浸润;C:ADSC组小鼠空肠黏膜层绒毛结构部分破坏,无明显水肿,有少量嗜酸性粒细胞及淋巴细胞(红色箭头所示)浸润;D:CpG-ODN组小鼠空肠黏膜层绒毛结构部分破坏,无水肿,有少量嗜酸性粒细胞及淋巴细胞浸润。 |
2.4 各组小鼠血清OVA-IgE水平变化
与对照组相比,过敏组血清中OVA-IgE水平升高(P < 0.05);ADSC组、CpG-ODN组血清OVA-IgE水平低于过敏组(P < 0.05),但仍高于对照组(P < 0.05);ADSC组血清OVA-IgE水平与CpG-ODN组比较差异无统计学意义(P > 0.05)。提示ADSC和非甲基化CpG-ODN均可降低过敏小鼠血清中OVA-IgE水平;且两种治疗方法对降低过敏小鼠血清OVA-IgE水平无差异。见表 1。
| 表 1 各组小鼠血清OVA-IgE及外周血CD4+CD25+Treg表达水平比较 (n=10,x±s) |
2.5 各组小鼠外周血CD4+CD25+Treg水平变化
与对照组相比,过敏组外周血中CD4+CD25+Treg水平降低(P < 0.05);ADSC组、CpG-ODN组外周血中CD4+CD25+Treg水平均高于过敏组(P < 0.05),且与对照组比较差异无统计学意义(P > 0.05),说明ADSC和非甲基化CpG-ODN均可提高过敏小鼠外周血中CD4+CD25+Treg的表达水平;ADSC组外周血CD4+CD25+Treg水平与CpG-ODN组比较差异无统计学意义(P > 0.05),说明两种治疗方法对提高过敏小鼠外周血CD4+CD25+Treg表达水平无明显差异。见图 4,表 1。
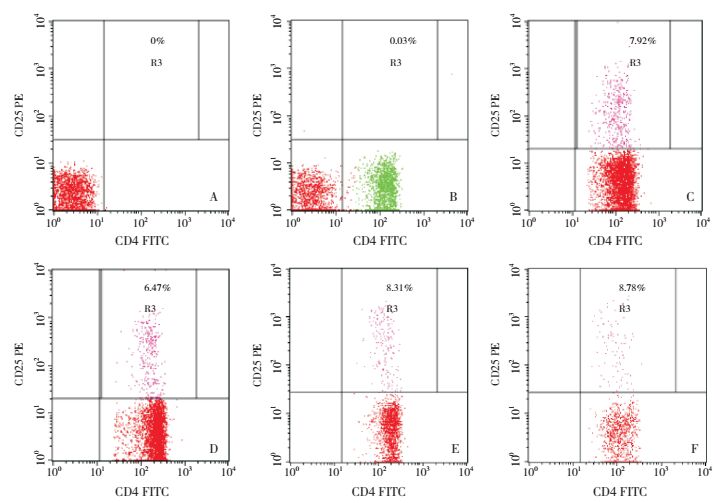
|
图 4 流式细胞术检测各组小鼠外周血中CD4+CD25+Treg表达水平 A为空白对照;B为同型对照;C为对照组;D为过敏组;E为ADSC组;F为CpG-ODN组。R3区域表示CD4+CD25+Treg占CD4+T细胞的百分比。 |
3 讨论
ADSC、非甲基化CpG-ODN对FA患者体内CD4+CD25+Treg表达水平的影响报道较少,既往研究提示CD4+CD25+Treg与免疫耐受有关,本课题组推测在FA中可能存在CD4+CD25+Treg数量减少和/或功能不全,非甲基化CpG-ODN及ADSC可能提高FA模型小鼠外周血中CD4+CD25+Treg的表达水平,本研究从CD4+CD25+Treg的角度对FA免疫耐受机制做进一步探讨。
Treg是一类具有免疫调节功能的T淋巴细胞亚群,在维持机体免疫平衡方面起着重要作用[6]。在Treg家族中,CD4+CD25+Treg是最重要的,也是研究最多的。CD4+CD25+Treg是一类专职免疫细胞,发挥非特异性免疫抑制作用,不受组织相容性复合体的限制。相关研究发现,CD4+CD25+Treg数量减少和/或功能紊乱均可导致各种免疫性疾病[7]。本实验研究结果显示,过敏组小鼠外周血中CD4+CD25+Treg表达水平低于对照组。目前认为其发生的机制可能是:(1)CD4+CD25+Treg可与树突状细胞相互作用,抑制对T细胞的抗原提呈作用,直接或间接发挥免疫负向调节作用,诱导效应T细胞凋亡[8];(2)CD4+CD25+Treg通过分泌具有免疫抑制作用的细胞因子(如TGF-β1、IL-10),发挥免疫调节作用;(3)在趋化因子的作用下,CD4+CD25+Treg可迁移至免疫应答的部位,通过其细胞表面的细胞毒性T淋巴细胞相关抗原4与效应细胞的相关配体结合,发挥免疫抑制作用[9]。当CD4+CD25+Treg数量减少,免疫抑制效能不足,可能是引起小鼠FA的主要机制之一。
本课题组前期研究已表明,非甲基化CpG-ODN及ADSC对FA及其相关细胞因子有一定的干预作用[3-5]。本研究旨在观察非甲基化CpG-ODN、ADSC对FA小鼠外周血CD4+CD25+Treg的影响,探究其发病机制。间充质干细胞是一种具有分化增殖和自我更新潜能的多能性干细胞,具有免疫调节和低免疫原性的特点[10-11]。ADSC是除骨髓间充质干细胞(MSCs)外重要的间充质干细胞来源,其组织来源丰富,具有非特异性的免疫调节能力,现已广泛用于各种炎性疾病及免疫性疾病的研究[12-13]。Kavanagh等[14]以及Nemeth等[15]在实验中发现,MSCs使得CD4+Foxp3+Treg的表达水平上调,能够有效地减轻过敏性疾病的症状。Kavanagh等[14]对哮喘大鼠模型进行MSCs移植,结果发现MSCs组大鼠的CD4+CD25+Treg水平明显高于模型组。通过检测过敏性鼻炎小鼠模型中IL-10及其mRNA的水平,提示回输ADSC可显著增加IL-10及其mRNA的表达水平[16]。与上述实验结果类似,本研究结果显示:ADSC干预组小鼠CD4+CD25+Treg的表达水平高于过敏组,可能与ADSC上调了外周血中CD4+CD25+Treg水平,TGF-β1分泌增加,抑制T淋巴细胞、B淋巴细胞、巨噬细胞的增殖与活化[17]有关,从而抑制了过度或偏移的免疫反应,使过敏症状减轻。
CpG-ODN是以胞嘧啶、鸟嘌呤结构为核心的寡核苷酸序列,是一种新兴的免疫佐剂。CpG-ODN主要与表达在树突状细胞及单个核细胞等免疫细胞上的识别受体—Toll样受体9结合,发挥免疫调节作用。CpG-ODN可使巨噬细胞和NK细胞活化,分泌IFN-γ、IL-12,诱导Th1反应,同时抑制IL-4、IL-5的分泌,使Th2反应向Th1反应逆转,维持Th1/Th2平衡。相关研究发现,CpG-ODN与Toll样受体9结合可以调整体内的骨化三醇,从而诱导调节性T细胞分泌IL-10,调控免疫反应[18]。本实验结果显示:CpG-ODN组小鼠外周血CD4+CD25+Treg水平高于过敏组,说明非甲基化CpG-ODN可以提高外周血中CD4+CD25+Treg水平。
本研究提示,ADSC、非甲基化CpG-ODN干预治疗可以降低FA幼鼠过敏症状评分,改善症状,同时,也可明显降低其血清中OVA-IgE含量,提高CD4+CD25+Treg表达水平,且两种治疗方法疗效相当,在诱导FA免疫耐受中发挥作用,但具体机制尚需深入研究。
| [1] | Akdis M, Akdis CA. Mechanisms of allergen-specific immunotherapy:multiple suppressor factors at work in immune tolerance to allergens[J]. J Allergy Clin Immunol, 2014, 133 (3): 621–631. DOI:10.1016/j.jaci.2013.12.1088 |
| [2] | Sakaguchi S, Sakaguchi N, Assno M, et al. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25)[J]. J Immunol, 1995, 155 (3): 1151–1164. |
| [3] | 来艳如, 郑成中. 脂肪间充质干细胞移植对食物过敏小鼠免疫干预作用[J]. 中国当代儿科杂志, 2016, 18 (7): 656–661. DOI:10.7499/j.issn.1008-8830.2016.07.017 |
| [4] | 王本贞, 郑成中. CPG寡核苷酸对卵清蛋白致敏幼鼠血清中Th1/Th2细胞因子及肥大细胞趋化蛋白1的影响[J]. 解放军医学院学报, 2015, 36 (5): 505–509. |
| [5] | 王本贞, 郑成中. 非甲基化CpG-ODN对卵清蛋白致食物过敏幼鼠血清TGF-β的影响及免疫调节作用[J]. 中国当代儿科杂志, 2015, 17 (8): 864–868. DOI:10.7499/j.issn.1008-8830.2015.08.020 |
| [6] | Dasgupta A, Saxena R. Regulatory T cells:a review[J]. Natl Med J India, 2012, 25 (6): 341–351. |
| [7] | Shalev I, Schmelzle M, Robson SC, et al. Making sense of regulatory T cell suppressive function[J]. Semin Immunol, 2011, 23 (4): 282–292. DOI:10.1016/j.smim.2011.04.003 |
| [8] | Mavinkurve-Groothuis AM, Marcus KA, Pourier M, et al. Myocardial 2D strain echocardiography and cardiac biomarkers in children during and shortly after anthracycline therapy for acute lymphoblastic leukaemia (ALL):a prospective study[J]. Eur Heart J Cardiovasc Imaging, 2013, 14 (6): 562–569. DOI:10.1093/ehjci/jes217 |
| [9] | 孙美, 张士发. 调节性T细胞在哮喘中的研究进展[J]. 国际儿科学杂志, 2014, 41 (1): 22–24. |
| [10] | James S, Fox J, Afsari F, et al. Multiparameter analysis of human bone marrow stromal cells identifies distinct immunomodulatory and differentiation-competent subtypes[J]. Stem Cell Reports, 2015, 4 (6): 1004–1015. DOI:10.1016/j.stemcr.2015.05.005 |
| [11] | Fan L, Yu Z, Li J, et al. Immunoregulation effects of bone marrow-derived mesenchymal stem cells in xenogeneic acellular nerve grafts transplant[J]. Cell Mol Neurobiol, 2014, 34 (7): 999–1010. DOI:10.1007/s10571-014-0076-3 |
| [12] | 樊艳, 王建军, 魏峰, 等. 脂肪间充质干细胞移植对心肌梗死后炎症反应及心室重构的影响[J]. 中国组织工程研究, 2014, 18 (6): 900–905. DOI:10.3969/j.issn.2095-4344.2014.06.013 |
| [13] | Hofmann U, Frantz S. How can we cure a heart "in flame"? A translational view on inflammation in heart failure[J]. Basic Res Cardiol, 2013, 108 (4): 356. DOI:10.1007/s00395-013-0356-y |
| [14] | Kavanagh H, Mahon BP. Allogeneic mesenchymal stem cells prevent allergic airway inflammation by inducing murine regulatory T cells[J]. Allergy, 2011, 66 (4): 523–531. DOI:10.1111/all.2011.66.issue-4 |
| [15] | Nemeth K, Keane-Myers A, Brown JM, et al. Bone marrow stromal cells use TGF-beta to suppress allergic responses in a mouse model of ragweed-induced asthma[J]. Proc Natl Acad Sci U S A, 2010, 107 (12): 5652–5657. DOI:10.1073/pnas.0910720107 |
| [16] | 李冠雪, 刘艳慧, 申聪香, 等. 脂肪来源间充质干细胞调控变应性鼻炎小鼠T细胞免疫状态的研究[J]. 中华耳鼻咽喉头颈外科杂志, 2016, 51 (1): 50–56. |
| [17] | 黄雪琼, 檀卫平, 吴葆菁, 等. 骨髓间充质干细胞对重症哮喘患儿外周血Th17/Treg的免疫调节作用[J]. 中国病理生理杂志, 2014, 30 (9): 1694–1697. |
| [18] | Urry Z, Xystrakis E, Richards DF, et al. Ligation of TLR9 induced on human IL-10-secreting Tregs by 1 alpha, 25-dihydroxyvitamin D3 abrogates regulatory function[J]. J Clin Invest, 2009, 119 (2): 387–398. |
 2017, Vol. 19
2017, Vol. 19