表观遗传学是指在不涉及DNA碱基序列改变的情况下,基因表达水平的可遗传性改变。表观遗传修饰主要包括DNA甲基化、组蛋白修饰、染色质重塑和非编码RNA调控。DNA甲基化是指在DNA甲基转移酶的催化下,以S-腺嘌呤蛋氨酸(S-adenosylmethionine, SAM)为甲基供体,在基因组某些特定区域胞嘧啶分子的5'碳原子上添加1个甲基基团的化学修饰。上述调控方式对保持基因组的稳定和调节基因表达起着重要作用[1-3]。大量的动物研究和流行病学资料表明,孕期甲基供体营养素可通过改变子代的表观遗传特征,尤其是DNA甲基化,影响某些关键基因的表达,从而造成子代相应表型的改变[4-8]。
叶酸、维生素B12、胆碱、甜菜碱和蛋氨酸等营养素作为甲基供体,主要是通过影响一碳单位的代谢途径,进而对DNA甲基化造成影响。一碳代谢作为细胞代谢的重要组成部分,参与了机体许多关键的代谢反应(如嘌呤、嘧啶的合成)[9-12]。因此,孕期甲基供体营养素的缺失或过剩,都可能影响DNA甲基化,干扰细胞正常的代谢,从而对子代健康造成深远的影响。现就孕期甲基供体营养素、DNA甲基化与子代健康之间的复杂关系与研究现状综述如下。
1 甲基供体、一碳单位代谢与DNA甲基化叶酸、维生素B12、胆碱、甜菜碱和蛋氨酸都是一碳单位代谢途径的重要组成物质。在叶酸还原酶的作用下,叶酸先生成二氢叶酸(dihydrofolic acid, DHF),再转化为四氢叶酸(tetrahydrofolic acid, THF)。四氢叶酸在丝氨酸羟甲基转移酶的催化下,以维生素B6为辅酶,转化成5,10-亚甲基四氢叶酸,然后在依赖维生素B2的亚甲基四氢叶酸还原酶的作用下进一步转化成5-甲基四氢叶酸。上述反应的关键是提供活性甲基,使同型半胱氨酸在依赖维生素B12的蛋氨酸合酶作用下再甲基化生成蛋氨酸。另一方面,胆碱转化为甜菜碱产生一碳单位的代谢也可提供不稳态甲基,用于同型半胱氨酸形成蛋氨酸。蛋氨酸是SAM的底物。作为转甲基反应中甲基的直接供体,SAM参与了体内包括DNA、RNA、蛋白质、脂质等多个甲基化反应。一碳单位的代谢过程如图 1所示[13]。因此,孕期饮食中上述任一物质的缺失或过量都可能导致一碳单位代谢紊乱,继而引起DNA甲基化的异常,从而影响子代的健康。
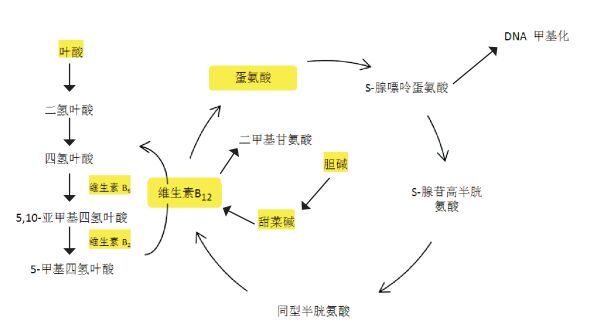
|
图 1 一碳单位的代谢通路 |
2 孕期甲基供体营养素缺乏与DNA甲基化 2.1 叶酸
叶酸是被研究最为广泛的营养素之一。孕期叶酸的补充在促进细胞正常生长、分化,防止神经管畸形,促进胎儿健康生长等方面发挥重要的作用[14-16]。但孕期叶酸水平与子代各种疾病发生的具体机制尚未完全阐明,近年来,越来越多的学者试图从表观遗传修饰的角度,尤其是DNA甲基化这一方向上来探讨可能的机制。
为了探索宫内和断乳后叶酸供应对子代DNA甲基化谱的影响,McKay等[17]在构建了相应的小鼠模型后发现,与正常组相比,孕期低叶酸饮食,其子代成年时小肠基因组的甲基化水平降低,且断乳后予叶酸补充,DNA甲基化的状态也不会随之改变。此研究结果表明孕期的叶酸缺乏可能对子代的表观印记产生深远的影响,且此效应难以随生后的饮食补充而得以改变。Chang等[18]在分析了神经管畸形胚胎与正常对照胚胎的组织甲基化水平与母体叶酸水平的关系后发现,神经管畸形胚胎脑的整体甲基化水平较正常对照组要低,且母亲的叶酸水平与胚胎的甲基化水平呈现相关关系。但其他组织的甲基化状态和模式却与脑组织表现截然不同。此结果表明选取的研究对象不同,不同组织的DNA甲基化水平表现也存在差异。最近的一项研究也证实了上述结论,Amarasekera等[19]的研究表明母体叶酸水平的差异并不会对子代总体DNA甲基化水平造成影响,但作者在比较了两组特异位点的甲基化水平后,发现ZFP57基因(调节与维持DNA甲基化的关键基因)在高叶酸组表现为低甲基化,且其启动子区的H3/H4乙酰化水平和mRNA表达都相对增高。因此,作者推测,围生期的叶酸缺乏可能促使机体发起一种保护机制,即通过调节ZFP57基因的表达来稳定DNA甲基化水平。
胰岛素样生长因子(IGF)-1、IGF-2是胚胎以及出生后调控生长发育的重要因子[20-21]。近年来,不少学者认为IGF-1、IGF-2基因的甲基化改变可能参与孕期叶酸缺乏所致子代生长发育的异常。Yang等[22]发现叶酸缺乏会导致海马神经元细胞停滞在G0/G1期,凋亡率增加,而予IGF-1补充则可改善上述情况,且叶酸缺乏会降低IGF-1浓度并导致其下游信号通路的异常,而IGF-1基因启动子区则表现为高甲基化,表明IGF-1基因甲基化的改变及其信号通路的异常参与了叶酸缺乏所致的细胞表型的改变。而另外两项动物研究也都证实了围生期的叶酸缺乏可以影响子代的IGF-2的表达[23-24]。但IGF-1、IGF-2基因是如何通过甲基化的改变从而介导下游基因表达的变化,则需要进一步研究。
2.2 维生素B12作为甲基转移反应的重要辅酶之一,维生素B12对维持神经功能也有重要作用[25]。近来的研究表明[26],孕期维生素B12缺乏可通过影响子代总体DNA甲基化水平,造成染色体不稳定和DNA合成与修复障碍,进而导致后代表型的改变。Kulkarni等[27]发现与正常对照组相比,孕期予高叶酸但缺乏维生素B12的饮食,胎盘的总体DNA甲基化水平会下降。Ciappio等[28]也发现孕期多种B族维生素的缺乏会增加子代对肿瘤的易感性,且伴随着总体DNA甲基化水平的下降。此外,还有一些研究初步探讨了母体的维生素B12水平与特定基因DNA甲基化的关系。一项研究在测定了母体的维生素B12水平和婴儿的甲基化状态后发现,婴儿IGFBP3基因(与胎儿功能生长密切相关的基因)位点的甲基化水平与自身的维生素B12水平呈负相关关系,而总体甲基化水平则与母亲的维生素B12水平呈负相关关系[29]。另一项研究分析了母体血清、脐带血中的叶酸、维生素B12水平与IGF-2基因(调控胚胎生长发育的基因)启动子区的甲基化关系,发现脐血中IGF的甲基化模式与叶酸水平无相关关系,但与母体血清维生素B12水平呈相关关系[30]。上述研究表明母体的维生素B12水平可影响婴儿的甲基化模式,但具体机制尚需要进一步的研究。
2.3 胆碱胆碱是构成和维持细胞结构的必需物质,不仅参与了细胞膜的形成,同时在调控脂质代谢和神经传导方面都有着重要的意义[31-32]。
一系列动物研究表明,孕期胆碱的水平可影响胚胎海马组织的血管和神经形成,进而导致持续终生的记忆力的改变[33]。
Niculescu[34]发现小鼠孕期予胆碱缺乏饮食,其子代胚胎海马区的全基因组甲基化水平下降,且Cdkn3基因(抑制细胞周期的基因)表现低甲基化状态,导致下游蛋白表达增加。上述结果表明孕期胆碱缺乏可能通过改变与细胞周期调控相关基因的DNA甲基化的水平,从而影响子代的脑发育。从理论的角度分析,研究者认为甲基供体缺乏会引起基因组低甲基化。但另一研究却发现孕期胆碱缺乏导致了肝脏组织全基因组和IGF-2基因的高甲基化,作者分析可能与DNMT1基因(促进甲基化的基因)的低甲基化相关,DNMT1基因的低甲基化,使得其mRNA水平表达上调,促进DNA甲基化的发生,从而导致全基因组与特定基因的高甲基化。由于此项研究胆碱缺乏的时间较为短暂(孕11~17 d),母体短期的胆碱缺乏,可能引起机体反馈性升高DNMT1基因水平来维持基因组甲基化水平的稳定[35]。
2.4 多种营养素相比于单一营养素的缺乏,多种营养素的缺失可能会对机体造成更复杂更深远的影响。一项动物研究发现,妊娠期限制母体多种营养素(维生素B12、叶酸和蛋氨酸)的供应后,与正常饮食组相比,限制饮食组子代成年后肥胖、胰岛素抵抗发生率大大增加,且伴随着免疫功能的改变,男性子代高血压的风险也大大提高[36]。分析了限制饮食组肝脏组织的甲基化情况后发现,基因组存在广泛的甲基化谱的改变,且半数以上发生改变的位点都是男性所特有的。而Jiao等[37]研究发现母亲高脂饮食所导致的子代代谢失衡可通过孕期甲基饮食补充而缓解,孕期予甲基饮食补充,将降低由高脂饮食造成的子代肥胖、糖耐量受损和胰岛素抵抗的发生率。上述两个研究证实了围生期限制与一碳单位代谢相关的营养素摄入,将改变子代的DNA甲基化谱,从而对成年期的表型造成影响。而孕期予甲基饮食补充,则可能逆转由表观遗传修饰改变造成的基因和表型的变化。
3 孕期甲基供体营养补充/过剩与DNA甲基化目前关于孕期叶酸过剩的研究较多,但对于其他甲基供体营养素,尚无过剩的研究。因此下文主要讨论了孕期甜菜碱、多种营养素的补充以及叶酸过剩对DNA甲基化和子代健康的影响。
3.1 甜菜碱甜菜碱在甜菜碱高半胱氨酸甲基转移酶的催化下,转甲基给高半胱氨酸以合成蛋氨酸,进而参与到转甲基的一碳代谢中。动物研究表明甜菜碱在调控肝脏脂质代谢中发挥着重要的作用。Cai等[38]的研究表明与对照组相比,孕期予甜菜碱补充饮食,其子代肝脏的甘油三酯含量下降,脂肪酸合成酶的mRNA和蛋白表达水平降低,且伴随着其基因启动子区甲基化水平的增加。此研究表明孕期的甜菜碱供应可通过对子代脂肪合成关键基因的表观调控,来影响脂肪合成相关关键酶的活性,从而影响子代的脂肪合成。而另两项研究也证实了孕期饮食的甜菜碱补充可通过对子代脂质代谢关键基因的复杂的表观调控机制,从而在转录水平调节基因的表达量来影响脂肪代谢[39-40]。
3.2 多种营养素相比于单一营养素(甜菜碱)的补充,多种营养素的补充对脂肪代谢的影响更为显著。Cordero等[41]发现饮食的多种甲基营养素(叶酸、维生素B12、甜菜碱和胆碱)的补充可改善由高脂饮食介导的肝脏甘油三酯的累积;而肝脏广泛的基因表达谱的改变以及脂肪酸合成酶DNA的高甲基化可能是改善脂质代谢的原因。作者通过对脂肪合成和脂肪分解的通路分析表明,予以甲基饮食供应虽然会增加总的甘油三酯的量,但却可以通过促进脂肪分解减少其过度堆积。多数的动物研究表明围孕期补充甲基相关营养素有益于子代健康。但Schaible等[42]的研究却发现母亲饮食的甲基营养素供应也可能给子代健康带来不利的影响。研究结果表明母体甲基饮食(叶酸、维生素B12、甜菜碱和胆碱)的补充会改变子代肠道的微生态,并增加子代结肠炎的易感性,且此表型与结肠黏膜的DNA甲基化改变相关。
3.3 叶酸近年来,由于人们生活水平的不断提高,孕期营养过剩不是一个少见现象。因此孕期过度营养或是某些营养素的过剩对子代健康的影响也成为了研究者关注的热点。有学者提出:食物的叶酸强化补充和孕期额外的叶酸补充剂也可能造成孕期叶酸补充过度,从而对子代健康带来诸多不利的因素[43]。
Shorter等[43]回顾了近年来的文献后发现随着叶酸饮食的强化,自闭症的发病风险也相对增加(从2000年的1/250增加到2013年的1/68)。但多项流行病学资料的结果尚存在争议。一项研究表明孕期过度补充叶酸会增加子代自闭症的风险[44];另一项研究则发现,自闭症患儿的母亲,其血浆叶酸和蛋氨酸水平都较正常组低[45];而最近的一项研究则表明两者并无相关关系[46]。虽然目前的研究尚不能明确孕期叶酸补充对子代自闭症的影响,但是越来越多的证据显示相较于正常儿童,自闭症患者存在多个基因的甲基化状态异常。
此外,孕期叶酸水平与子代癌症的发病风险之间的关系也是许多学者争论的焦点。为了探索孕期及断乳后叶酸补充对子代乳腺癌的影响,Ly等[47]分别在孕期及断乳后对动物进行饮食干预,结果发现,孕期和断乳后叶酸补充组显著增加了子代乳腺腺癌的发生风险,而单纯孕期叶酸补充组子代乳腺腺癌的发生率和肿瘤负荷也明显增加,并伴随着全基因组的甲基化的降低。而另一项动物研究则表明孕期叶酸补充可以降低子代结直肠腺癌的发生风险,且孕期的叶酸补充增加了全基因组DNA甲基化水平,作者推测甲基化水平的增加,上皮增生率以及结直肠的DNA损害的下降可能是结直肠腺癌发病风险下降的重要原因[48]。
孕期的叶酸补充对子代健康的影响是多方面的,我们既要充分肯定叶酸在预防神经管畸形方面的重要作用,也要避免过度的营养负担对子代带来的远期的不利影响。
孕期营养是保证子代健康生长的重要因素,宫内营养不良或者宫内营养过剩对胚胎的发育以及子代的远期健康都是不利的。鉴于表观遗传修饰的可逆性,即基因组DNA甲基化状态可随营养和环境的改变而改变,探究孕期营养对子代健康的表观遗传影响机制,有助于发现有潜在致病相关的基因和/或位点以期望通过对表观修饰的早期干预来改变不良结局。
| [1] | Akhavan-Niaki H, Samadani AA. DNA methylation and cancer development:molecular mechanism[J]. Cell Biochem Biophys, 2013, 67 (2): 501–513. DOI:10.1007/s12013-013-9555-2 |
| [2] | Crider KS, Yang TP, Berry RJ, et al. Folate and DNA methylation:a review of molecular mechanisms and the evidence for folate's role[J]. Adv Nutr, 2012, 3 (1): 21–38. DOI:10.3945/an.111.000992 |
| [3] | Lillycrop KA, Burdge GC. Maternal diet as a modifier of offspring epigenetics[J]. J Dev Orig Health Dis, 2015, 6 (2): 88–95. DOI:10.1017/S2040174415000124 |
| [4] | Gabory A, Attig L, Junien C. Developmental programming and epigenetics[J]. Am J Clin Nutr, 2011, 94 (6 Suppl): 1943S–1952S. |
| [5] | Geraghty AA, Lindsay KL, Alberdi G, et al. Nutrition during pregnancy impacts offspring's epigenetic status-evidence from human and animal studies[J]. Nutr Metab Insights, 2016, 8 (Suppl 1): 41–47. |
| [6] | Glier MB, Green TJ, Devlin AM. Methyl nutrients, DNA methylation, and cardiovascular disease[J]. Mol Nutr Food Res, 2014, 58 (1): 172–182. DOI:10.1002/mnfr.v58.1 |
| [7] | Imbard A, Benoist JF, Blom HJ. Neural tube defects, folic acid and methylation[J]. Int J Environ Res Public Health, 2013, 10 (9): 4352–4389. DOI:10.3390/ijerph10094352 |
| [8] | Martinez JA, Cordero P, Campión J, et al. Interplay of early-life nutritional programming on obesity, inflammation and epigenetic outcomes[J]. Proc Nutr Soc, 2012, 71 (2): 276–283. DOI:10.1017/S0029665112000055 |
| [9] | Dominguez-Salas P, Cox SE, Prentice AM, et al. Maternal nutritional status, C (1) metabolism and offspring DNA methylation:a review of current evidence in human subjects[J]. Proc Nutr Soc, 2012, 71 (1): 154–165. DOI:10.1017/S0029665111003338 |
| [10] | Padmanabhan N, Watson ED. Lessons from the one-carbon metabolism:passing it along to the next generation[J]. Reprod Biomed Online, 2013, 27 (6): 637–643. DOI:10.1016/j.rbmo.2013.09.008 |
| [11] | Singh K, Jaiswal D. One-carbon metabolism, spermatogenesis, and male infertility[J]. Reprod Sci, 2013, 20 (6): 622–630. DOI:10.1177/1933719112459232 |
| [12] | Steegers-Theunissen RP, Twigt J, Pestinger V, et al. The periconceptional period, reproduction and long-term health of offspring:the importance of one-carbon metabolism[J]. Hum Reprod Update, 2013, 19 (6): 640–655. DOI:10.1093/humupd/dmt041 |
| [13] | Anderson OS, Sant KE, Dolinoy DC. Nutrition and epigenetics:an interplay of dietary methyl donors, one-carbon metabolism and DNA methylation[J]. J Nutr Biochem, 2012, 23 (8): 853–859. DOI:10.1016/j.jnutbio.2012.03.003 |
| [14] | Barua S, Kuizon S, Junaid MA. Folic acid supplementation in pregnancy and implications in health and disease[J]. J Biomed Sci, 2014, 21 : 77. DOI:10.1186/s12929-014-0077-z |
| [15] | McGlynn AP, Wasson GR, O'Reilly SL, et al. Low colonocyte folate is associated with uracil misincorporation and global DNA hypomethylation in human colorectum[J]. J Nutr, 2013, 143 (1): 27–33. DOI:10.3945/jn.112.167148 |
| [16] | Singh MD, Thomas P, Owens J, et al. Potential role of folate in pre-eclampsia[J]. Nutr Rev, 2015, 73 (10): 694–722. DOI:10.1093/nutrit/nuv028 |
| [17] | McKay JA, Waltham KJ, Williams EA, et al. Folate depletion during pregnancy and lactation reduces genomic DNA methylation in murine adult offspring[J]. Genes Nutr, 2011, 6 (2): 189–196. DOI:10.1007/s12263-010-0199-1 |
| [18] | Chang H, Zhang T, Zhang Z, et al. Tissue-specific distribution of aberrant DNA methylation associated with maternal low-folate status in human neural tube defects[J]. J Nutr Biochem, 2011, 22 (12): 1172–1177. DOI:10.1016/j.jnutbio.2010.10.003 |
| [19] | Amarasekera M, Martino D, Ashley S, et al. Genome-wide DNA methylation profiling identifies a folate-sensitive region of differential methylation upstream of ZFP57-imprinting regulator in humans[J]. FASEB J, 2014, 28 (9): 4068–4076. DOI:10.1096/fj.13-249029 |
| [20] | Agrogiannis GD, Sifakis S, Patsouris ES, et al. Insulin-like growth factors in embryonic and fetal growth and skeletal development (Review)[J]. Mol Med Rep, 2014, 10 (2): 579–584. |
| [21] | Ziegler AN, Levison SW, Wood TL. Insulin and IGF receptor signaling in neural-stem-cell homeostasis[J]. Nat Rev Endocrinol, 2015, 11 (3): 161–170. |
| [22] | Yang Y, Li X, Sun Q, et al. Folate deprivation induces cell cycle arrest at G0/G1 phase and apoptosis in hippocampal neuron cells through down-regulation of IGF-1 signaling pathway[J]. Int J Biochem Cell Biol, 2016, 79 : 222–230. DOI:10.1016/j.biocel.2016.08.040 |
| [23] | Kim HW, Kim KN, Choi YJ, et al. Effects of paternal folate deficiency on the expression of insulin-like growth factor-2 and global DNA methylation in the fetal brain[J]. Mol Nutr Food Res, 2013, 57 (4): 671–676. DOI:10.1002/mnfr.v57.4 |
| [24] | 李屾, 梁良, 姚志刚, 等. 叶酸缺乏致胎鼠宫内发育迟缓及肝脏胰岛素生长因子系统表达变化[J]. 现代生物医学进展, 2014, 14 (4): 601–607. |
| [25] | da Silva VC, Fernandes L, Haseyama EJ, et al. Effect of vitamin B deprivation during pregnancy and lactation on homocysteine metabolism and related metabolites in brain and plasma of mice offspring[J]. PLoS One, 2014, 9 (4): e92683. DOI:10.1371/journal.pone.0092683 |
| [26] | Rush EC, Katre P, Yajnik CS. Vitamin B12:one carbon metabolism, fetal growth and programming for chronic disease[J]. Eur J Clin Nutr, 2014, 68 (1): 2–7. DOI:10.1038/ejcn.2013.232 |
| [27] | Kulkarni A, Dangat K, Kale A, et al. Effects of altered maternal folic acid, vitamin B12 and docosahexaenoic acid on placental global DNA methylation patterns in Wistar rats[J]. PLoS One, 2011, 6 (3): e17706. DOI:10.1371/journal.pone.0017706 |
| [28] | Ciappio ED, Liu Z, Brooks RS, et al. Maternal B vitamin supplementation from preconception through weaning suppresses intestinal tumorigenesis in Apc1638N mouse offspring[J]. Gut, 2011, 60 (12): 1695–1702. DOI:10.1136/gut.2011.240291 |
| [29] | McKay JA, Groom A, Potter C, et al. Genetic and non-genetic influences during pregnancy on infant global and site specific DNA methylation:role for folate gene variants and vitamin B12[J]. PLoS One, 2012, 7 (3): e33290. DOI:10.1371/journal.pone.0033290 |
| [30] | Ba Y, Yu H, Liu F, et al. Relationship of folate, vitamin B12 and methylation of insulin-like growth factor-II in maternal and cord blood[J]. Eur J Clin Nutr, 2011, 65 (4): 480–485. DOI:10.1038/ejcn.2010.294 |
| [31] | Biswas S, Giri S. Importance of choline as essential nutrient and its role in prevention of various toxicities[J]. Prague Med Rep, 2015, 116 (1): 5–15. DOI:10.14712/23362936.2015.40 |
| [32] | Jiang X, West AA, Caudill MA. Maternal choline supplementation:a nutritional approach for improving offspring health?[J]. Trends Endocrinol Metab, 2014, 25 (5): 263–273. DOI:10.1016/j.tem.2014.02.001 |
| [33] | Zeisel SH. The supply of choline is important for fetal progenitor cells[J]. Semin Cell Dev Biol, 2011, 22 (6): 624–628. DOI:10.1016/j.semcdb.2011.06.002 |
| [34] | Niculescu MD. Dietary choline deficiency alters global and gene-specific DNA methylation in the developing hippocampus of mouse fetal brains[J]. FASEB J, 2006, 20 (1): 43–49. DOI:10.1096/fj.05-4707com |
| [35] | Kovacheva VP, Mellott TJ, Davison JM, et al. Gestational choline deficiency causes global and Igf2 gene DNA hypermethylation by up-regulation of Dnmt1 expression[J]. J Biol Chem, 2007, 282 (43): 31777–31788. DOI:10.1074/jbc.M705539200 |
| [36] | Sinclair KD, Allegrucci C, Singh R, et al. DNA methylation, insulin resistance, and blood pressure in offspring determined by maternal periconceptional B vitamin and methionine status[J]. Proc Natl Acad Sci U S A, 2007, 104 (49): 19351–19356. DOI:10.1073/pnas.0707258104 |
| [37] | Jiao F, Yan X, Yu Y, et al. Protective effects of maternal methyl donor supplementation on adult offspring of high fat diet-fed dams[J]. J Nutr Biochem, 2016, 34 : 42–51. DOI:10.1016/j.jnutbio.2016.04.005 |
| [38] | Cai D, Wang J, Jia Y, et al. Gestational dietary betaine supplementation suppresses hepatic expression of lipogenic genes in neonatal piglets through epigenetic and glucocorticoid receptor-dependent mechanisms[J]. Biochim Biophys Acta, 2016, 1861 (1): 41–50. DOI:10.1016/j.bbalip.2015.10.002 |
| [39] | Cai D, Jia Y, Lu J, et al. Maternal dietary betaine supplementation modifies hepatic expression of cholesterol metabolic genes via epigenetic mechanisms in newborn piglets[J]. Br J Nutr, 2014, 112 (9): 1459–1468. DOI:10.1017/S0007114514002402 |
| [40] | Idriss AA, Hu Y, Sun Q, et al. Prenatal betaine exposure modulates hypothalamic expression of cholesterol metabolic genes in cockerels through modifications of DNA methylation[J]. Poult Sci, 2016.[Epub ahead of print] |
| [41] | Cordero P, Gomez-Uriz AM, Campion J, et al. Dietary supplementation with methyl donors reduces fatty liver and modifies the fatty acid synthase DNA methylation profile in rats fed an obesogenic diet[J]. Genes Nutr, 2013, 8 (1): 105–113. DOI:10.1007/s12263-012-0300-z |
| [42] | Schaible TD, Harris RA, Dowd SE, et al. Maternal methyl-donor supplementation induces prolonged murine offspring colitis susceptibility in association with mucosal epigenetic and microbiomic changes[J]. Hum Mol Genet, 2011, 20 (9): 1687–1696. DOI:10.1093/hmg/ddr044 |
| [43] | Shorter KR, Felder MR, Vrana PB. Consequences of dietary methyl donor supplements:is more always better?[J]. Prog Biophys Mol Biol, 2015, 118 (1-2): 14–20. DOI:10.1016/j.pbiomolbio.2015.03.007 |
| [44] | Beard CM, Panser LA, Katusic SK. Is excess folic acid supplementation a risk factor for autism?[J]. Med Hypotheses, 2011, 77 (1): 15–17. DOI:10.1016/j.mehy.2011.03.013 |
| [45] | James SJ, Melnyk S, Jernigan S, et al. A functional polymorphism in the reduced folate carrier gene and DNA hypomethylation in mothers of children with autism[J]. Am J Med Genet B Neuropsychiatr Genet, 2010, 153B (6): 1209–1220. |
| [46] | Braun JM, Froehlich T, Kalkbrenner A, et al. Brief report:are autistic-behaviors in children related to prenatal vitamin use and maternal whole blood folate concentrations?[J]. J Autism Dev Disord, 2014, 44 (10): 2602–2607. DOI:10.1007/s10803-014-2114-x |
| [47] | Ly A, Lee H, Chen J, et al. Effect of maternal and postweaning folic acid supplementation on mammary tumor risk in the offspring[J]. Cancer Res, 2011, 71 (3): 988–997. DOI:10.1158/0008-5472.CAN-10-2379 |
| [48] | Sie KK, Medline A, van Weel J, et al. Effect of maternal and postweaning folic acid supplementation on colorectal cancer risk in the offspring[J]. Gut, 2011, 60 (12): 1687–1694. DOI:10.1136/gut.2011.238782 |
 2017, Vol. 19
2017, Vol. 19

