儿童急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)疗效较好,诱导缓解化疗的完全缓解率(complete remission, CR)高达98%,5年无事件生存率(event free survival, EFS)超过80%[1]。但初诊时年龄是影响儿童ALL疗效及预后的重要因素之一,10岁以上的儿童青少年ALL疗效及预后欠佳[2]。国内对这一特殊群体ALL的研究报道较少。现对北京大学人民医院儿科2003年4月至2013年7月收治的86例10岁以上初诊ALL患儿的临床特征、实验室检查及治疗疗效等进行回顾、总结,并分析其预后因素,报告如下。
1 资料与方法 1.1 研究对象2003年4月至2013年7月收治的10岁以上初诊ALL患儿86例中男52例、女34例,中位年龄13(10~17)岁。诊断和分型采取MICM诊断、分型标准。86例患儿中85例(1例患儿诱导缓解中死亡)于诱导缓解末进行多参数流式细胞术检测微小残留病(minimal residual disease, MRD)[3]。
1.2 危险度分级根据初诊时的最高外周血白细胞(white blood count, WBC)计数、免疫表型、细胞遗传学及分子生物学检查等分为中危和高危两组[4-5]:(1)初诊WBC≥100×109/L;(2)染色体核型为t(4;11)(q21;q23)或易位形成的融合基因MLL/AF4阳性;(3)染色体核型t(9;22)(q34;q11)或易位形成的融合基因BCR/ABL阳性;(4)诱导缓解治疗未获完全缓解。具备以上任何一项者为高危,无上述危险因素的患儿为中危。
1.3 治疗方法ALL患儿的化疗方案参考小儿急性淋巴细胞白血病诊疗建议[4-5]制定。
诱导缓解、巩固强化和再诱导治疗采用环磷酰胺(C)、长春新碱(O)、地塞米松或醋酸泼尼松(P)、柔红霉素或去甲氧柔红霉素(D)、左旋门冬酰胺酶或培门冬酶(L)、大剂量甲氨喋呤、大剂量阿糖胞苷等药物序贯、交替治疗,每半年左右应用一次CODPL方案再诱导治疗,再诱导治疗共两次。
维持治疗采用巯嘌呤(每日50 mg/m2)每晚睡前口服,以及MTX(每次20 mg/m2)每周一次肌注。根据患儿的白细胞水平及耐受程度适当调整药物剂量。总疗程女孩3年,男孩3年半。
2008年以后入院的Ph染色体阳性ALL采用甲磺酸伊马替尼(每日340 mg/m2)联合化疗方案治疗[6]。
所有患者均采用甲氨喋呤、阿糖胞苷、地塞米松三联鞘内注射预防中枢神经系统白血病(central nervous system leukemia, CNSL)。对已确诊为CSNL的患儿,在规范化疗的同时,给予较密集的三联鞘注治疗,详见参考文献[4]。
12例患儿进行了异基因造血干细胞移植(hemopoietic stem cell transplantation, HSCT),其中B-ALL 6例、T-ALL 6例。
1.4 诊断和疗效标准ALL及CNSL诊断及疗效判断参考血液病诊断及疗效标准[7]。
1.5 随访统计完成诱导缓解化疗4周以上患儿的CR率、总生存(overall survival, OS)率和无事件生存率。事件评估包括未缓解、复发、死亡、第二肿瘤。随访截至2016年8月9日。
1.6 统计学分析采用统计软件SPSS 16.0进行数据处理。计量资料以中位数(范围)表示,计数资料以百分率表示,率的比较采用卡方检验。多因素分析采用COX模型。采用Kaplan-Meier方法进行生存分析,各组生存率的比较采用log-rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料86例10岁以上的ALL患儿中,首诊表现为肝肿大的53例(62%),脾肿大50例(58%),淋巴结肿大46例(54%)。初诊时外周血WBC中位数为17.9(0.9~516.0)×109/L, < 10×109/L者33例(38%),10×109/L≤WBC < 50×109/L者24例(28%),WBC≥50×109/L者29例(34%)。
86例患儿中B-ALL 62例(72%),T-ALL 24例(28%)。中危组患儿62例(B-ALL 49例、T-ALL13例),占72%;高危组24例(B-ALL 13例、T-ALL 11例),占28%。
78例患儿进行了染色体核型分析,其中46例(59%)为正常核型;21例(27%)染色体数目异常,其中15例为超二倍体(19%),4例(5%)为亚二倍体,2例为假二倍体;11例(14%)患儿染色体结构异常,其中Ph染色体阳性1例,t(1;19)1例。
所有病例进行了融合基因检测,TEL-AML1融合基因3例(4%),E2A-PBX1融合基因3例(4%),BCR-ABL融合基因6例(7%),SIL-TAL1融合基因4例(5%)。
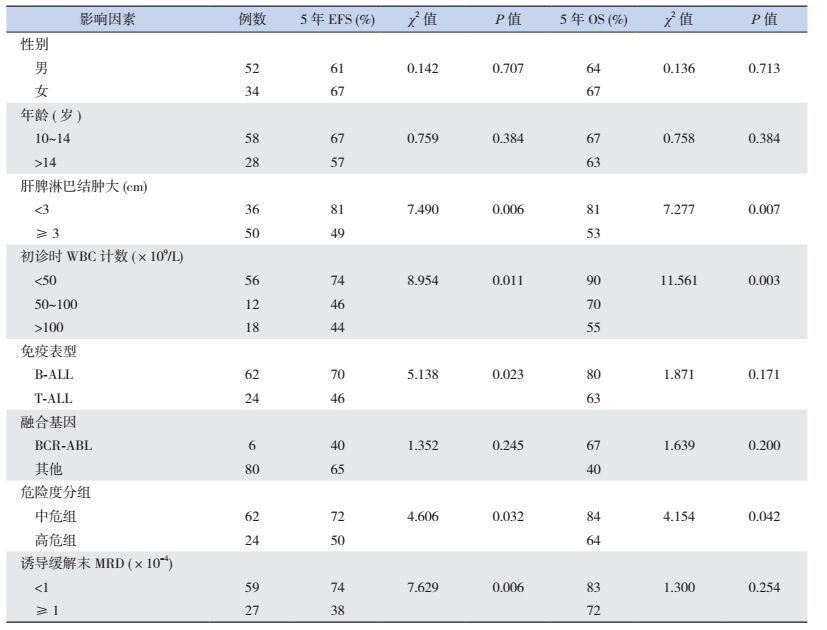
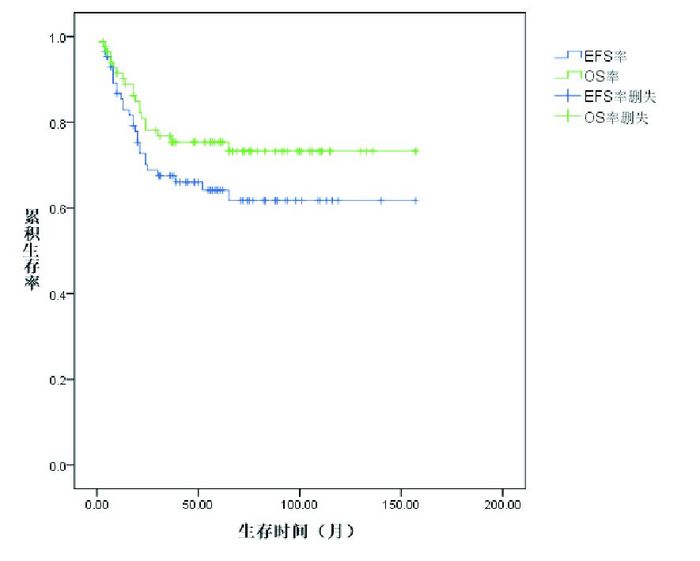
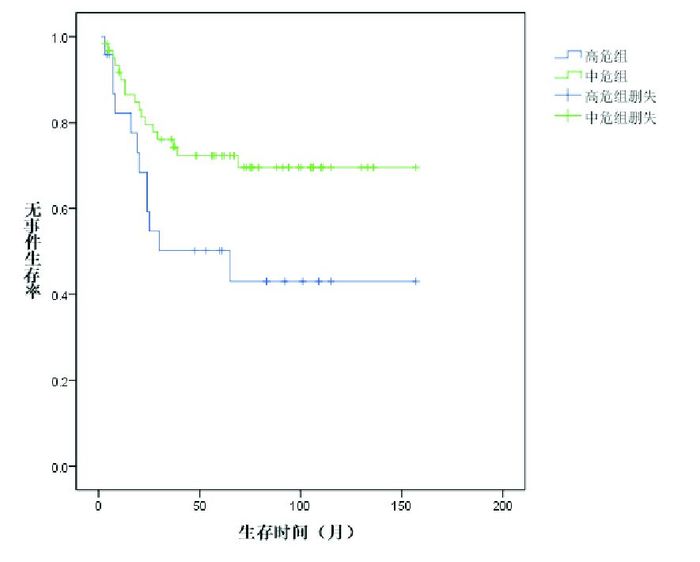
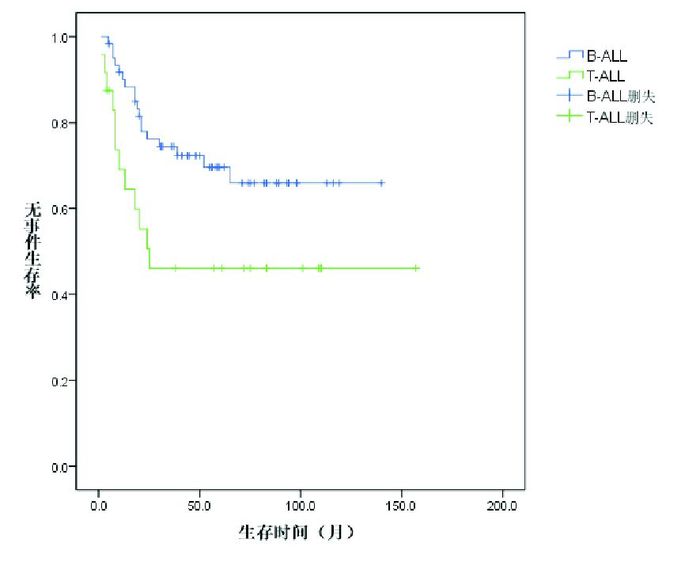
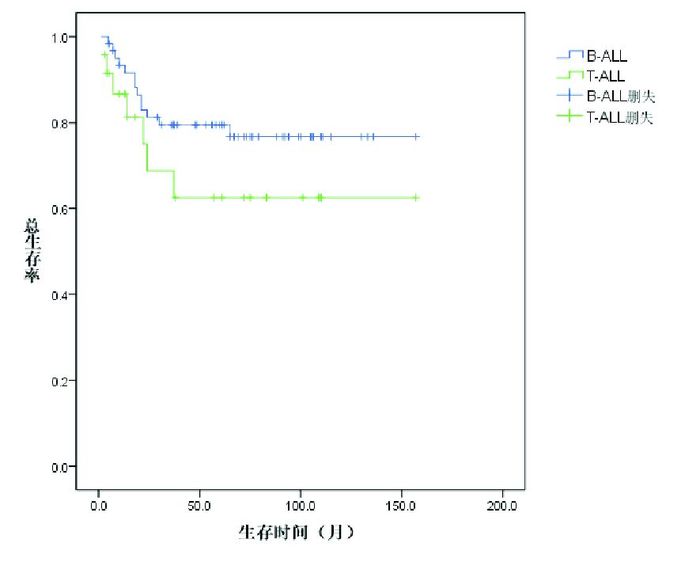
2.2 治疗疗效诱导缓解治疗4周后85例达CR,CR率99%,1例(1%)部分缓解(PR)。25例(29%)患儿复发,复发距初诊时间16(3~65)个月。死亡20例(23%),其中1例患儿在诱导缓解中因暴发性肝衰竭、肝性脑病、肺出血死亡,1例患儿在巩固强化治疗期间放弃治疗、死亡,1例患儿死于HSCT后移植排斥,其余17例为复发后死亡:5例复发后即放弃治疗、死亡,5例死于HSCT后感染、出血,7例复发后再度化疗、最终死亡。Kaplan-Meier分析表明,86例患儿5年EFS率、OS率分别为64%±6%、75%±5%,见图 1。中危组患儿5年EFS率、OS率均高于高危组(72%±6% vs 50%±11%,84%±5% vs 64%±11%),差异具有统计学意义(P < 0.05),见图 2~3。B-ALL患儿5年EFS率为70%±6%,优于T-ALL组46%±11%,差异具有统计学意义(P < 0.05);B-ALL的5年OS率为80%±50%,与T-ALL组5年OS率(63%±12%)的差异无统计学意义(P > 0.05)。见图 4~5。移植组和非移植组5年EFS率(40%±16%,67%±6%)的差异无统计学意义(P > 0.05),5年OS率(74%±16%,81%±5%)的差异也无统计学意义(P > 0.05)。
|
图 1 86例ALL患儿的生存曲线 |
|
图 2 中危组和高危组ALL患儿的无事件生存曲线 |
|
图 3 中危组和高危组ALL患儿的总生存曲线 |
|
图 4 B-ALL和T-ALL患儿的无事件生存曲线 |
|
图 5 B-ALL和T-ALL患儿的总生存曲线 |
2.3 预后因素分析
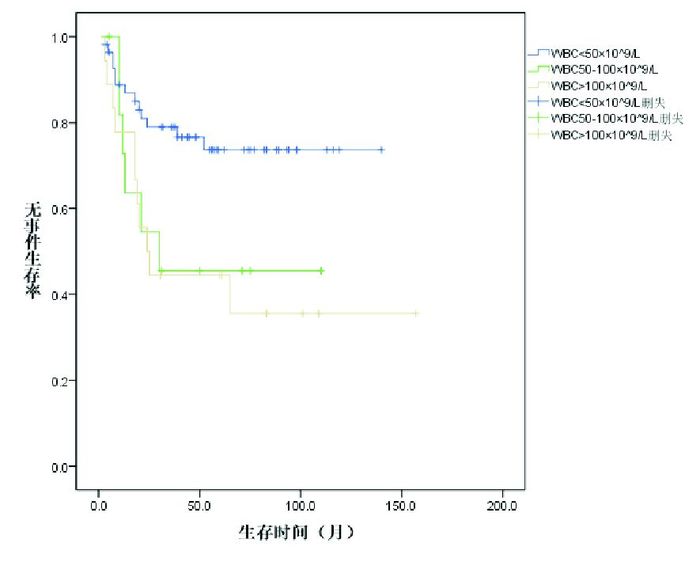
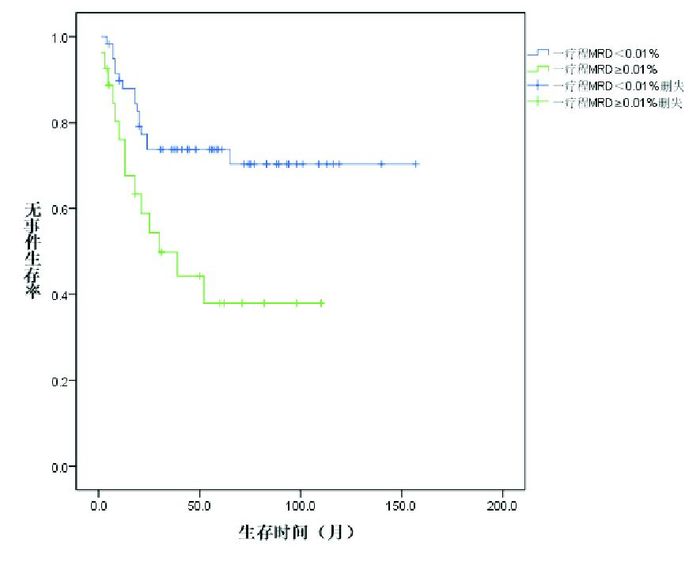
初诊时白细胞计数、肝脾淋巴结肿大的程度、危险度对EFS、OS的影响均有统计学意义(P < 0.05);免疫表型、诱导缓解末的MRD对EFS影响有统计学意义(P < 0.05),对OS的影响无统计学意义(P > 0.05);年龄、性别、融合基因对EFS、OS的影响均无统计学意义(P > 0.05)。见表 1。COX多因素回归分析显示,初诊时白细胞计数、诱导缓解末MRD是影响患儿EFS、OS的独立危险因素(图 6~7)。
| 表 1 10岁以上ALL患儿的预后因素分析 |
|
图 6 白细胞计数对ALL患儿无事件生存的影响 |
|
图 7 诱导缓解末MRD对ALL患儿无事件生存的影响 |
3 讨论
众所周知,年龄是儿童ALL患者的独立预后因素,10岁以上儿童青少年ALL在临床特征、疗效预后等方面都有其特殊性[8-12]。本组86例10岁以上的ALL患儿中半数以上存在肝脾淋巴结肿大,初诊WBC≥50×109/L者超过1/3,T-ALL比例超过1/4,融合基因BCR-ABL阳性的占7%,而预后相对较好的TEL-AML1阳性者仅占4%,临床特点与Pui等[12]报道类似。提示大年龄组患儿预后相对较差。
10岁以上ALL,尤其是14岁以上青少年ALL经常会选择在成人白血病中心接受治疗。目前法国儿童肿瘤协作组、北欧儿童血液和肿瘤学会、美国St Jude儿童医院等多个研究协助组报道,对于10岁以上的ALL病例应用儿童ALL方案的疗效明显优于应用成人ALL方案[8-11]。本研究86例10岁以上的儿童或青少年ALL患儿5年EFS率、OS率分别为64%±6%、75%±5%。与上海儿童医学中心血液肿瘤科报道非常接近[13],与发达国家的报道也基本一致[8-11],明显高于应用成人ALL方案治疗的病例[14-15]。儿童ALL方案疗效优于成人方案可能与儿童ALL应用非骨髓抑制性药物如左旋门冬酰胺酶、长春新碱、糖皮质激素、甲氨喋呤等较多,以及巩固强化、再诱导治疗以及较长周期低强度维持治疗的应用,化疗间隔较短,CNSL预防更加积极等因素有关[8, 11, 16-17]。
文献报道,除发病年龄以外,影响儿童青少年ALL预后的因素还包括初诊时白细胞计数、免疫表型、染色体核型、诱导治疗结束后的MRD等因素[18]。本研究结果表明初诊时白细胞计数是影响ALL患儿EFS、OS的独立预后因素,初诊时白细胞计数 > 50×109/L者具有更差的EFS、OS,与文献报道一致[2]。本研究B-ALL患儿的5年EFS率优于T-ALL组,表明对于10岁以上的ALL患儿,免疫分型对预后有一定影响[19]。染色体核型t(9;22)(q34;q11)或其易位形成的融合基因BCR/ABL是ALL患儿一个提示预后不良的细胞遗传学或分子遗传学表型,但近年来甲磺酸伊马替尼的引入使得这部分患儿的预后有了明显改善[6]。本研究BCR-ABL融合基因阳性组与其他融合基因阳性ALL的EFS及OS差异无统计学意义,考虑与联用了甲磺酸伊马替尼有关。本研究还发现,诱导缓解末MRD≥0.01%的患儿比MRD < 0.01%的患儿具有更差的EFS、OS,与Conter等[20]报道相似。
本研究中危组ALL患儿5年EFS率、OS率均优于高危组,说明合理的危险度分层能够帮助正确判断预后[13],高危组患儿可能需要更强烈的化疗或造血干细胞移植以改善预后。
骨髓移植在ALL患儿中的作用尚存争议,有报道青少年ALL骨髓移植相关死亡率高,但也有研究证实青少年ALL骨髓移植组的生存率高于单纯化疗组[18, 21-22]。由于本研究移植患儿例数偏少,移植组ALL患儿和非移植组的5年EFS、OS率的差异虽无统计学意义,但需要进一步扩大样本进行研究。
综上所述,10岁以上的ALL患儿具有不利的临床特征,初诊时白细胞计数、一疗程MRD是决定远期疗效的重要因素。进一步细化10岁以上儿童青少年ALL患儿的预后分层,对于优化治疗方案,进一步提高疗效具有重要意义。
| [1] | Pui CH, Campana D, Pei D, et al. Treatment of childhood acute lymphoblastic leukemia without prophylactic cranial irradiation[J]. N Engl J Med, 2009, 360 (26): 2730–2741. DOI:10.1056/NEJMoa0900386 |
| [2] | Lustosa de Sousa DW, de Almeida Ferreira FV, Cavalcante Félix FH, et al. Acute lymphoblastic leukemia in children and adolescents:prognostic factors and analysis of survival[J]. Rev Bras Hematol Hemoter, 2015, 371 (4): 223–229. |
| [3] | 刘艳荣, 于弘, 常艳, 等. 四色荧光标记抗体在白血病免疫分型中的应用及意义[J]. 中国实验血液学杂志, 2002, 10 (5): 423–427. |
| [4] | 中华医学会儿科学分会血液学组, 中华儿科杂志编辑委员会. 儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J]. 中华儿科杂志, 2006, 44 (5): 392–395. |
| [5] | 中华医学会儿科学分会血液学组, 中华儿科杂志编辑委员会. 儿童急性淋巴细胞白血病诊疗建议(第二次修订草案)[J]. 中华儿科杂志, 1999, 37 (5): 305–307. |
| [6] | Schultz KR, Bowman WP, Aledo A, et al. Improved early event-free survival with imatinib in Philadelphia chromosome-positive acute lymphoblastic leukemia:a children's oncology group study[J]. J Clin Oncol, 2009, 27 (31): 5175–5181. DOI:10.1200/JCO.2008.21.2514 |
| [7] | 张之南, 沈悌. 血液病诊断及疗效标准[M]. 第2版. 北京: 科学出版社, 1999: 214-218. |
| [8] | Holt BVD, Dekker AW, Berg AD, et al. Significant difference in outcome for adolescents with acute lymphoblastic leukemia treated on pediatric vs adult protocols in the Netherlands[J]. Leukemia, 2003, 18 (12): 2032–2035. |
| [9] | Bolssel N, Auclerc MF, Lhéritier V, et a1. Should adolescents with acute lymphoblastic leukemia be treated as old children or young adults? Comparison of the French FRALLE-93 and LALA-94 Trials[J]. J Clin Oncol, 2003, 21 (5): 774–780. DOI:10.1200/JCO.2003.02.053 |
| [10] | Hallböök H, Gustafsson G, Smedmyr B, et al. Treatment outcome in young adults and children >10 years of age with acute lymphoblastic leukemia in Sweden:a comparison between a pediatric protocol and an adult protocol[J]. Cancer, 2006, 107 (7): 1551–1561. DOI:10.1002/(ISSN)1097-0142 |
| [11] | Stock W, La M, Sanford B, et a1. What determines the outcomes for adolescents and young adults with acute lymphoblastic leukemia treated on cooperative group protocols? A comparison of Children's Cancer Group and Cancer and Leukemia Group B studies[J]. Blood, 2008, 112 (5): 1646–1654. DOI:10.1182/blood-2008-01-130237 |
| [12] | Pui CH, Pei D, Campana D, et al. Improved prognosis for older adolescents with acute lymphoblastic leukemia[J]. J Clin Oncol, 2011, 29 (4): 386–391. DOI:10.1200/JCO.2010.32.0325 |
| [13] | 叶启东, 汤静燕, 潘慈, 等. 10岁以上儿童、青少年急性淋巴细胞白血病的临床研究[J]. 中华血液学杂志, 2011, 32 (12): 840–843. DOI:10.3760/cma.j.issn.0253-2727.2011.12.008 |
| [14] | 刘凯奇, 赵邢力, 魏辉, 等. 青少年急性淋巴细胞白血病单中心临床研究[J]. 中华内科杂志, 2016, 55 (2): 102–106. |
| [15] | 孔圆, 江滨, 王德炳, 等. 80例青少年急性淋巴细胞白血病MICM分型与临床预后分析[J]. 中华血液学杂志, 2004, 25 (7): 421–424. |
| [16] | Lukenbill J, Advani AS. The treatment of adolescents and young adults with acute lymphoblastic leukemia[J]. Curr Hematol Malig Rep, 2013, 8 (2): 91–97. DOI:10.1007/s11899-013-0159-0 |
| [17] | Gatta G, Rossi S, Foschi R, et al. Survival and cure trends for European children, adolescents and young adults diagnosed with acute lymphoblastic leukemia from 1982 to 2002[J]. Haematologica, 2013, 98 (5): 744–752. DOI:10.3324/haematol.2012.071597 |
| [18] | Hochberg J, Khaled S, Forman SJ, et al. Criteria for and outcomes of allogeneic haematopoietic stem cell transplant in children, adolescents and young adults with acute lymphoblastic leukaemia in first complete remission[J]. Br J Haematol, 2013, 161 (1): 27–42. DOI:10.1111/bjh.2013.161.issue-1 |
| [19] | Dores GM, Devesa SS, Curtis RE, et al. Acute leukemia incidence and patient survival among children and adults in the United States, 2001-2007[J]. Blood, 2012, 119 (1): 34–43. DOI:10.1182/blood-2011-04-347872 |
| [20] | Conter V, Bartram CR, Valsecchi MG, et al. Molecular response to treatment redefines all prognostic factors in children and adolescents with B-cell precursor acute lymphoblastic leukemia:Results in 3184 patients of the AIEOP-BFM ALL 2000 study[J]. Blood, 2010, 115 (16): 3206–3214. DOI:10.1182/blood-2009-10-248146 |
| [21] | Burke MJ, Gossai N, Wagner JE, et al. Survival differences between adolescent/young adults and children with B-precursor acute lymphoblastic leukemia following allogeneic hematopoietic cell transplantation[J]. Biol Blood Marrow Transplant, 2013, 19 (1): 138–142. DOI:10.1016/j.bbmt.2012.08.020 |
| [22] | Wood WA, Lee SJ, Brazauskas R, et al. Survival improvements in adolescents and young adults after myeloablative allogeneic transplantation for acute lymphoblastic leukemia[J]. Biol Blood Marrow Transplant, 2014, 20 (6): 829–836. DOI:10.1016/j.bbmt.2014.02.021 |
 2017, Vol. 19
2017, Vol. 19