急性T淋巴细胞白血病(T-cell acute lymphoblastic leukemia, T-ALL),是来源于造血干细胞的T系恶性增殖性疾病,占儿童急性白血病的10%~15%[1]。作为一种危险度较高的急性淋巴细胞白血病,儿童T-ALL复发率高达30%[2-3]。尽管随着危险度分层和化疗方案的改善,T-ALL患儿的预后得到改善,但仍有部分患儿出现诱导缓解失败、发生早期复发或者中枢神经系统复发[3]。
整合素(integrin, ITG)是一类介导哺乳动物细胞黏附与信号转导的异二聚体跨膜糖蛋白受体,由α和β亚单位组成,迄今已发现18种α亚单位和8种β亚单位,按不同的组合构成24种整合素二聚体[4-5]。β整合素家族成员(对应基因型ITGβ 1~8)与胞外基质分子以及胞内信号蛋白形成多种蛋白质复合物,介导肿瘤细胞与基质微环境相互作用、肿瘤与宿主细胞黏附及下游信号转导等多个环节的作用,对恶性肿瘤的发生、发展、浸润产生影响[6]。此外,通过结合细胞外基质配体,β整合素可激活多种胞内信号通路,调节细胞的增殖、凋亡、迁移及分化等过程[7]。而浸润性是T-ALL白血病细胞的重要特征,也是影响预后的原因之一。但β整合素家族在T-ALL的表达水平及其临床意义尚未见报道。整合素与配体间相互作用的识别位点为精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp, RGD),对于肿瘤细胞与细胞外基质以及肿瘤细胞之间的黏附起着关键作用[8];游离的外源性RGD肽可以特异性结合整合素的配体,是整合素分子常用抑制剂。本研究通过实时荧光定量PCR检测β整合素家族成员在T-ALL患儿的表达水平,并通过CCK 8与流式细胞术检测RGD肽处理的Jurkat细胞增殖与凋亡情况,探讨β整合素家族成员与T-ALL的关系。
1 资料与方法 1.1 研究对象以2011年6月至2015年1月在重庆医科大学附属儿童医院血液科住院的22例初诊急性T淋巴细胞白血病(T-ALL)患儿作为研究对象,男17例、女5例,中位年龄94(67~110)个月。对照组中男16例、女5例,中位年龄为72(16~175)个月,其中16例为非恶性血液病患者(免疫性血小板减少性紫癜10例,缺铁性贫血6例)、5例为骨髓移植健康供者。
收集患儿的临床资料,如年龄、性别、初诊时外周血白细胞计数、染色体核型、融合基因及治疗反应(泼尼松试验、诱导第33天缓解状态和微小残留病水平以及复发、死亡)等。
本研究获得医院伦理委员会批准及患儿家长知情同意。
1.2 ALL诊断及疗效判断标准T-ALL的诊断、危险度分层和治疗参照2006年《儿童急性淋巴细胞白血病诊疗建议(修订草案)》及中国儿童白血病协作组2008方案(简称CCLG-2008方案)[9-10]。疗效判断参照《血液病诊断和疗效标准》第3版[11]。泼尼松治疗第8天外周血幼稚淋巴细胞 < 1 000/μL为泼尼松试验敏感;≥1 000/μL则为不敏感。微小残留病(minimal residual desease, MRD)水平 > 10-4为阳性, < 10-4则为阴性。
随访截止至2016年6月。无事件生存(event-free survival, EFS)为初诊至首次事件发生的生存时间,事件包括未缓解、复发、死亡。总体生存(overall survival, OS)为初诊至死亡或随访截止的生存时间。
1.3 实时荧光定量qRT-PCR检测β整合素表达采集患儿初诊时的骨髓1~2 mL、EDTA抗凝,加入淋巴细胞分离液5 mL,1 000 r/min离心20 min,PBS洗涤2遍,收集骨髓单个核细胞。采用实时荧光定量qRT-PCR进行β整合素家族成员表达水平检测。引物根据Genebank数据库提供的mRNA序列进行设计(北京六合华大基因科技有限公司合成),见表 1。根据TRIzol试剂(美国Invitrogen公司)说明书提取BMMNC的总RNA,NanoDrop 2000分光光度计测定RNA浓度及纯度。根据逆转录试剂盒(大连宝生物科技有限公司)说明使用2 μg RNA进行逆转录构建cDNA文库。使用BioRad CTMX实时荧光定量PCR仪进行PCR定量分析和熔解曲线分析。样本基因mRNA表达水平采用ΔΔCT法进行相对定量分析,GAPDH基因表达量作为表达分析的内对照。
| 表 1 β整合素家族成员及内参基因的引物序列 |
1.4 细胞株及细胞培养
人Jurkat细胞株购自美国ATCC细胞库(ATCC®TIB-152TM),由重庆医科大学附属儿童医院儿研所传代冻存。细胞培养采用含10%胎牛血清、100 U/mL青-链霉素的RPMI-1640培养液,培养箱条件为37℃、5%CO2、饱和湿度,每2~3 d传代1次,取对数生长期细胞用于实验。
1.5 CCK 8法检测RGD肽对Jurkat细胞增殖的影响取对数期生长的Jurkat细胞,培养液含不同浓度RGD肽(美国阿拉丁公司),细胞以1×105/mL接种96孔培养板,每孔100 μL培养体系。实验分6组,RGD肽的浓度分别为:0 mmol/L、0.2 mmol/L、0.4mmol/L、0.6 mmol/L、0.8 mmol/L、1 mmol/L。每组设3个复孔,分别培养6、12、24、48或72 h,每孔加入10 μL CCK 8试剂(日本同仁化工研究所),继续孵育2 h,酶标仪测定450 nm波长处每孔的吸光度(OD)。实验重复3次。
1.6 Annexin V-APC/7AAD双染法检测Jurkat细胞凋亡实验细胞分2组:1 mmol/L RGD肽处理组和未处理组。取对数生长期的Jurkat细胞,分组处理后培养24 h,收集细胞,800 r/min离心5 min,弃上清,预冷PBS洗涤2次。根据凋亡检测试剂盒(北京凯基公司)说明进行Annexin V、7AAD荧光染色,并采用BD Accuri C6流式细胞仪分析荧光染色水平。右上象限(Q2)示晚期凋亡细胞,右下象限(Q4)示早期凋亡细胞,右象限(Q2+Q4)示总凋亡细胞。实验重复3次。
1.7 统计学分析采用SPSS 20.0统计学软件进行数据处理。非正态分布的计量资料采用中位数四分位数[P50(P25,P75)]表示;正态分布的计量资料采用均数±标准差(x±s)表示。两组间比较采用t检验或Mann-Whitney U检验;多组间多重比较采用Krusikal-Wallis检验Bonferroni法校正检验水准。采用Kaplan-Meier分析与对数秩检验评估无事件生存率和总体生存率。P < 0.05为差异有统计学意义。
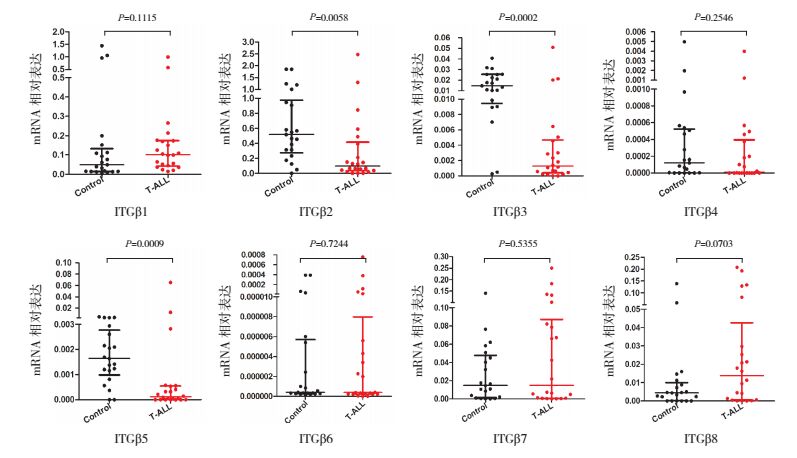
2 结果 2.1 β整合素家族在T-ALL的表达水平与对照组相比,T-ALL组整合素β1、β4、β6、β7、β8的mRNA表达差异无统计学意义(P > 0.05);整合素β2、β3、β5的mRNA表达水平显著下调(P < 0.05)。见图 1。
|
图 1 整合素β家族在22例T-ALL患儿的表达 |
2.2 整合素β2、β3、β5表达水平与T-ALL临床特征的相关性
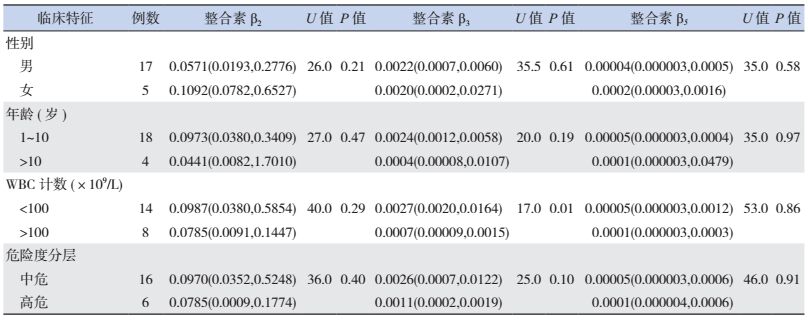
整合素β2、β5在不同性别、年龄、危险度和白细胞计数的T-ALL患儿的表达差异无统计学意义(P > 0.05);整合素β3在外周血白细胞计数 < 100×109/L的T-ALL患儿表达水平较高(P < 0.01),在不同性别、年龄、危险度T-ALL之间的表达差异也没有统计学意义(P > 0.05)。见表 2。
| 表 2 整合素β2、β3、β5表达水平与T-ALL临床特征的相关性 [P50(P25,P75)] |
2.3 整合素β2、β3、β5表达与T-ALL治疗反应的相关性
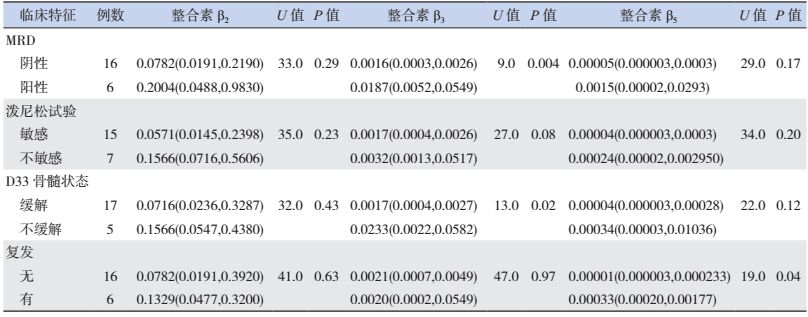
泼尼松试验、D33骨髓缓解状态、MRD对T-ALL患儿整合素β2、β5的表达无影响(P > 0.05);整合素β5在复发T-ALL患儿表达水平高于无复发T-ALL患儿(P < 0.05),但β2在有无复发T-ALL患儿的表达差异无统计学意义(P > 0.05)。整合素β3在MRD阳性、第33天不缓解的T-ALL患儿表达水平较高(P < 0.05),但泼尼松试验、有无复发对β3的表达无影响(P > 0.05)。见表 3。
| 表 3 整合素β2、β3、β5表达水平与T-ALL治疗结局的相关性 [P50(P25,P75)] |
2.4 整合素β2、β3或β5对T-ALL生存率的影响
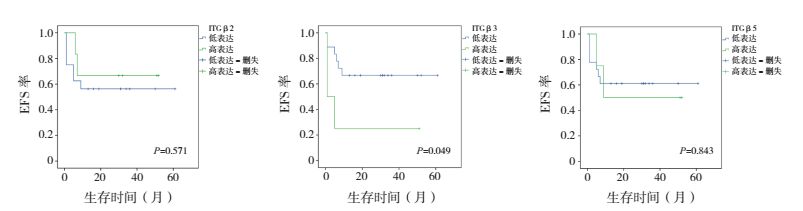
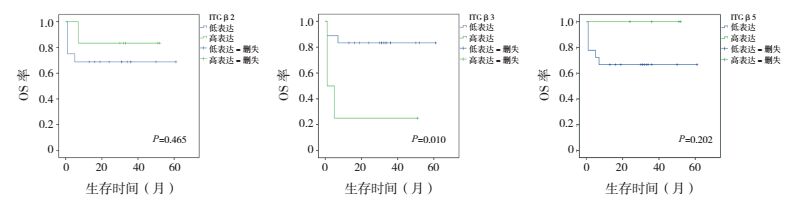
将整合素β2、β3与β5的mRNA表达高于总体样本(包括对照组)中位数定义为高表达,反之则为低表达。整合素β2、β5高表达或低表达T-ALL患儿的EFS率和OS率的差异均无统计学意义(P > 0.05);β3高表达T-ALL患儿的EFS、OS率均低于β3低表达者(P < 0.05)。见图 2~3。
|
图 2 整合素β2、β3或β5表达水平对T-ALL患儿EFS率的影响 |
|
图 3 整合素β2、β3或β5表达水平对T-ALL患儿OS率的影响 |
2.5 整合素抑制剂RGD肽对Jurkat细胞增殖及凋亡的影响
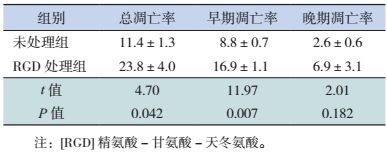
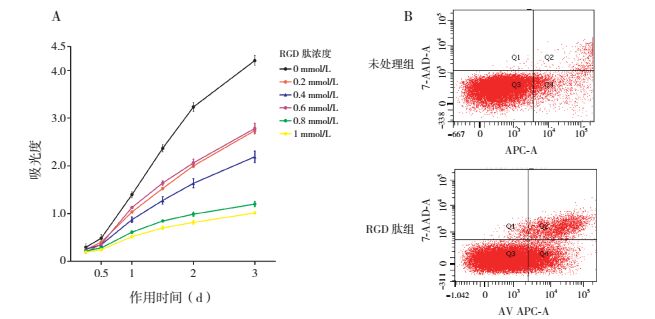
与未处理组相比,RGD肽各浓度组第1、2、3天的Jurkat细胞存活率均显著降低,以1 mmol/L浓度组的存活率最低,差异有统计学意义(P < 0.01)。见图 4 A。1 mmol/L RGD肽处理Jurkat细胞24 h后,早期凋亡率(象限Q4/总细胞数)、晚期凋亡率(象限Q2/总细胞数)与总凋亡率(象限Q2+Q4/总细胞数)较未处理组均明显升高(图 4 B),且早期凋亡率和总凋亡率高于未处理组(P < 0.05),见表 4。
|
图 4 RGD肽处理后的Jurkat细胞增殖及凋亡情况 A:不同浓度RGD肽处理Jurkat细胞的CCK 8曲线;B:RGD肽处理24 h后的Jurkat细胞凋亡情况。右上象限(Q2)示晚期凋亡细胞,右下象限(Q4)示早期凋亡细胞,右象限(Q2+Q4)示总凋亡细胞。 |
| 表 4 1mmol/L RGD肽处理组与未处理组的凋亡情况比较 (x±s,%) |
3 讨论
β整合素家族作为黏附受体,介导细胞与细胞外基质的相互作用和信号传导,参与调控恶性肿瘤的生长、浸润与侵袭等生物学过程[12-13]。浸润性是T-ALL的重要特征,也是影响预后的原因之一。而β整合素在T-ALL发生发展中所起的作用尚不清楚。
T-ALL是儿童ALL中预后不良类型。第33天骨髓缓解状态和MRD是调整T-ALL危险度分组和化疗强度的重要依据,能反映T-ALL的治疗效果与预后[14]。本研究发现,第33天骨髓不缓解或MRD阳性的T-ALL患儿整合素β3表达水平较高;复发T-ALL患儿整合素β5的表达高于无复发T-ALL患儿。提示β整合素家族可能可以作为T-ALL患儿新的预后判断指标。生存分析结果也显示,整合素β3高表达者EFS、OS较低,进一步证明整合素β3的表达水平可作为T-ALL疗效及预后判断的依据。本研究还发现,整合素β3在外周血白细胞计数 < 100×109/L的T-ALL患儿表达水平较高。而高白细胞计数对T-ALL的预后意义较小[15-16]。但整合素β3表达水平与T-ALL白细胞计数及预后之间的关系有待扩大样本进一步研究。
RGD由精氨酸、甘氨酸和天冬氨酸组成,广泛存在于细胞外基质蛋白中,是整合素二聚体(整合素αVβ2、αVβ3、αVβ5)的主要结合位点[17]。游离RGD肽能特异性结合整合素二聚体,介导细胞和细胞外基质、细胞和细胞之间的相互作用,调控细胞增殖、分化、存活和迁移[18]。本研究应用整合素抑制剂RGD肽作用于Jurkat细胞,发现RGD肽处理后的Jurkat细胞凋亡率增加、生存率下降,而且RGD肽对于Jurkat细胞增殖的抑制作用具有浓度依赖性。提示β整合素家族可能是通过影响白血病细胞的增殖与凋亡,从而参与T-ALL的发生发展过程。β整合素可能成为儿童T-ALL新的治疗靶点。
综上表明,β整合素家族可能通过影响细胞的增殖和凋亡而参与T-ALL的发生发展,整合素β5表达与T-ALL患儿复发风险密切相关,整合素β3表达与T-ALL患儿治疗反应及预后密切相关。我们相信,经过后续深入研究,最终能够阐明β整合素在T-ALL作用机制,为临床治疗提供更多可靠的依据。
| [1] | Durinck K, Goossens S, Peirs S, et al. Novel biological insights in T-cell acute lymphoblastic leukemia[J]. Exp Haematol, 2015, 43 (8): 625–639. DOI:10.1016/j.exphem.2015.05.017 |
| [2] | Cox CV, Martin HM, Keams PR, et al. Characterization of a progenitor cell population in childhood T-cell acute lymphoblastic leukemia[J]. Blood, 2007, 109 (2): 674–682. DOI:10.1182/blood-2006-06-030445 |
| [3] | Goldberg JM, Silverman LB, Levy DE, et al. Childhood T-cell acute lymphoblastic leukemia:the Dana-Farber Cancer Institute acute lymphoblastic leukemia consortium experience[J]. J Clin Oncol, 2003, 21 (19): 3616–3622. DOI:10.1200/JCO.2003.10.116 |
| [4] | Desgrosellier JS, Cheresh DA. Integrins in cancer:biological implications and therapeutic opportunities[J]. Nat Rev Cancer, 2010, 10 (1): 9–22. DOI:10.1038/nrc2748 |
| [5] | Hynes RO. Integrins:bidirectional, allosteric signaling machines[J]. Cell, 2002, 110 (6): 673–687. DOI:10.1016/S0092-8674(02)00971-6 |
| [6] | Kapp TG, Rechenmacher F, Sobahi TR, et al. Integrin modulators:a patent review[J]. Expert Opin Ther Pat, 2013, 23 (10): 1273–1295. DOI:10.1517/13543776.2013.818133 |
| [7] | Lambert AW, Ozturk S, Thiagalingam S. Integrin signaling in mammary epithelial cells and breast cancer[J]. ISRN Oncol, 2012, 2012 : 493283. |
| [8] | Akkari L, Gocheva V, Kester JC, et al. Distinct functions of macrophage-derived and cancer cell-derived cathepsin Z combine to promote tumor malignancy via interactions with the extracellular matrix[J]. Genes Dev, 2014, 28 (19): 2134–2150. DOI:10.1101/gad.249599.114 |
| [9] | 中华医学会儿科学分会血液组, 中华儿科杂志编辑委员会. 儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J]. 中华儿科杂志, 2006, 44 (5): 392–395. |
| [10] | 孙伊娜, 柴忆欢, 何海龙, 等. CCLG-ALL2008方案治疗儿童急性淋巴细胞性白血病的临床疗效[J]. 江苏医药, 2011, 24 (37): 2922–2925. |
| [11] | 秘营昌, 卞寿庚. 急性白血病[M]//张之南, 沈悌. 血液病诊断及疗效标准. 第3版. 北京: 科学出版社, 2007: 131-134. |
| [12] | Kapp TG, Rechenmacher F, Sobahi TR, et al. Integrin modulators:a patent review[J]. Expert Opin Ther Pat, 2013, 23 (10): 1273–1295. DOI:10.1517/13543776.2013.818133 |
| [13] | Roth P, Silginer M, Goodman SL, et al. Integrin control of the transforming growth factor-β pathway in glioblastoma[J]. Brain, 2013, 136 (Pt 2): 564–576. |
| [14] | 王耀平. 儿童及少年急性淋巴细胞白血病危险因素评估[J]. 白血病.淋巴瘤, 2005, 14 (4): 241–242. |
| [15] | 王跃平. 儿童急性白血病诊治进展[J]. 实用医院临床杂志, 2007, 4 (6): 33–38. |
| [16] | Pui CH, Robison LL, Look AT. Acute lymphoblastic leukaemia[J]. Lancet, 2008, 371 (9617): 1030–1043. DOI:10.1016/S0140-6736(08)60457-2 |
| [17] | 管箫玉, 李庆伟, 王继红. RGD肽抗肿瘤机制及进展[J]. 吉林医药学院学报, 2015, 36 (5): 361–365. |
| [18] | 沈瑛, 糜军. 靶向整合素αVβ3的分子影像探针[J]. 中国癌症杂志, 2010, 20 (4): 303–307. |
 2017, Vol. 19
2017, Vol. 19