支气管肺发育不良(bronchopulmonary dysplasia, BPD)又称慢性肺疾病(chronic lung disease, CLD),是早产儿肺部疾病中常见的并发症之一[1],主要由机械通气导致的严重呼吸窘迫综合征(respiratory distress syndrome, RDS)引起[2]。BPD可造成早产儿神经发育障碍,延长住院时间,增加再入院治疗风险[1]。有越来越多的证据表明,炎症反应在BPD的发病机制中起重要作用[2-4]。糖皮质激素由于其强大的抗炎特性,是一个有吸引力的干预策略。理论上讲,应用糖皮质激素会对肺部有益,但同时具有相应的不良反应。Halliday等[5]及Shah等[6]分别于2010年及2012年做过有关早产儿生后早期应用糖皮质激素预防BPD疗效与安全性的系统评价,但由于有新的文献更新,且对于相关疗效及不良反应仍存在争议,为此,本研究增加了相关的文献进行Meta分析,评价早产儿早期应用糖皮质激素预防BPD的疗效与安全性,以期为BPD防治提供循证依据。
1 资料与方法 1.1 纳入标准纳入标准包括:(1)研究对象为早产儿;(2)干预措施:生后早期( < 2周)开始接受糖皮质激素治疗者为治疗组,接受安慰剂者为对照组[2];(3)同一团队的同一研究只收录与本Meta分析相关性最大的一项;(4)研究类型:临床随机对照试验(RCT),文献的语种不受限制。
1.2 排除标准排除标准包括:(1)未提供充分原始数据且索取无果,无法获取原文的文献;(2)文献质量严重偏倚的RCT;(3)重复收录的文献;(4)综述、专家经验总结、评价性、理论阐述文章。
1.3 检索策略利用计算机检索PubMed、Embase、Cochrane Library、中国期刊全文数据库(CNKI)、万方医学网及维普等数据库,并追溯纳入文献的参考文献,收集早产儿早期应用糖皮质激素预防BPD的疗效和安全性的相关文献。检索时限均从各数据库建库至2016年6月。
英文检索词包括:bronchopulmonary dysplasia; lung diseases; chronic disease; anti-inflammatory agents; budesonide; beclomethasone dipropionate; flunisolide; fluticasone propionate; dexamethasone; steroids; glucocorticoids; corticosteroid; hydrocortisone; infants, premature; preterm infants; neonatal prematurity; newborn infant; newborns; newborn; neonate; randomized controlled trial; controlled clinical trial; randomized; placebo; clinical trials as topic; trial。中文检索词包括:支气管肺发育不良、早产儿、糖皮质激素。
1.4 资料提取参考Cochrane协作网推荐的方法编制资料提取表,由2名研究者独立提取资料,交叉核对,如果有不一致观点通过讨论进行解决。本Meta分析提取的资料包括:(1)文献的基本特征(包括文题、年份、研究者姓名等);(2)所纳入文献研究对象的基本特征、干预措施和结局指标。
1.5 文献质量评价由采用Cochrane系统评价员手册5.1.0版(Review Manager 5.3中自带)提供的标准进行评价:(1)是否随机,随机方法是否正确;(2)是否采用盲法;(3)是否做到分配隐藏;(4)研究结局是否盲法评价;(5)随访是否完成。所有质量标准均满足者,发生偏倚的可能性最低;如其中任何一条或多条质量评价标准仅部分满足(或不清楚),则该研究存在相应偏倚的可能性为中等;如其中任何一条或多条完全不满足(未使用或不正确),则该研究存在相应偏倚的高度可能性。
1.6 统计学分析采用Review Manager 5.3进行Meta分析。本Meta分析对于计数资料的效应指标选取比值比(odds ratio, OR)及其95%可信区间(confidence interval, CI)表示。异质性检验的检验方法采用Q检验和I2统计量,如果异质性检验结果P ≥ 0.1、I2 < 50%,表示各研究间没有异质性,选用固定效应模型;如果异质性检验结果P < 0.1、I2 > 50%,表示研究间存在异质性,选用随机效应模型。采用Cochrane风险偏倚评估工具分析是否存在偏倚。利用Review Manager 5.3软件采取去除单项研究法,即文献的逐一排除进行敏感性分析,评价Meta分析结果的稳定性。P < 0.05为差异有统计学意义。
2 结果 2.1 检索结果按制订的检索策略,检出相关文献共718篇,经阅读标题、摘要或全文,依据纳入标准与质量评价后,筛选出符合纳入标准的有16篇文献[7-22]。文献筛选流程见图 1。
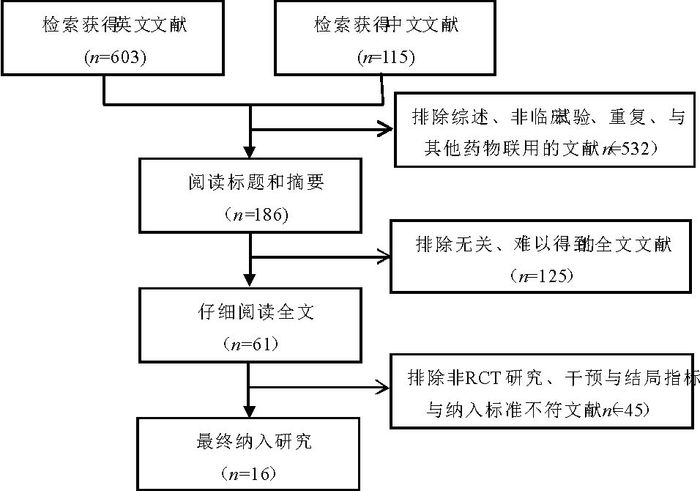
|
图 1 文献筛选流程 |
2.2 研究对象及观察指标
16项RCT[7-22]共纳入2 962例参与者,其中试验组1 486例,对照组1 476例。结局指标如下。
(1)主要指标:纠正胎龄36周时两组BPD的患病情况。
(2)其他指标:全身激素的使用率(吸入激素治疗的患儿,预防BPD治疗过程中仍需使用静脉激素率);14 d撤机失败率;重新气管插管率;纠正胎龄36周病死率;高血糖、高血压、感染、胃肠道出血、严重脑室内出血、脑室周围白质软化、坏死性小肠结肠炎、严重早产儿视网膜病变、动脉导管未闭、肠穿孔、气胸、肺出血的发生率。
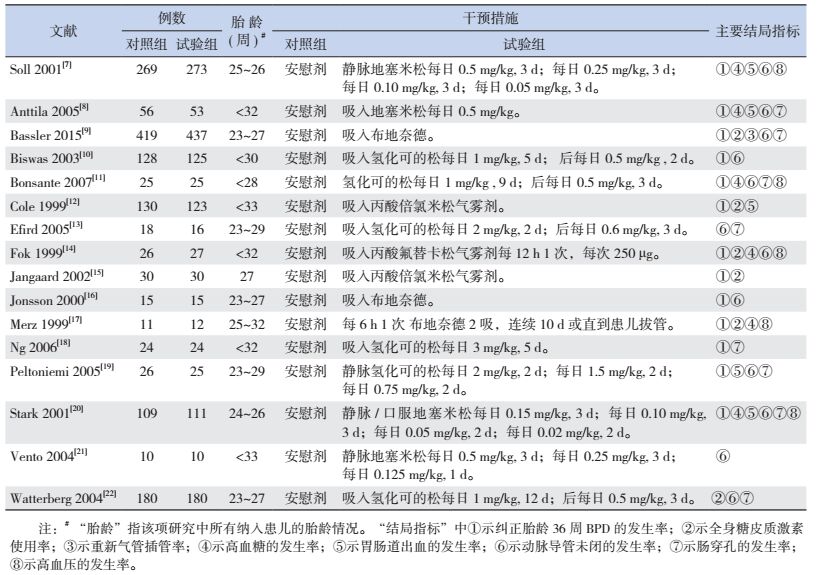
2.3 干预措施所有文献均以应用糖皮质激素为治疗组,应用安慰剂为对照组。6项RCT[10-11, 13, 18-19, 22]应用氢化可的松;3项RCT[9, 16-17]应用布地奈德;4项RCT[7-8, 20-21]应用地塞米松;2项RCT[12, 15]应用丙酸倍氯米松;1项RCT[14]应用丙酸氟替卡松。16篇RCT的相关信息见表 1。
| 表 1 16篇RCT的相关信息 |
2.4 文献偏倚评价
本Meta分析采用Cochrane风险偏倚评估工具进行文献偏倚评价,纳入的16项RCT[7-22]均使用随机方法,其中7项RCT[9-11, 13, 18, 20, 22]描述了正确的随机方法,并提及分配隐藏,11项RCT[7, 9-12, 15-20]实施了双盲,故存在选择性偏倚可能小;11项RCT研究结局实行盲法评价,故测量偏倚较小;14项RCT结局数据完整及不存在选择性报告研究结果,故随访及报告的偏倚均较小;纳入文献的总体质量和证据强度较高。纳入研究的方法学质量评价见图 2。
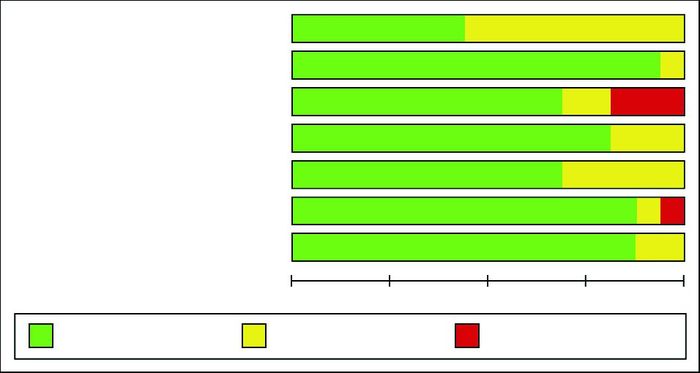
|
图 2 偏倚风险图 约56%研究随机序列的产生方式未知,因而有较高的未知偏倚风险;约94%研究有指定的分配隐藏方法从而具有较低风险的分配偏倚;约69%研究实行了双盲,约19%研究者施盲存在高风险;约69%研究测量偏倚低风险,其余研究测量偏倚风险未知;随访偏倚高风险与未知风险研究各占约6%,其余研究结局数据完整,从而有低风险偏倚;约88%研究报告偏倚低风险,12%报告风险未知。 |
2.5 Meta分析结果 2.5.1 纠正胎龄36周时BPD发生率
研究纠正胎龄36周时BPD的发生率共13项试验[7-12, 14-20],纳入2 548名患儿。Meta分析显示,试验组比对照组发生率低,两组间差异有统计学意义(OR=0.73,95%CI:0.61~0.87,P=0.0004),见图 3。异质性检验显示:I2=0%,P=0.71,无异质性。
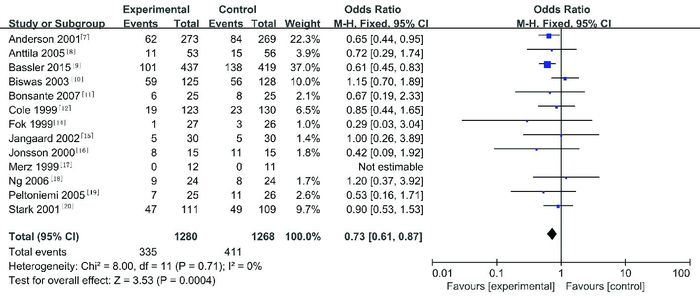
|
图 3 两组纠正胎龄36周时BPD发生率比较的Meta分析 |
2.5.2 纠正胎龄36周时病死率
研究纠正胎龄36周时病死率有9项试验[7, 9-10, 12, 14-15, 17, 20-21],纳入2 620名患儿。Meta分析显示,两组间病死率比较差异无统计学意义(OR=1.13,95%CI:0.92~1.40,P=0.23)。异质性检验显示:I2=0%,P=0.68,无异质性。
2.5.3 全身糖皮质激素使用率研究全身糖皮质激素的使用率共6项试验[9, 12, 14-15, 17, 22],纳入1 605名患儿。Meta分析显示,试验组比对照组全身糖皮质激素使用率低,两组间差异有统计学意义(OR=0.72,95%CI:0.58~0.90,P=0.003),见图 4。异质性检验显示:I2=0%,P=0.44,无异质性。
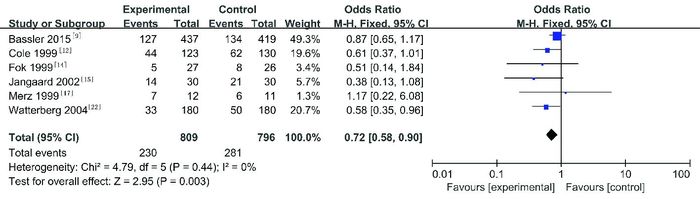
|
图 4 两组全身糖皮质激素使用率比较的Meta分析 |
2.5.4 14 d撤机失败率
研究14 d撤机失败率共5项试验[10, 14-17],纳入419名患儿。Meta分析显示,两组间14 d撤机失败率比较差异无统计学意义(OR=0.87,95%CI:0.58~1.32,P=0.52)。异质性检验显示:I2=33%,P=0.20,无异质性。
2.5.5 重新气管插管率研究重新气管插管率共1项试验[9],纳入856名患儿。Meta分析显示,试验组比对照组重新气管插管率低,差异有统计学意义(OR=0.56,95%CI:0.33~0.95,P=0.03),见图 5。
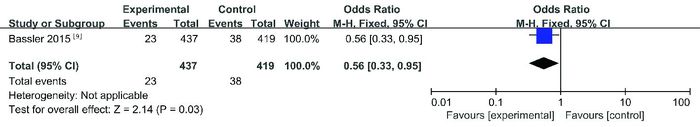
|
图 5 两组重新气管插管率比较的Meta分析 |
2.5.6 高血糖的发生率
研究高血糖发生率共6项试验[7-8, 11, 14, 17, 20],纳入993名患儿。Meta分析显示,试验组比对照组高血糖发生率高,差异有统计学意义(OR=1.61,95%CI:1.24~2.09,P=0.0003),见图 6。异质性检验显示:I2=38%,P=0.16,无异质性。
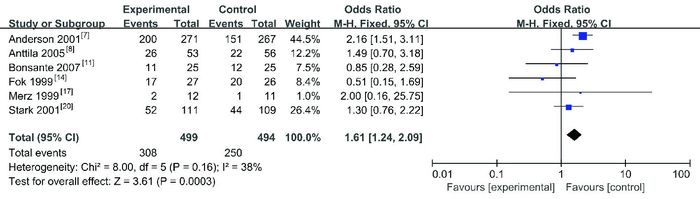
|
图 6 两组高血糖发生率比较的Meta分析 |
2.5.7 高血压的发生率
研究高血压发生率共5项试验[7, 11, 14, 17, 20],纳入885名患儿。Meta分析显示,两组间高血压发生率差异有统计学意义(OR=1.63,95%CI:1.11~2.38,P=0.01),见图 7。异质性检验显示:I2=6%,P=0.37,无异质性。
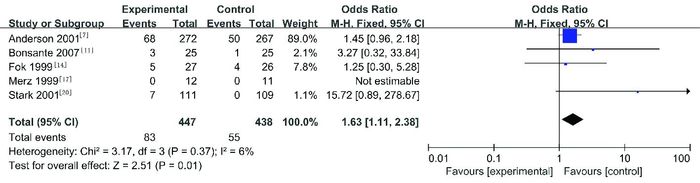
|
图 7 两组高血压发生率比较的Meta分析 |
2.5.8 动脉导管未闭的发生率
研究动脉导管未闭发生率共12项试验[7-11, 13-14, 16, 19-22],纳入2 578名患儿。Meta分析显示,试验组动脉导管未闭率比对照组低,差异有统计学意义(OR=0.66,95%CI:0.56~0.77,P=0.00001),见图 8。异质性检验显示:I2=7%,P=0.37,无异质性。
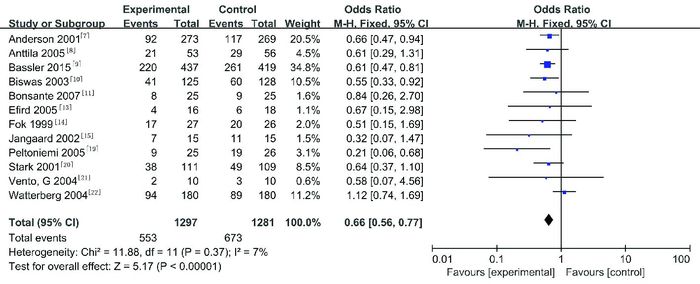
|
图 8 两组动脉导管未闭发生率比较的Meta分析 |
2.5.9 肠穿孔的发生率
研究肠穿孔发生率共9项试验[7-9, 11, 13, 18-20, 22],纳入2 266名患儿。Meta分析显示,试验组肠穿孔发生率比对照组高,差异有统计学意义(OR=1.51,95%CI:1.12~2.04,P=0.007),见图 9。异质性检验显示:I2=0%,P=0.53,无异质性。
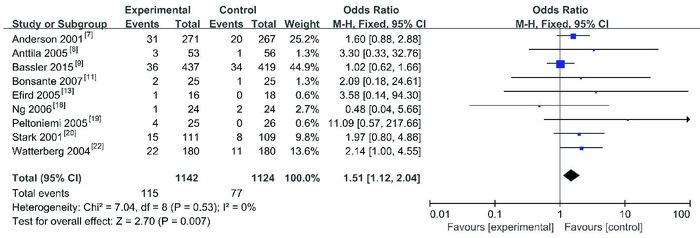
|
图 9 两组肠穿孔发生率比较的Meta分析 |
2.5.10 其他不良反应
胃肠道出血(OR=1.63,95%CI:0.99~2.66,P=0.05)、感染(OR=1.11,95%CI:0.94~1.30,P=0.21)、严重脑室内出血(OR=0.97,95%CI:0.75~1.24,P=0.79)、脑室周围白质软化(OR=1.33,95%CI:0.90~1.97,P=0.16)、坏死性小肠结肠炎(OR=0.85,95%CI:0.66~1.09,P=0.20)、严重早产儿视网膜病变(OR=0.91,95%CI:0.75~1.10,P=0.32)、气胸(OR=1.17,95%CI:0.84~1.64,P=0.50)、肺出血(OR=1.17,95%CI:0.70~1.94,P=0.55)等不良反应两组间比较差异无统计学意义。
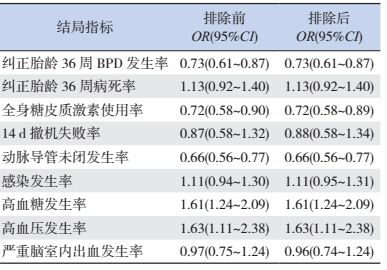
2.6 敏感性分析所有Meta分析结果均没有异质性。利用Review Manager 5.3软件将每项Meta分析结果排除小样本或低质量研究[17, 21]后,比较Meta分析合并值的一致性。结果显示,排除前后Meta分析结果一致,说明研究合并结果稳定性较好,结果可靠,见表 2。
| 表 2 排除小样本、低质量研究前后Meta分析结果的比较 |
3 讨论
炎症反应在BPD的发病机制中起重要作用,糖皮质激素可能通过不同机制改善BPD患儿的肺功能。有研究表明糖皮质激素可通过抑制炎症反应,从而预防BPD的发生[23]。也有研究表明,在生后第1周促肾上腺皮质激素可刺激机体释放出低水平的皮质醇,从而可有效预防BPD[24]。Halliday等[5] Meta分析发现,虽然出生后早期(≤7 d)激素治疗降低了BPD和动脉导管未闭的风险,但仍可造成短期不利影响,包括增加胃肠道出血、肠穿孔、高血糖、高血压、肥厚性心肌病的发生风险,以及导致生长障碍。长期随访结果表明还可增加神经系统异常与脑性瘫痪的风险。Shah等[6]Meta分析显示,没有证据表明早期(生后2周)吸入糖皮质激素可降低机械通气早产儿BPD的发生率。
本Meta分析纳入的16项RCT[7-22]均使用随机方法,其中7项RCT [9-11, 13, 18, 20, 22]描述了正确的随机方法,并提及分配隐藏,11项RCT [7, 9-12, 15-20]对医生和受试者均实施了盲法,故存在选择性偏倚可能性小;16项RCT均描述了两组基线资料可比,故存在发表偏倚风险较小。纳入文献的总体质量和证据强度较高,而且异质性分析表明所纳入的研究没有明显异质性。
本Meta分析结果显示,早产儿早期(生后2周)应用糖皮质激素有利于减少纠正胎龄36周时BPD的发生率、再次插管的风险,以及可减少动脉导管未闭的发生和全身激素的使用,同时增加了高血糖、高血压、胃肠道穿孔等风险。本Meta分析的研究结果与Halliday等[5]研究结果基本一致。早产儿生后早期使用激素仍存在其他的潜在危险。有研究表明早产儿早期使用糖皮质激素对神经系统也有相应的影响[5-6]。Van Goudoever等[25]研究患儿使用地塞米松后第4天和第19天的体重,以及分析其氮平衡,结果表明使用高剂量地塞米松使患儿蛋白质水解增加,呈现负氮平衡,从而减少体重。Gibson等[26]通过对比患儿地塞米松治疗前后下肢增长的变化,结果提示患儿使用地塞米松后生长受到一定的限制。Werner等[27]研究表明呼吸机依赖的BPD患儿使用高剂量地塞米松治疗后,室间隔厚度与对照组患儿相比增加,且差异具有统计学意义,从而表明使用高剂量地塞米松可增加BPD患儿心肌肥厚的患病风险。
本Meta分析存在以下局限性:(1)所纳入研究使用的糖皮质激素种类多样:6项RCT [10-11, 13, 18-19, 22]应用氢化可的松;3项RCT [9, 16-17]应用布地奈德;4项RCT [7-8, 20-21]应用地塞米松;2项RCT [12, 15]应用丙酸倍氯米松;1项RCT [14]应用丙酸氟替卡松。(2)激素使用剂量及疗程不一;(3)随访时间范围差别较大。
综上所述,本Meta分析显示,早产儿早期(生后2周)应用糖皮质激素对于预防BPD有一定疗效,但同时存在一些不良反应。目前尚不推荐在此人群中使用糖皮质激素,需要进一步研究确定糖皮质激素的给药方式、疗效与安全性,尤其需注意高血糖、高血压、肠穿孔等不良反应的发生。
| [1] | 裘刚, 龚小慧. 糖皮质激素防治支气管肺发育不良的循证医学证据[J]. 中国小儿急救医学, 2012, 19 (1): 98–100. |
| [2] | 齐骥. 糖皮质激素防治早产儿支气管肺发育不良的进展及争议[J]. 中国循证儿科杂志, 2011, 6 (3): 237–240. |
| [3] | Choi CW, Kim BI, Kim HS, et al. Increase of interleukin-6 in tracheal aspirate at birth:a predictor of subsequent bronchopulmonary dysplasia in preterm infants[J]. Acta Paediatr, 2006, 95 (1): 38–43. DOI:10.1080/08035250500404085 |
| [4] | Patterson AM, Taciak V, Lovchik J, et al. Ureaplasma urealyticum respiratory tract colonization is associated with an increase in interleukin 1-beta and tumor necrosis factor alpha relative to interleukin 6 in tracheal aspirates of preterm infants[J]. Pediatr Infect Dis J, 1998, 17 (4): 321–328. DOI:10.1097/00006454-199804000-00011 |
| [5] | Halliday HL, Ehrenkranz RA, Doyle LW. Early ( < 8 days) postnatal corticosteroids for preventing chronic lung disease in preterm infants[J]. Cochrane Database Syst Rev, 2010 (1): CD001146. |
| [6] | Shah VS, Ohlsson A, Halliday HL, et al. Early administration of inhaled corticosteroids for preventing chronic lung disease in ventilated very low birth weight preterm neonates[J]. Cochrane Database Syst Rev, 2012 (5): Cd001969. |
| [7] | Vermont Oxford Network Steroid Study Group. Early postnatal dexamethasone therapy for the prevention of chronic lung disease[J]. Pediatrics, 2001, 108 (3): 741–748. DOI:10.1542/peds.108.3.741 |
| [8] | Anttila E, Peltoniemi O, Haumont D, et al. Early neonatal dexamethasone treatment for prevention of bronchopulmonary dysplasia. Randomised trial and meta-analysis evaluating the duration of dexamethasone therapy[J]. Eur J Pediatr, 2005, 164 (8): 472–481. DOI:10.1007/s00431-005-1645-8 |
| [9] | Bassler D, Plavka R, Shinwell ES, et al. Early inhaled budesonide for the prevention of bronchopulmonary dysplasia[J]. N Engl J Med, 2015, 373 (16): 1497–1506. DOI:10.1056/NEJMoa1501917 |
| [10] | Biswas S, Buffery J, Enoch H, et al. Pulmonary effects of triiodothyronine (T3) and hydrocortisone (HC) supplementation in preterm infants less than 30 weeks gestation:results of the THORN trial-thyroid hormone replacement in neonates[J]. Pediatr Res, 2003, 53 (1): 48–56. |
| [11] | Bonsante F, Latorre G, Iacobelli S, et al. Early low-dose hydrocortisone in very preterm infants:a randomized, placebo-controlled trial[J]. Neonatology, 2007, 91 (4): 217–221. |
| [12] | Cole CH, Colton T, Shah BL, et al. Early inhaled glucocorticoid therapy to prevent bronchopulmonary dysplasia[J]. N Engl J Med, 1999, 340 (13): 1005–1010. DOI:10.1056/NEJM199904013401304 |
| [13] | Efird MM, Heerens AT, Gordon PV, et al. A randomized-controlled trial of prophylactic hydrocortisone supplementation for the prevention of hypotension in extremely low birth weight infants[J]. J Perinatol, 2005, 25 (2): 119–124. DOI:10.1038/sj.jp.7211193 |
| [14] | Fok TF, Lam K, Dolovich M, et al. Randomised controlled study of early use of inhaled corticosteroid in preterm infants with respiratory distress syndrome[J]. Arch Dis Child Fetal Neonatal Ed, 1999, 80 (3): F203–F208. DOI:10.1136/fn.80.3.F203 |
| [15] | Jangaard KA, Stinson DA, Allen AC, et al. Early prophylactic inhaled beclomethasone in infants less than 1250 g for the prevention of chronic lung disease[J]. Paediatr Child Health, 2002, 7 (1): 13–19. DOI:10.1093/pch/7.1.13 |
| [16] | Jonsson B, Eriksson M, Soder O, et al. Budesonide delivered by dosimetric jet nebulization to preterm very low birthweight infants at high risk for development of chronic lung disease[J]. Acta Paediatr, 2000, 89 (12): 1449–1455. DOI:10.1111/j.1651-2227.2000.tb02775.x |
| [17] | Merz U, Kusenbach G, Hausler M, et al. Inhaled budesonide in ventilator-dependent preterm infants:a randomized, double-blind pilot study[J]. Biol Neonate, 1999, 75 (1): 46–53. |
| [18] | Ng PC, Lee CH, Bnur FL, et al. A double-blind, randomized, controlled study of a "stress dose" of hydrocortisone for rescue treatment of refractory hypotension in preterm infants[J]. Pediatrics, 2006, 117 (2): 367–375. DOI:10.1542/peds.2005-0869 |
| [19] | Peltoniemi O, Kari MA, Heinonen K, et al. Pretreatment cortisol values may predict responses to hydrocortisone administration for the prevention of bronchopulmonary dysplasia in high-risk infants[J]. J Pediatr, 2005, 146 (5): 632–637. DOI:10.1016/j.jpeds.2004.12.040 |
| [20] | Stark AR, Carlo WA, Tyson JE, et al. Adverse effects of early dexamethasone in extremely-low-birth-weight infants. National Institute of Child Health and Human Development Neonatal Research Network[J]. N Engl J Med, 2001, 344 (2): 95–101. DOI:10.1056/NEJM200101113440203 |
| [21] | Vento G, Matassa PG, Zecca E, et al. Effect of dexamethasone on tracheobronchial aspirate fluid cytology and pulmonary mechanics in preterm infants[J]. Pharmacology, 2004, 71 (3): 113–119. DOI:10.1159/000077444 |
| [22] | Watterberg KL, Gerdes JS, Cole CH, et al. Prophylaxis of early adrenal insufficiency to prevent bronchopulmonary dysplasia:a multicenter trial[J]. Pediatrics, 2004, 114 (6): 1649–1657. DOI:10.1542/peds.2004-1159 |
| [23] | Groneck P, Speer CP. Inflammatory mediators and bronchopulmonary dysplasia[J]. Arch Dis Child Fetal Neonatal Ed, 1995, 73 (1): F1–F3. DOI:10.1136/fn.73.1.F1 |
| [24] | Watterberg KL, Gerdes JS, Gifford KL, et al. Prophylaxis against early adrenal insufficiency to prevent chronic lung disease in premature infants[J]. Pediatrics, 1999, 104 (6): 1258–1263. DOI:10.1542/peds.104.6.1258 |
| [25] | Van Goudoever JB, Wattimena JD, Carnielli VP, et al. Effect of dexamethasone on protein metabolism in infants with bronchopulmonary dysplasia[J]. J Pediatr, 1994, 124 (1): 112–118. DOI:10.1016/S0022-3476(94)70265-9 |
| [26] | Gibson AT, Pearse RG, Wales JK. Growth retardation after dexamethasone administration:assessment by knemometry[J]. Arch Dis Child, 1993, 69 (Spec No): 505–509. |
| [27] | Werner JC, Sicard RE, Hansen TW, et al. Hypertrophic cardiomyopathy associated with dexamethasone therapy for bronchopulmonary dysplasia[J]. J Pediatr, 1992, 120 (2 Pt 1): 286–291. |
 2017, Vol. 19
2017, Vol. 19