2. 北京大学儿童青少年卫生研究所, 北京 100191
现代辅助生殖技术(assisted reproductive technology, ART)解决了人类诸多生育问题,同时也增加了许多非生理的操作,这项技术的一系列操作有可能导致儿童印记基因表达异常[1]。近年来,不断有研究发现很多印记基因不仅影响胎盘的功能,而且对胎儿生长发育有影响,并且与青春期启动相关[2],因此ART过程可能影响儿童正常生长发育轨迹。随着ART出生儿童数量的增加,有关ART出生儿童生长发育的思考越来越多,但多集中在出生缺陷、出生体重以及神经系统异常风险等近期研究,远期研究甚少。虽然ART出生儿童的体格生长、智力发育均广泛为社会所关注,其生育能力也是儿科医师以及家长关心的问题[3],但由于ART出生儿童的年龄限制及远期随访研究难度较大,阻碍了ART出生儿童青春发育及妊娠潜能的研究。迄今为止,我国已开展ART技术28年,尚无ART出生儿童青春发育情况的研究报道。为此,本研究对ART出生儿童青春期性发育情况进行回顾性调查分析,旨在研究ART出生儿童青春发育情况。
1 资料与方法 1.1 研究对象通过使用“北京大学第三医院病案数字化管理信息系统”回顾性收集1994年7月至2003年10月在北京大学第三医院生殖医学中心通过体外受精-胚胎移植(in vitro fertilization and embryo transfer, IVF-ET)或卵胞浆内单精子显微注射技术(intracytoplasmic sperm injection, ICSI)受孕并在北京大学第三医院产科出生的儿童,且排除胎龄 < 32周早产儿及存在出生缺陷及遗传性疾病的病例。
以“2010年中国学生体质健康调查”[4-5] 85 513名女性和63 309名男性,共计148 822名正常青春期儿童横断面研究的结果为本研究的对照数据,这些调查对象以下简称为“对照人群”。
1.2 临床资料的获取查阅产科病历详细记录辅助实施ART母亲孕期的医疗情况,内容包括:分娩时年龄,怀孕胎数,出生儿童的胎龄、性别、出生日期、出生身长及出生体重等。
ART出生儿童青春期资料通过电话随访和函询获得。电话随访人员是经过培训的2名住院医师,她们按照指定好的电话随访模板和路径进行随访。电话模版由开场语、询问内容及健康教育三部分组成。根据可能出现的情况设计了3条路径:(1)按模版询问;(2)预约门诊随访;(3)简短问候,不再多加打扰。需要获得的青春期资料包括:月经初潮年龄、首次遗精年龄、学业情况及目前身高、体重(体重测量要求仅穿轻便单衣,身高测量为赤足并保持直立)。并邀请家长带研究对象到北京大学第三医院儿童保健中心进行一次身高、体重的测量,同时进行当面沟通。
1.3 记录指标的换算及相关标准体重指数(BMI)=体重除以身高的平方,单位为kg/m2,应用世界卫生组织研发用于评估世界青少年儿童生长发育情况的“WHO AnthroPlus”[6]软件计算BMI-Z评分。BMI-Z评分是根据总人口的平均值校正年龄偏差的特定BMI值,BMI-Z评分=(调查对象的BMI -所在年龄段BMI的平均值)/标准差。
超重、肥胖的诊断依据:采用中国肥胖问题工作组推荐的“中国学龄儿童青少年超重、肥胖筛查BMI值分类标准”定义超重和肥胖[7]。
1.4 统计学分析采用SPSS 18.0版本统计学软件进行统计学分析。正态分布的连续变量以均值±标准差(x±s)表示,分类变量以例(百分率)[n(%)]表示。采用概率单位回归法(probit analysis)计算月经初潮平均年龄和首次遗精平均年龄。在组间比较首次遗精或月经初潮的平均年龄时,采用Z检验方法进行分析;应用卡方检验比较ART出生儿童与自然受孕出生儿童的超重和肥胖检出率;应用多元线性回归分析方法,分析首次遗精或月经初潮的平均年龄与BMI及其他相关因素的关系。P < 0.05为有统计学意义。
2 结果 2.1 一般情况1994年7月至2003年10月间在北京大学第三医院生殖中心通过IVF-ET或ICSI技术受孕并在北京大学第三医院产科分娩的母亲共计156位,出生儿童211例,男106例,女105例。其中胎龄 < 32周病例4例,均为女孩;先天心脏畸形7例,男孩5例,女孩2例,包括肺动脉狭窄合并动脉导管未闭(patent ductus arteriosus, PDA)、房间隔缺损(atrial septal defect, ASD)合并PDA、室间隔缺损(ventricular septal defect, VSD)合并PDA、法洛四联症合并PDA及ASD各1例,单纯ASD 3例;没有发现存在遗传性疾病的出生儿童。本研究中将此11例早产儿及有先天畸形的新生儿剔除,计划纳入研究对象200例,男性病例101例,女性病例99例。
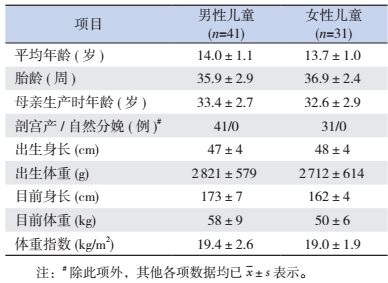
对156例ART母亲函询50例,退回信件38封,12封信件2个月无回复。对计划纳入的200例ART儿童的母亲进行电话随访,随访结果如下:婴儿期死亡病例5例(2.5%),拒绝接受随访25例(12.5%),2次不同时间段拨打电话无人接听9例(4.5%),电话号码更换为其他人6例(3.0%),电话号码为空号83例(41.5%);电话随访获得信息者共72例儿童(36.0%),其中IVF-ET出生69例,ICSI出生3例,随访率为36.0%(72/200)。72例儿童中,男性41例,平均年龄为14.0±1.1岁(范围:13~20岁);女性31例,平均年龄为13.7±1.0岁(范围:13~18岁)。72例儿童包括:单胎41例,其中男性儿童22例,女性儿童19例;双胎14例,其中男性双胎7例,女性双胎4例,一男一女双胎3例;三胎1例,为2男1女。获得随访的72例儿童的一般资料见表 1。
| 表 1 获得随访的儿童的一般资料 |
72例电话随访儿童中有8例进行了二次回访,并预约到儿科门诊,由专人进行体检,测量身高、体重,所得结果与电话随访所得数据相符,平均身高相差 < 2 cm,体重相差 < 0.5 kg。
根据家长所述研究对象在学校中学习情况划分为5个等级:优秀、良好、中等、及格、不及格。72例儿童中,优秀20例(28%),良好36例(50%),中等14例(19%),及格1例(1%),不及格1例(1%)。
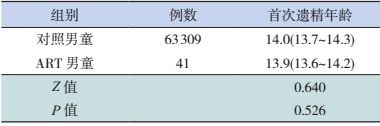
2.2 青春期发育情况ART出生的41名男性儿童,首次遗精年龄为13.9岁,95%置信区间(CI)为13.6~14.2岁;对照人群中男性青春期儿童的首次遗精年龄为14.0岁,95%CI为13.7~14.3岁,两者比较差异无统计学意义(P=0.526),见表 2。
| 表 2 ART出生男童与对照人群男童首次遗精年龄的比较 [均值(95%CI),岁] |
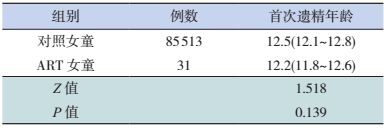
ART出生的31名女性儿童,月经初潮年龄为12.2岁,95%CI为11.8~12.6岁;对照人群中女性青春期儿童的月经初潮年龄为12.5岁,95%CI为12.1~12.8岁,两者比较差异无统计学意义(P=0.139),见表 3。
| 表 3 ART出生女童与对照人群女童月经初潮年龄的组间比较 [均值(95%CI),岁] |
2.3 ART出生儿童的超重/肥胖率
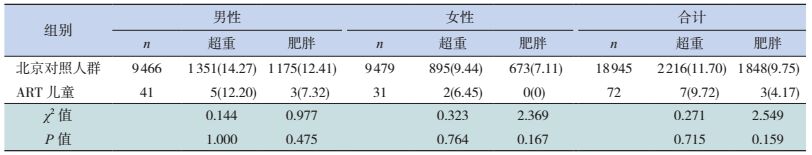
根据中国肥胖问题工作组(WGOC)推荐的中国学龄儿童青少年超重、肥胖筛查BMI值分类标准[7],本研究所随访的全部72名ART出生儿童中,肥胖儿童3名(4%),超重儿童7名(10%);其中41名男性儿童中,肥胖儿童3名(7%),超重儿童5名(12%);31名女性儿童中,无肥胖儿童,超重儿童2名(6%)。将ART出生儿童超重、肥胖率与2004年北京市儿童青少年超重和肥胖检出率[8]进行比较,两组差异无统计学意义,见表 4。
| 表 4 ART出生儿童与北京市儿童青少年超重和肥胖率比较 [n(%)] |
2.4 ART超重/肥胖儿童与正常体重儿童青春期发育状况的比较
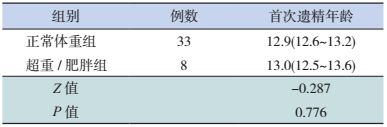
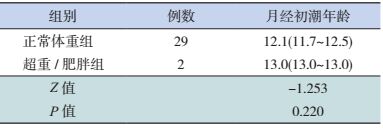
按性别将ART出生儿童分为男性、女性超重/肥胖组(因样本量少,将超重、肥胖合并分析),分别与ART出生的正常体重组的首次遗精年龄或月经初潮年龄进行比较,差异均无统计学意义(表 5~6)。
| 表 5 ART出生男童中正常体重组与超重/肥胖组的首次遗精年龄的比较 [均值(95%CI),岁] |
| 表 6 ART出生女童中正常体重组与超重/肥胖组的月经初潮年龄的比较 [均值(95%CI),岁] |
2.5 影响青春期发育的相关因素分析
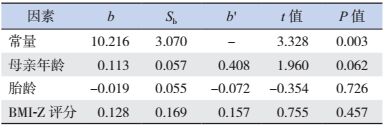
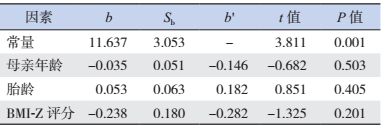
根据世界卫生组织2007年的参考数据,计算得到ART出生儿童BMI-Z评分,其中男性儿童的BMI-Z评分为0.12±0.91,女性儿童的BMI-Z评分为-0.27±0.80。运用多元线性回归分析首次遗精年龄或月经初潮年龄与母亲生产时年龄、儿童出生时胎龄、儿童的BMI-Z评分之间的关系,发现ART出生儿童青春期发育情况与母亲生产时年龄、胎龄、儿童的BMI均无明显线性关系(表 7~8)。
| 表 7 首次遗精年龄与母亲年龄、胎龄、BMI-z评分的多元线性回归分析 |
| 表 8 月经初潮年龄与母亲年龄、胎龄、BMI-Z评分的多元线性回归分析 |
3 讨论
ART是指对配子、胚胎或者基因物质进行体外系统操作而获得新生命的技术。近30年来,国内ART发展突飞猛进,其范围已从单纯的不孕症治疗扩展到对人类配子进行筛选和优选,由于个体发育、疾病等原因,不能自然受孕的夫妻,不得不通过人工操作的方法促进精子和卵子的结合,产生、孕育新一代个体。狭义的生殖工程技术主要指IVF-ET及其衍生技术,如ICSI技术等[9]。表观遗传研究显示,配子在发生过程中印记基因将发生甲基化擦除和重新建立,在种植前后维持甲基化,而ART技术正是在配子发生、受精及种植前后阶段操作配子和胚胎,这一时期恰恰是印记基因甲基化重新编程的关键时期,因此近年来不断有科学家提出ART的一系列操作有可能导致儿童印记基因表达异常[10]。
近年来有关儿童特发性中枢性性早熟的研究发现,青春期提前启动与位于15q11-q13印记区域基因突变或表达异常密切相关,且性早熟儿童成年后慢性疾病发生明显增加[2, 11]。MKRN3是新近发现与青春期提前启动相关的基因,该基因是一个母系印记、父系表达的基因,位于染色体15q11-q13[12]。MKRN3缺陷是最常见的家族性中枢性性早熟的遗传因素[2, 12]。基于ART过程可能会影响表观遗传假设,ART出生儿童青春发育也可能会有别于自然妊娠儿童,但目前国际上有关ART出生儿童青春期发育情况报道甚少,国内虽然ART技术开展已有28年,然而,迄今为止尚未见ART出生儿童青春发育情况的报道。为此,本研究对ART出生儿童的青春发育情况进行了初步调查分析。
本研究对200例ART儿童回访,得到72例有效问卷,有效率为36.0%。对有效问卷分析发现,男性首次遗精年龄为13.9岁(95%CI:13.6~14.2岁),女性月经初潮年龄为12.5岁(95%CI:11.8~12.6岁)。本研究未发现青春期提前及延后的病例;母亲的年龄、儿童出生胎龄、儿童目前的BMI-Z评分与首次遗精年龄或月经初潮年龄未发现有相关性。
2011年,Beydoun等[13]对173例18~26岁IVF青年进行回顾性分析,未发现IVF青年存在青春发育异常,本研究结果与之一致。Beydoun等[13]对其中93例女性分析还发现,IVF女性的青春发育年龄与其BMI呈负相关,青春期启动年龄越早成年后BMI越高,提示青春期启动的年龄可以用来预测女性IVF儿童成年后的BMI值。本研究未发现ART出生女性儿童月经初潮年龄及男性儿童首次遗精年龄与BMI之间有相关性,是否与本研究纳入样本量较少有关,还需继续收集病例进一步分析。2011年Kleber等[14]对德国1 363名10~16岁自然受孕出生儿童进行随访研究,也未发现青春发育年龄与其BMI值呈负相关的关系。
Beydoun等[13]的研究还发现IVF儿童中男孩青春发育启动年龄(12.3岁)要明显晚于女孩(11.5岁)。在自然受孕出生儿童中,男童的青春发育也要晚于女童,与ART出生儿童一致。据2010年调查,中国女童月经初潮年龄为12.47岁,95%CI为12.1~12.8岁[4];男童首次遗精年龄为14.03岁,95%CI为13.7~14.3岁[5]。本研究也显示ART儿童男性遗精年龄要晚于女孩月经初潮年龄。2008年Ceelen等[15]对233例IVF儿童进行青春发育研究,其中男孩113例,女孩118例,并与自然受孕组配对比较,发现IVF女孩儿童的骨龄较自然受孕组提前,但是男孩中却不存在这种现象。而且与自然受孕组比较,在IVF女童中发现硫酸脱氢表雄酮和黄体生成素(LH)激素水平增高。本研究未对骨龄及激素水平情况进行探讨,还需后续研究。
Rojas-Marcos等[16]描述了7例年龄在5~21个月出现乳房发育及阴毛的ART出生儿童,通过内分泌检查、盆腔超声检查证实存在青春期发育前状态,然而在后期临床随访中未发现乳房发育进程异常、阴毛早现和性激素水平的升高。本研究中未追问到婴儿期有乳房发育及阴毛的病例。但是,Belva等[17]在布鲁塞尔生殖医学中心进行的14年前瞻性队列研究中发现,虽然ICSI组平均月经初潮年龄(13.1±1.2岁)与自然受孕组(13.1±1.4岁)差异无统计学意义,但101例ICSI女孩的乳房发育比108例自然受孕组女孩发育时间要早,并且除外了可能存在的混杂因素,如目前的年龄、BMI值、出生胎龄、出生体重、胎数、母亲的教育水平、母亲的月经初潮年龄等。
Neville等[18]在对89名明确阴毛初现的儿童的回顾性研究发现,早产儿、小于胎龄儿可能与阴毛早现有关,为了避免早产及宫外发育迟缓对青春启动的影响,本研究剔除了胎龄 < 32周的早产儿。
近20多年由于我国经济飞速发展,居民的居住环境及通讯方式均发生了巨大变化,本研究中许多ART出生儿童的父母在入院当时留下的联系方式、联系地点已经更换,部分家长不希望被他人知道自己的孩子是ART出生儿童,刻意更换电话,或拒绝回答问题均导致本研随访率偏低。Beydoun等[13]通过信件邮寄的方式,对美国弗吉尼亚州560例年龄为18~26岁的IVF-ET出生的儿童青少年进行随访调查,获得有效问卷173例,随访率为30.9%,与本研究中电话随访所得随访率相当。Ceelen等[15]对荷兰553例年龄为8~18岁的IVF-ET出生的儿童青少年进行回顾性调查青春发育情况,获得有效问卷233份,随访率为69%。Belva等[17]在布鲁塞尔生殖医学中心对217例单胎白种人进行ICSI儿童持续14年的前瞻性队列研究中,随访率为56%。由此可见,国外研究的随访率在30.9%~69%之间。我国首例试管婴儿出生于1988年,多年来未曾关注ART出生儿童的远期随访问题,因此,在本研究之后,相信能够引起生殖医学医师、儿科医师、内分泌医师的充分重视,关注这一人群的各年龄生长发育情况。
综上所述,本研究显示,ART出生儿童的青春期发育未出现延迟或提前,与正常对照人群一致;ART出生儿童青春期发育与其青春期BMI无显著相关性。但本研究是回顾性研究,存在一定局限性,且样本量较少,随访率低,可能存在选择偏倚,今后还需进一步扩大样本量随访验证。
| [1] | Manning M, Lissens W, Bonduelle M, et al. Study of DNA-methylation patterns at chromosome 15q11-q13 in children born after ICSI reveals no imprinting defects[J]. Mol Hum Reprod, 2000, 6 (11): 1049–1053. DOI:10.1093/molehr/6.11.1049 |
| [2] | Bulcao Macedo D, Nahime Brito V, Latronico AC. New causes of central precocious puberty:the role of genetic factors[J]. Neuroendocrinology, 2014, 100 (1): 1–8. DOI:10.1159/000366282 |
| [3] | Fisher-Jeffes LJ, Banerjee I, Sutcliffe AG. Parents' concerns regarding their ART children[J]. Reproduction, 2006, 131 (2): 389–394. DOI:10.1530/rep.1.00842 |
| [4] | Song Y, Ma J, Wang HJ, et al. Trends of age at menarche and association with body mass index in Chinese school-aged girls, 1985-2010[J]. J Pediatr, 2014, 165 (6): 1172–1177. DOI:10.1016/j.jpeds.2014.08.013 |
| [5] | Song Y, Ma J, Wang HJ, et al. Age at spermarche:15-year trend and its association with body mass index in Chinese school-aged boys[J]. Pediatr Obes, 2016, 11 (5): 369–374. DOI:10.1111/ijpo.v11.5 |
| [6] | World Health Organization. WHO Reference 2007 SPSS macro package[EB/OL]. (June 19, 2014). http://www.who.int/entity/growthref/tools/readme_spss.pdf. |
| [7] | 中国肥胖问题工作组. 中国学龄儿童青少年超重、肥胖筛查体重指数值分类标准[J]. 中华流行病学杂志, 2004, 25 (2): 97–102. |
| [8] | 米杰, 程红, 侯冬青, 等. 北京市2004年2~18岁儿童青少年超重和肥胖流行现状[J]. 中华流行病学杂志, 2006, 27 (6): 469–474. |
| [9] | 苏萍. 绪论[M]//乔杰. 生殖工程学. 第7版. 北京: 人民卫生出版社, 2007: 1-5. |
| [10] | Uh KJ, Park CH, Choi KH, et al. Analysis of imprinted IGF2/H19 gene methylation and expression in normal fertilized and parthenogenetic embryonic stem cells of pigs[J]. Anim Reprod Sci, 2014, 147 (1-2): 47–55. DOI:10.1016/j.anireprosci.2014.03.020 |
| [11] | Perry JR, Day F, Elks CE, et al. Parent-of-origin-specific allelic associations among 106 genomic loci for age at menarche[J]. Nature, 2014, 514 (7520): 92–97. DOI:10.1038/nature13545 |
| [12] | 蔡春艳. 青春发育提前的相关基因研究进展[J]. 国际儿科学杂志, 2014, 41 (1): 48–50. |
| [13] | Beydoun HA, Sicignano N, Beydoun MA, et al. Pubertal development of the first cohort of young adults conceived by in vitro fertilization in the United States[J]. Fertil Steril, 2011, 95 (2): 528–533. DOI:10.1016/j.fertnstert.2010.04.057 |
| [14] | Kleber M, Schwarz A, Reinehr T. Obesity in children and adolescents:relationship to growth, pubarche, menarche, and voice break[J]. J Pediatr Endocrinol Metab, 2011, 24 (3-4): 125–130. |
| [15] | Ceelen M, van Weissenbruch MM, Vermeiden JP, et al. Pubertal development in children and adolescents born after IVF and spontaneous conception[J]. Hum Reprod, 2008, 23 (12): 2791–2798. DOI:10.1093/humrep/den309 |
| [16] | Rojas-Marcos PM, David R, Kohn B. Hormonal effects in infants conceived by assisted reproductive technology[J]. Pediatrics, 2005, 116 (1): 190–194. DOI:10.1542/peds.2004-2553 |
| [17] | Belva F, Roelants M, Painter R, et al. Pubertal development in ICSI children[J]. Hum Reprod, 2012, 27 (4): 1156–1161. DOI:10.1093/humrep/des001 |
| [18] | Neville KA, Walker JL. Precocious pubarche is associated with SGA, prematurity, weight gain, and obesity[J]. Arch Dis Child, 2005, 90 (3): 258–261. DOI:10.1136/adc.2004.053959 |
 2017, Vol. 19
2017, Vol. 19